氯喹通过激活P38MAPK通路诱导人肝癌HepG2细胞凋亡
2018-12-07丁文评陆元元童文侠周蔼斌陈意红
丁文评,陆元元,童文侠,周蔼斌,孔 祥,陈意红,*
(1.皖南医学院弋矶山医院放疗科,安徽 芜湖241001;2.皖南医学院弋矶山医院内分泌科,安徽 芜湖 241001)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化道肿瘤之一,其恶性程度高,严重威胁人类健康。根据2012年癌症数据统计,全球每年肝癌新发病例数达到78.2万,而我国的肝癌新发病例数为39.5万,约占全球发病例数的一半[1-2]。目前,手术是肝癌的主要治疗手段,介入、化疗和靶向药物等治疗手段是重要的补充。但多数患者肝癌发现时已属中晚期,治疗效果欠佳。因此,肝癌的治疗仍是难题,探寻新的药物显得尤为迫切。但研发新药耗时长,价格昂贵,若以“老药”为基础探索其潜在的抗肿瘤机制,将其变成抗肿瘤“新药”,则可为肿瘤治疗带来新的思路[3]。
氯喹(chloroquine,CQ)既往广泛应用于疟疾、炎症和病毒感染性疾病的治疗[4-6],近年来,由于其抗肿瘤作用备受学者关注。目前,氯喹的抗肿瘤机制大多集中在其对自噬(autophagy)的抑制作用,从而使肿瘤细胞难以抵抗不利环境[7]。有研究表明,氯喹可抑制肝癌细胞的增殖和诱导细胞凋亡[8],但氯喹抗肿瘤的具体作用机制尚不清楚。P38丝裂原活化蛋白激酶(P38 mitogenactivated protein kinase,P38MAPK)通路在肿瘤的发生发展中发挥重要作用,本研究将氯喹作用于肝癌细胞株后观察细胞凋亡情况和P38MAPK蛋白表达的变化,初步探讨其可能的机制,为肝癌的治疗提供新方法。
1 材料与方法
1.1 主要材料和细胞
人肝细胞株HepG2购自中国科学院上海生命科学研究院细胞资源中心;氯喹和四甲基噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)粉剂购自美国Sigma公司(均溶解于PBS溶液);DMEM培养基购自美国Hyclone公司;胎牛血清和胰蛋白酶均购自美国Gibco公司;鼠抗人P-P53、Bcl-2和Bax抗体均购自美国Santa Cruz公司;兔抗人P38MAPK、P-P38MAPK和Caspase-3抗体均购自美国Cell Signaling公司;4´,6-二脒基-2-苯基吲哚(4´,6-diamidino- 2-phenylindole,DAPI)染色液、Annexin V-FITC细胞凋亡检测试剂盒、BCA蛋白浓度测定试剂盒、蛋白裂解液、SDS-PAGE凝胶配制试剂盒、鼠抗人Actin抗体、HRP标记的山羊抗兔抗体和HRP标记的山羊抗小鼠抗体均购自中国碧云天公司;ECL超敏发光液和PVDF膜购自美国Millipore公司。
1.2 实验方法
1.2.1 细胞培养 用含10%胎牛血清的DMEM培养基培养HepG2细胞,并置于37 ℃、CO2体积分数为5%、饱和湿度培养箱中,隔天传代1次,选择呈对数生长期的细胞用于后续实验。
1.2.2 MTT法检测细胞增殖情况 将HepG2细胞接种于96孔板中,接种细胞密度为5×104/mL,待细胞过夜贴壁后加药,分为空白组(仅含DMEM培养基,不含细胞)、对照组(加等体积PBS)和实验组(氯喹终浓度分别为10、20和40 μmol/L)。加药继续培养24、48和72 h后,加入0.5%的MTT溶液10 μL,作用4 h后,再加10%的SDS溶液150 μL,室温下溶解过夜,用酶标仪检测各孔吸光度D(562)值,计算细胞相对存活率。
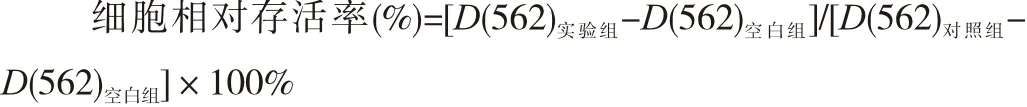
1.2.3 DAPI染色观察细胞核形态变化 取对数生长期的HepG2细胞接种到24孔板中,接种细胞密度为2×105/mL,过夜贴壁后,分别向细胞中加入不同浓度(0、10、20和40 μmol/L)的氯喹,继续培养24 h。用4%多聚甲醛固定后,进行DAPI 荧光染色,于倒置荧光显微镜下观察细胞核的形态学变化。
1.2.4 流式细胞术检测细胞凋亡情况 将HepG2细胞接种到6 cm培养皿中,接种细胞密度为2×105/mL,待过夜贴壁后,分别加入不同浓度(0、10、20和40 μmol/L)氯喹,继续培养24 h。收集全部细胞(包括悬浮和贴壁的细胞),调整细胞悬液至1×106/mL后,按凋亡试剂盒步骤分别加入Annexin V和PI染料后在流式细胞仪上检测,统计细胞凋亡率。结果判断:无染色细胞(左下象限,Q4)为正常细胞;Annexin V单染(右下象限,Q3)为早期凋亡细胞;PI单染(左上象限,Q1)为细胞碎片;Annexin V和PI双染(右上象限Q2)为晚期凋亡细胞。
1.2.5 Western blot法检测相关蛋白的表达 将HepG2细胞接种到6 c m培养皿中,接种细胞密度为2×105/mL,待过夜贴壁后,加入不同浓度(0、10、20和40 μmol/L)氯喹,24 h后提取细胞总蛋白,BCA法测定细胞裂解物蛋白浓度。每组取50 μg蛋白样品加入SDS-PAGE凝胶中电泳,再湿转至PVDF膜上,常温下脱脂奶粉封闭后,分别加入一抗溶液(Actin,1∶2 000;P-P53、Bcl-2、Bax、P38MAPK、P-P38MAPK 和Caspase-3均为1∶1 000) 4 ℃孵育过夜。洗膜后,滴加相应的二抗溶液(HRP标记的山羊抗兔或山羊抗小鼠抗体)室温下孵育1 h 。洗膜后加入ECL超敏发光液后显影。
1.3 统计学方法
2 结 果
2.1 氯喹对HepG2细胞增殖的影响
MTT实验结果如图1所示。当用不同浓度(10、20和40 μ mol/L)氯喹处理HepG2细胞时,24 h 后10 μ mol/L氯喹对HepG2细胞增殖抑制作用不明显(P>0.05);当氯喹浓度增加到 20和40 μmol/L时,对细胞增殖均有明显抑制作用(P<0.05);当处理HepG2细胞48和72 h后,10~ 40 μmol/L氯喹对细胞均有明显抑制作用(P<0.05),见图1。
2.2 氯喹对HepG2细胞核形态的影响
在荧光倒置显微镜下观察发现,对照组肝癌细胞核完整,呈均匀微弱的淡蓝色荧光,细胞核固缩少见(图2A);当氯喹作用细胞后,细胞核出现固缩、致密的强蓝色荧光,提示细胞发生凋亡,并随着药物浓度的增加,这种含固缩、紧密蓝色荧光的细胞核逐渐增加,提示凋亡细胞数增加(图2B~D)。
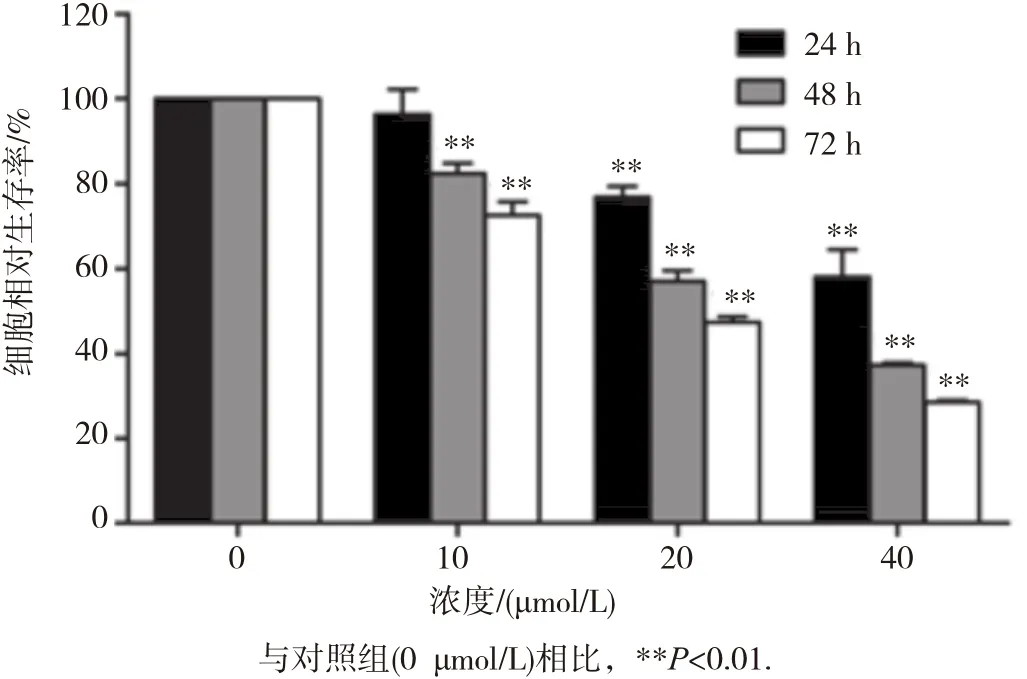
图1 氯喹对人肝癌HepG2细胞增殖能力的影响
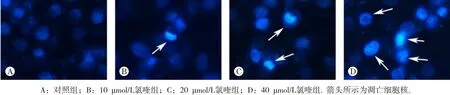
图2 氯喹对人肝癌细胞HepG2细胞核形态的影响(×200)
2.3 氯喹对HepG2细胞凋亡的影响
用不同浓度氯喹处理HepG2细胞24 h后,流式细胞仪对细胞进行凋亡分析的结果见图3。对照组凋亡率 (2.51± 0.63)%, 10、 20和 40 μmol/L氯 喹 实 验 组HepG2 细 胞 凋 亡 率 分 别 是(5.58±1.14)%、 (9.21±0.97)%和(22.54+2.53)%,实验组细胞凋亡率随着氯喹浓度的增加而增加,较对照组均明显升高,差异具均有统计学意义(P<0.05或P<0.01)。
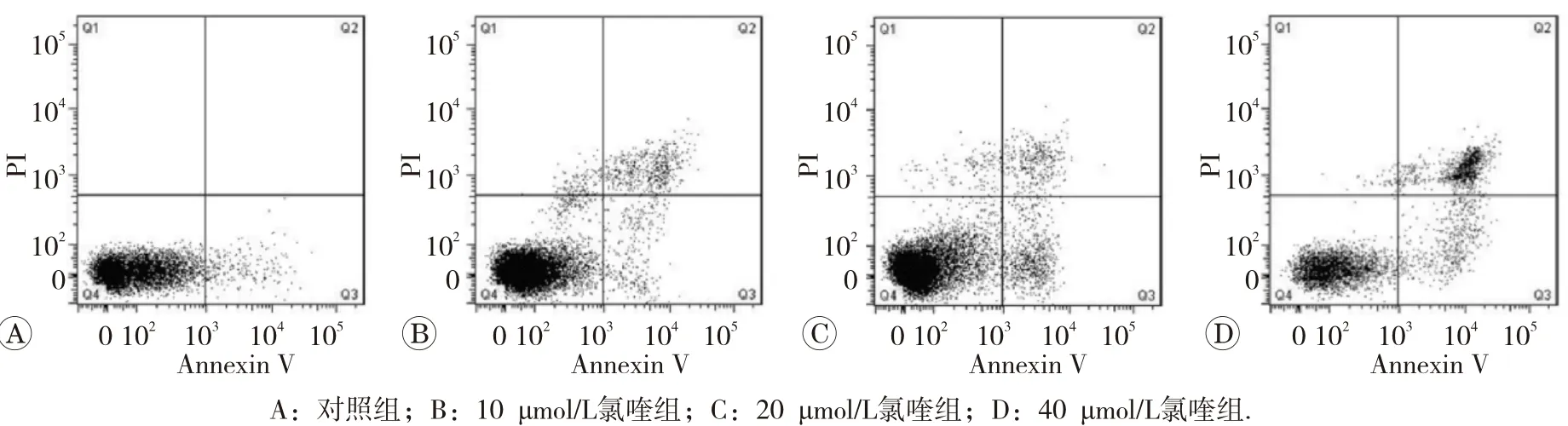
图3 氯喹对人肝癌细胞HepG2细胞凋亡的影响
2.4 氯喹对HepG2细胞凋亡相关蛋白表达的影响
Western blot检测HepG2细胞中Caspase-3、Bax和Bcl-2蛋白的表达情况,如图4所示。当氯喹处理细胞24 h后,Caspase-3蛋白的表达量未发生明显变化,但其剪切后活化型Caspase-3的表达量上升(图4A)。随着氯喹浓度的升高,促凋亡蛋白Bax的表达量逐渐增加,而抗凋亡蛋白Bcl-2的表达量降低(图4B)。
2.5 氯喹对HepG2细胞P38MAPK通路蛋白表达的影响
用氯喹处理HepG2细胞24 h后,随着药物浓度的增加,细胞中P38MAPK蛋白均无明显增加;而在20和40 μmol/L氯喹处理时,磷酸化的P38MAPK和磷酸化的P53蛋白的表达水平均显著升高(图5)。
3 讨 论
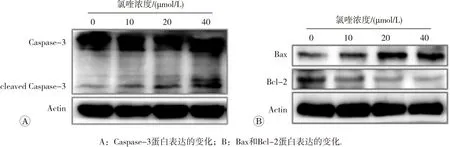
图4 氯喹对HepG2细胞凋亡相关蛋白表达的影响
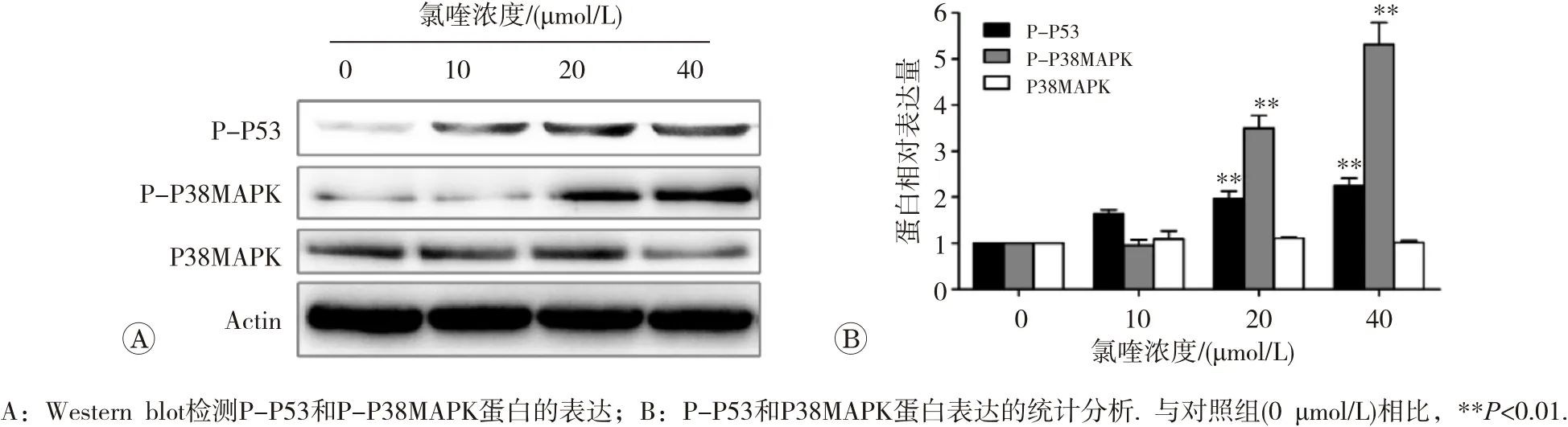
图5 氯喹对HepG2细胞P38MAPK通路蛋白表达的影响
氯喹作为经典的抗疟药物还广泛应用于病毒感染、自身免疫系统疾病和癌症等疾病上[9-10]。研究表明,氯喹可改变溶酶体内的pH值从而阻断了自噬作用发挥抗肿瘤作用,因为自噬可以帮助肿瘤细胞抵抗不良生存环境以及放化疗[11-14]。随着研究的深入,发现氯喹的抗肿瘤作用机制还涉及诱导凋亡、肿瘤干细胞的清除和促进肿瘤血管正常化等[15-16]。目前有少量文献报道氯喹可诱导肝癌细胞的凋亡和引起细胞周期阻滞,其机制可能与Caspase活化和 miRNA调控等有关[8,17-18]。但氯喹在肝癌中的抗肿瘤机制仍不明确,需要我们进一步探索和证实。本研究中,为明确氯喹的抗肿瘤作用,我们通过体外实验观察了氯喹对肝癌细胞株HepG2增殖的影响。我们发现氯喹可抑制其生长,并能诱导细胞凋亡,随着药物浓度的增加,这种作用更加明显。
丝裂原活化蛋白激酶 (mitogen activated protein kinases,MAPKs)是一类丝氨酸/苏氨酸蛋白激酶,它们在细胞的增殖、分化和凋亡等过程中发挥重要作用[19]。P38MAPK也称为 RK或 CSBP,它是酵母HOG激酶的哺乳动物同源基因,作为MAPKs家族中重要的组成部分,与肿瘤的发生、发展和转移等密切相关,它主要通过调控下游多种酶及转录因子的基因表达活性发挥生物细胞学效应[20]。有研究表明,在诸如化学药物、紫外线、射线和细胞因子等外界因素的刺激下,P38MAPK信号通路能被激活并加速细胞的凋亡[21]。我们研究发现,氯喹可引起磷酸化P38MAPK蛋白表达增加,而磷酸化P38MAPK是发挥生物学作用的活化状态,可磷酸化下游的转录因子,调控细胞增殖、分化和凋亡。作为P38MAPK下游的P53基因被称为明星抑癌基因,其激活的方式是以蛋白的磷酸化实现,磷酸化后的P53可通过引发细胞周期阻滞和诱导凋亡等来抑制肿瘤细胞的生长[22]。而Bcl-2家族和Caspase家族与P53介导的凋亡有关[23]。Bax基因发挥促凋亡作用,而Bcl-2则发挥相反作用。Caspase蛋白作为细胞凋亡的功能执行者,在凋亡后期发挥重要作用[24]。本研究发现,氯喹作用肝癌细胞后,磷酸化的P53蛋白表达增加,活化型Caspase-3的表达量显著上升,Bax的表达量增加,而抗凋亡蛋白Bcl-2的表达量却降低。这说明,P38MAPK可通过活化P53后调控Bax、Bcl-2和Caspase-3等诱导肝癌细胞发生凋亡。
综上所述,氯喹可能是通过激活P38MAPK来活化下游凋亡信号通路,促进肝癌HepG2细胞的凋亡。然而氯喹是直接作用于P38MAPK信号分子还是通过调节其上游信号分子发挥作用仍不清楚,尚需进行更深入的研究和探索。
