基于“课标” 着眼“素养”——高三化学复习要重视课堂中学生的参与度
2018-12-06颜建河代景坤
颜建河 代景坤
河北
随着新《课程标准》的全面实施,贯彻新理念、全面考查学生的能力,尤其是对实践能力和创新能力的考查,成为今后高考命题改革的方向。基于此,在高三化学学科复习进程中,要改变传统中不适应新形势的复习方法,要抓纲务本,回归教材,特别是要重视课堂复习中学生的参与度。这是因为重视学生基础知识的复习(学习)和基本技能的培养,重视知识的内在联系和实际运用,使教材的知识内容在新的教学(复习)环境中升华,才能达到举一反三,纠正高三复习中片面追求“新、奇、怪”的现象,改变过去教学中“考什么教什么”的现象,杜绝死记硬背,防止“题海战术”,有效减轻高中生过重的学业负担,实现高效复习,提升学生素养。
一、抓“基础”,复习中要重视让学生参与化学概念、定义建立的全过程,强化思维严密性的培养
化学概念或化学理论是在反复实验的基础上进行归纳总结,推导出来的。教材上的定义常隐去概念形成的思维过程,教师在复习中要积极引导学生参与化学概念建立的全过程,促使学生真正理解概念的来龙去脉,准确把握概念的本质。例如,在复习氧化还原反应的概念等相关内容时,可按以下几步进行:
第一步,何为物质的氧化性、还原性?(1)氧化性:物质具有得电子能力的性质,表现为元素化合价降低;(2)还原性:物质具有失电子能力的性质,表现为元素化合价升高。
第二步,在某条件下,强氧化性物质遇到强还原性物质会怎样?自发进行氧化还原反应。
第三步,何为氧化还原反应?(1)表现:元素化合价有变;(2)本质:电子发生转移;(3)规律:得电子和失电子同步进行,故其电子转移数相等。
第四步,氧化还原反应的一般形式如下:

(1)试分别填写在c值增大的过程中,不同c值范围内被氧化的离子的物质的量。
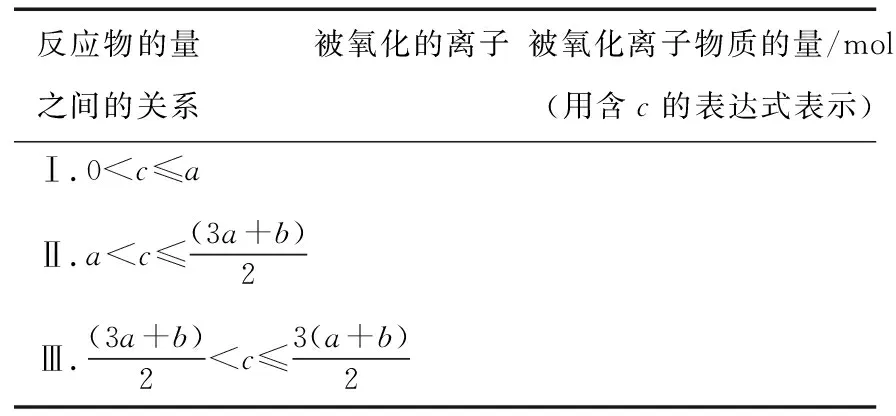
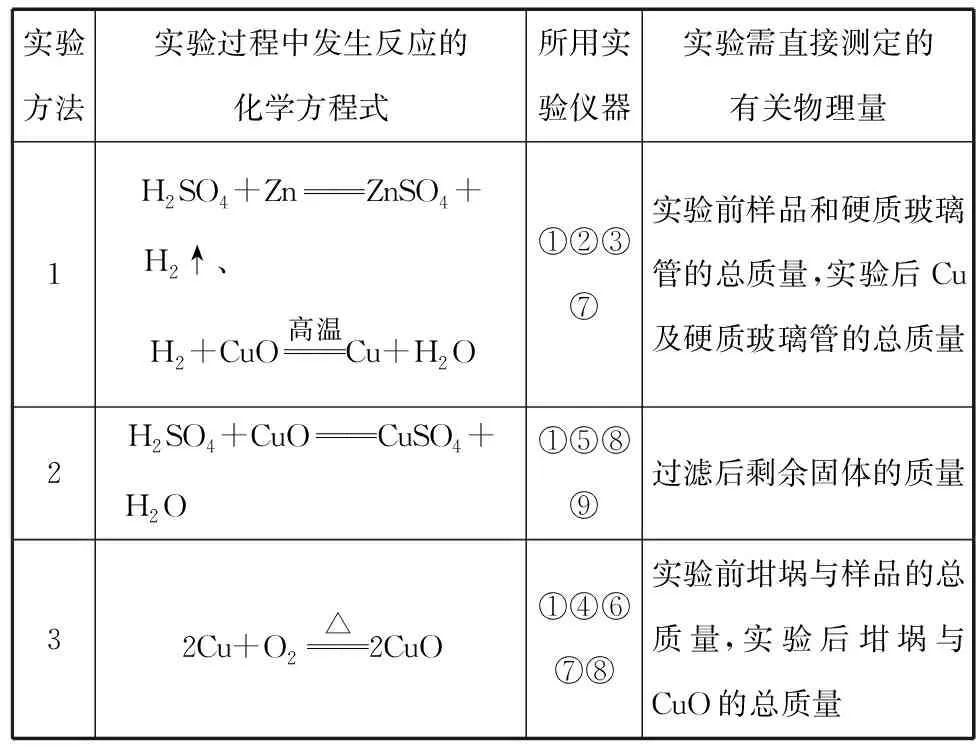
反应物的量之间的关系被氧化的离子被氧化离子物质的量/mol(用含c的表达式表示)Ⅰ.0 (2)写出Ⅲ情景时的计算推理过程。 分析与解答:本题是一道涉及氧化还原反应知识的计算题,有一定难度。然而,只要认真分析题意,就会发现其解答关键就是不能忽视氧化还原反应的次序规律,抓住次序规律与“量”的关系,这样题中的问题便可迎刃而解。根据题给反应方程式及次序规律可知,氧化性强弱次序为Cl2>Br2>Fe3+>I2;还原性强弱次序为I->Fe2+>Br->Cl-。又知amol FeI2和bmol FeBr2的混合溶液中含有(a+b) mol Fe2+、2amol I-和2bmol Br-。 这样的复习方法,学生参与复习的全过程,采用设问、简答方式,对所学知识进行锤炼,知识主线清晰、过程简捷、内容完整,能准确把握核心知识。同时,通过分析、类比的方法,还能找出拓展知识与教材知识之间的联系和区别,实现知识的迁移运用,做到学以致用,复习效率高且效果好。 学生在参与课堂教学中必然暴露一些问题或错误,教师要及时引导学生参与剖析这些错误,并找出问题的症结所在。为此,在化学复习中,一定要抓“问题”,给学生思考的时间,引导学生弄清问题,寻找解题的突破口。例如,“考纲”明确了化学实验与探究能力的考查范畴,实验是理科发展的最重要动力之一。这就要求复习中要强化实验,要亲自动手去做,提高独立操作能力。同时,要善于运用理论,依据指定目标,灵活设计实验,掌握“探究方法”。其切入点就是从实验原理入手,结合相关元素及其化合物知识去理解实验步骤,找到解决问题的途径。 为了证明是哪一种反应发生,某同学设计并实施了下列实验,请填写下列空白: 【实验Ⅰ】该同学选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸、试管若干、胶头滴管若干。从选择的药品分析,该同学设计这个实验的目的是_____________________。 【实验Ⅱ】取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红褐色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是________。向红褐色“液体”中逐滴加入稀盐酸至过量,可以观察到的现象是__________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生血红色现象的离子方程式是__________。 【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是__________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是____________________。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是① ___________;②__________。 对于【实验Ⅰ】来说,从选择的药品分析,该同学设计这个实验的目的是检验Na2SO3是否变质(或检验Na2SO3溶液是否混有Na2SO4)。 这样的复习方法,学生参与问题反思,是弥补思维缺点,培养思维广阔性的最有效途径之一。这是因为反思问题的途径,有助于学生对化学问题进行深入地分析和理解,从多层次多角度去联想、思考、探索,注重细节,开拓思维。同时,让学生带着问题去修正教材的不足,学生才能知其所以然,在这个过程中,学生既重视对教材知识的复习,又能带着疑问去深刻理解教材。 高考理综化学所考查的能力和能力的品质包括观察能力、实验能力、思维能力和自学能力,其中“观察能力”和“实验能力”是基础,“思维能力”是关键,“自学能力”才是目的。学生参与课堂教学时,教师要与学生一起对解法的优劣进行评价,使学生从比较中学习一些快速简捷的解题方法,提高学生巧解巧算的能力,从而提高学生的灵活性。例如,强化对实验原理和操作过程的深入思考,需要在实验复习过程中有意识地设计问题,激发思考,培养探究、迁移和创新能力。 例3实验室里有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂设计两种测定该样品(已称知其质量为mg)中氧化铜的质量分数的方法,并填入表格中要求填写的有关内容。 实验方法实验过程中发生反应的化学方程式所用实验仪器实验需直接测定的有关物理量123 实验可能用到的主要仪器:①托盘天平 ②启普发生器 ③硬质玻璃管 ④泥三角 ⑤烧杯 ⑥坩埚 ⑦酒精灯 ⑧玻璃棒 ⑨漏斗 ⑩干燥管 实验可能用到的试剂:a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸 分析与解答:本题是一道最基础实验含量测定试题,所涉及的知识非常基础,可谓起点低,但由于其途径(方法)的多样性,导致试题考查学生的能力层次非常高,有一定的难度。为此,要解决好这类问题,学生必须熟悉中学课本中测定混合物含量的实验方法,大胆思维,就不难依据所给的实验仪器、药品,筛选多种确实可行的基本实验方法,来确定混合物(CuO和Cu)样品中氧化铜的质量分数。其正确答案如下: 实验方法实验过程中发生反应的化学方程式所用实验仪器实验需直接测定的有关物理量1H2SO4+ZnZnSO4+H2↑、 H2+CuO高温Cu+H2O①②③⑦实验前样品和硬质玻璃管的总质量,实验后Cu及硬质玻璃管的总质量2H2SO4+CuOCuSO4+H2O ①⑤⑧⑨过滤后剩余固体的质量32Cu+O2△2CuO①④⑥⑦⑧实验前坩埚与样品的总质量,实验后坩埚与CuO的总质量 这类试题要求学生依据题目所提供的题设条件,寻找切合实际的多种途径来解决问题,让学生接受挑战,进入发现、创造的角色,具有较高的素质要求。同时,这样的审题方法,就是让学生学会对自己的解题方法优劣进行评价,从而达到揭示出化学题目中的内在联系与解题的规律,以期达到“举一反三,以一贯十”之功效,遇到错综复杂的题目,也能得心应手,触类旁通,运用自如。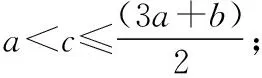
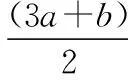
二、抓“问题”,复习中要重视学生参与多途径解答问题的全过程探索,强化思维广阔性的培养
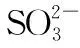
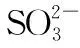

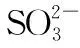
三、抓“评价”,复习中要重视学生参与对问题解法的优劣进行评价,注重思维灵活性的培养