油污土壤修复微生物的筛选及其影响因素
2018-12-05慕庆峰于立红贾洪柏吴慧云
慕庆峰, 于立红, 张 涛, 贾洪柏, 吴慧云
(1.黑龙江八一农垦大学 农学院 寒地作物栽培技术省级重点实验室, 黑龙江 大庆 163319;2.中海油能源发展股份有限公司 工程技术分公司, 天津 300452; 3.东北林业大学, 生命科学学院, 黑龙江 哈尔滨 150040)
石油作为重要的化石能源为社会的发展提供了巨大的动力,但是,自20世纪以来,石油污染带来的问题日益突出[1],石油进入土壤后,会对土壤、植物、微生物、水体等产生直接或间接危害,如堵塞土壤孔隙,使土壤透水、透气性降低,改变土壤有机质的碳氮比和碳磷比,引起土壤板结[2];进入土壤的石油会附着在植物根系表面,影响根系的呼吸和吸收作用,抑制植物生长,并且大多数石油污染物具有致癌、致畸和致突变作用[3],危害人类的身体健康。传统处理油污土壤多采用的是热解析、化学洗涤方法[4],因费用昂贵,产生二次污染,处理后土壤不能复垦等不足,难以规模化应用。而微生物原位修复技术因其良好的修复效果,低廉的价格,无二次污染等特点越来越成为全世界有机污染修复的主流技术[5]。该技术通过优化环境因素来加速自然生物降解进程,是一种高效、经济和生态可承受的绿色清洁修复技术[6]。其技术核心是获得高效微生物及其影响因素之间的作用关系,寻找到最佳的组合方式,提高土壤中石油污染物的降解[7]。微生物作为环境修复的主体,其降解效率决定修复水平。提高降解率的第一要务是获得高效石油降解菌[8]。因此筛选高效降解菌成为国内外行业、学术界研究热点。不同种属微生物都有自己底物谱系,单一微生物很难独立完成修复任务,特别是面对石油这种超级复杂有机物复合体,更需要偏利共生的高效微生物种群协同降解。因此开展高效协同菌种的筛选及其修复影响因素研究具有重要意义。本文针对大庆地区石油污染的土壤筛选驯化高效石油降解协同微生物菌群,并在室内开展模拟试验,研究微生物原位修复的主要影响因素及水平(正交设计)之间的关系,以期为石油污染场地生物修复工程的参数设计提供理论依据。
1 材料与方法
1.1 菌 源
在大庆油田不同类型的油污地采集油污土壤,均匀混合,转入塑料袋中,密封,4 ℃低温保藏,用于菌种的筛选,石油样品来自大庆油田采油一厂。
1.2 培养基
(1) 固体筛选培养基。石油20 g/L; NH4Cl 6 g/L; K2HPO45 g/L;微量元素液8 ml; KH2PO45 g/L;琼脂20 g/L;蒸馏水1 L;调整pH值至7.0~7.2。
(2) 增殖培养基。NH4Cl 6 g/L; K2HPO45 g/L;KH2PO45 g/L;葡萄糖20 g/L;微量元素液8 ml;蒸馏水 1 L。
(3) 石油降解培养基。NH4Cl 6 g/L; K2HPO45 g/L;微量元素液8 ml,KH2PO45 g/L,蒸馏水1 L,石油1 g/L,pH=7.0~7.2。
(4) 微量元素液。MgSO44 g/L; MnSO410 g/L; FeSO4·7 H2O 10 g/L; CaCl210 g/L; ZnSO410 g/L;去离子水1 L。
1.3 菌株筛选
1.3.1 菌株初筛 称取10 g油污土壤样品,放入250 ml锥形瓶中,用生理盐水定容至100 ml,放入10个玻璃珠,170 r/min振摇,待土壤分布均匀,取1 ml泥水混合液用无菌生理盐水梯度稀释后,分别移取10-6,10-5,10-4倍的混合稀释液0.5 ml至相应编号的固体筛选培养基平板内,用三角刮刀均匀涂布,倒置放入30 ℃恒温培养箱中进行培养。观察菌种生长情况,挑取长势良好的菌落再次梯度稀释,并接入到石油筛选培养基中进行培养。重复上述步骤,直到得到纯培养的石油烃降解菌。纯培养菌种4 ℃冰箱保藏备用。
1.3.2 菌株的石油降解能力测定 将保藏菌株接入到增殖培养基中,30 ℃,140 r/min振荡培养48 h,7 000 r/min离心,菌体以2质量数接入到250 ml三角瓶中,每瓶含液体石油降解培养基(1.2.3)50 ml,30 ℃,140 r/min震荡培养7 d后,加入20 ml石油醚(馏分30~60 ℃)萃取(重复3次),合并有机相,并将水相7 000 r/min离心10 min,取上清液至分液漏斗,加入10 ml石油醚振荡100次,静置,待分层后收集合并总有机相,68 ℃蒸干,置干燥器中冷却至恒重,称重。不接菌的培养液为对照,按照下列公式计算石油降解率(μ)(3次重复)。
μ=(W0-Wx)/W0×100%
(1)
式中:W0——对照液中残余石油含量(%);Wx——菌培养液中残余石油含量(%)。
1.3.3 菌群的复配研究 石油是一种复杂的混合物,每种微生物只能降解特定的组分,优势微生物只能在特定时期在油污土壤环境中占据顶端优势,为提高石油降解率,研究复合菌群降解石油的协同能力至关重要[9]。试验选择石油降解率高,在土壤扩散能力强的菌株进行复配,测定7 d石油降解率。真菌生长环境偏酸、细菌偏碱,因此本次试验按照真菌间互作,细菌间互作,真菌细菌混作原则,等比例接入菌量,每个试验真菌按总湿菌量1 g接入,细菌则接入1 ml发酵液(提前调到1 012 cfm)。测定方法参照菌株的石油降解能力测定法,初始石油浓度1 g/L,(7 000 r/min离心发酵液获得),3次重复。
1.4 复合微生物菌群正交试验设计
土壤的营养条件、含水率、pH值、石油的组分及浓度决定着土壤中微生物组成和数量的变化,后者直接关系到油污土壤的修复效果,为明晰其关系,试验选取5个因素:土壤石油污染强度;营养物(NH4NO3,K2HPO4)[10];氧化剂(H2O2溶液)[11];表面活性剂[12]和接菌量[13],每个因素设4个水平,比较不同因素影响下油污土壤的微生物修复效果,探求修复效果最好的外源补给方案,试验选在室内进行,温度25 ℃,适当补充水分,两次重复。各因素及其水平列表L16(45)见表1。
培养条件:10 kg土壤放入50 cm×40 cm×35 cm的塑料箱中,土壤深度35 cm,用黑色塑料布封好
表面,定期翻整土壤。试验中,分别于第7,14,21,28,35,42,49 d对土壤进行检测,测定石油降解率。根据预试验中获得的菌种在土壤不同深度的生长状态,将土壤分为上中下3层,每次取样分别在上(0—10 cm)、中(11—25 cm)、下层(26—35 cm)随机用土壤环刀等比例取土,样品烘干、粉碎、混匀后通过4分法取土10 g,用石油醚萃取,然后测定和计算石油降解率。
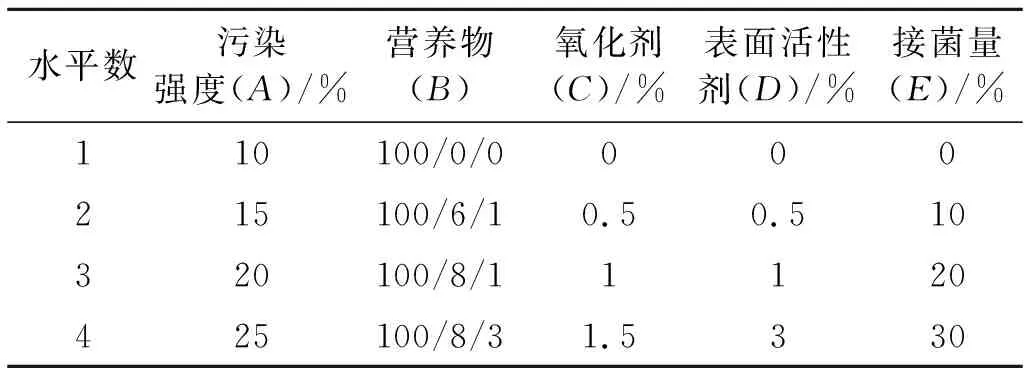
表1 研究区正交设计试验因素及水平
注:表1中各因素不同水平划分的标准为:A为原油占原土重的质量百分比;B为原油/N/P的比例,其中N源为NH4NO3,P源为K2HPO4;C为H2O2占原土重的质量比(g/kg);D为表面活性剂占原土重的质量百分比;E为接菌量(发酵液)占土重的百分比。下同。
2 结果与分析
2.1 石油降解菌株的初筛
经筛选驯化,共获得16株原油降解效果好的菌株,3株真菌(DPF1,DPF2,DPF4)和13株细菌(DPB001-DPB013),其中DPB009为含油废水中分离得到的菌株。参照1.3.2方法对所得菌株进行石油降解率的测定,菌株形态特征及石油降解情况如表2所示。

表2 菌株形态特征及石油降解情况
2.2 降解菌群的复配
考虑到嗜油微生物在土壤中扩散能力,选择全部3株真菌(DPF1,DPF2和DPF4)和降解率最高的两株细菌(DPB004和DPB009)进行复合菌群协同试验,2株真菌(DPF2和DPF4)混合菌群的7 d石油降解率达到87.77%,远远高于普通降油菌对石油类的降解率(40.3%~57.6%)[14]和海洋细菌对石油类的降解率(40.89%~62.75%)[15]。
向量的下标和上标分别表示向量的某个元素和该向量在某次迭代时的值,如xi和x(j)分别向量x的第i个元素和向量x在第j次迭代时的值.矩阵的下标和上标分别表示矩阵的行向量和列向量,如Ai和Aj分别表示矩阵A的第i个行向量和第j个列向量,而Aij则表示矩阵A的第i行第j列元素.向量x和矩阵A的转置分别表示为xT和AT.向量x∈Rn的l2范数记为矩阵A∈Rm×n的Frobenius范数记为核范数记为其中r为矩阵A的秩,σi为其第i个奇异值.
如图1所示,采用LSD法对各处理两两比较,真菌(DPF2和DPF4)比单一真菌DPF2试验组高5.88%,比真菌DPF4试验组高7.32%,说明真菌DPF2和真菌DPF4具有偏利共生,二者代谢底物有不重合域,不重合域越大,协同能力越强。细菌亦如此,对单一细菌DPB004试验组和DPB009试验组而言,两株细菌混合试验组降解率更高,但是在摇瓶培养条件下细菌和真菌混合后的降解率不高,说明此降解条件下细菌和真菌的协同效果不理想。考虑细菌在土壤中活动受限制,在接下来的试验中主要研究这2株真菌的复合菌群对油污土壤的修复。
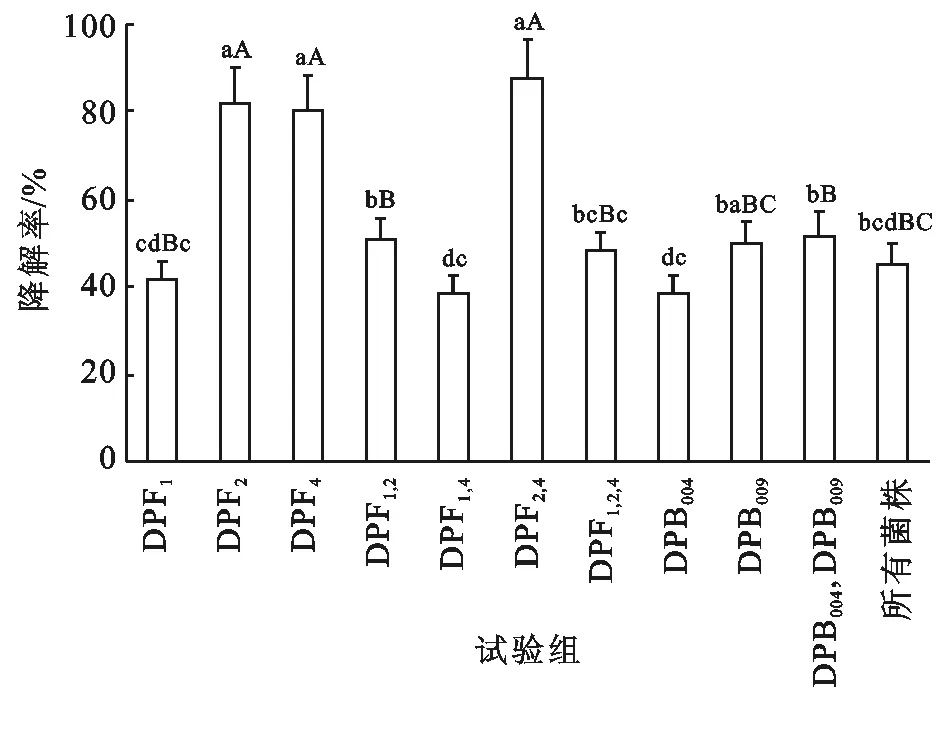
注:不同小写字母表示在p<0.05水平下差异显著,不同大写字母表示在p<0.01水平下差异显著。
图1研究区微生物复配试验
2.3 复配菌系正交试验设计
如表3所示,试验设计采用5因素4水平正交设计,共16个试验组。按照1.4方法定期取样测定石油降解率,用SPSS软件17.0分析所得数据。结果显示对7 d各试验组石油绝对降解量进行分析如表4所示。

表3 研究区各采样时间石油降解率 %
注:石油降解率=石油绝对降解量/初始油污土壤含油量×100%。
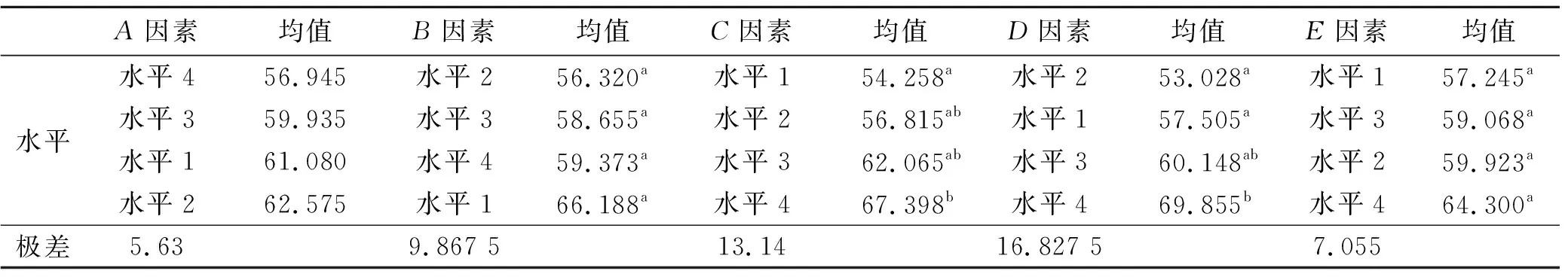
表4 研究区石油的7 d降解率SPSS分析
从表4结果方差分析,均值大的因素水平影响效果强,各因素水平对结果影响的强弱顺序为:A2>A1>A2>A3,B1>B4>B3>B2,C4>C3>C2>C1,D4>D3>D1>D2,E4>E2>E3>E1。方差分析给出因素水平比较,在本次统计中,A,B,C,D,E5个因素都当成了处理因素,这种试验设计实际上没有考虑试验误差,即表中Error 为0。在正交设计中,如果没有重复试验,又无空白项时,常取因素离均差平方和(Ⅲ 型平方和)最小项作为误差估计[16]。从表5中可以看出,A的Ⅲ 型平方和SSC=68.251最小,它对整个试验结果影响最小,因而把它作为误差估计,用以检验其他因素作用的显著性。这样重新进行统计,方法同上,只是不要将变量A添加参与到计算即可[17],结果见表4。
极差分析可知,因素的F值越大,其影响权重越高,各因素对试验结果的重要次序为:D>C>B>E>A,氧化剂(C)对石油降解率影响水平极显著性,p<0.05水平,氧化剂(C)对石油降解率C1和C4影响水平极显著,表面活性剂(D)在p<0.05水平,水平1水平2和水平4差异显著,污染强度(A)、营养物(B)、接菌量(E)在7 d内对石油降解率影响非常小,综合各种因素,确定石油降解因素组合为D4C4B1E4A2。同理可得14,21,28,35,42,49,56 d的各因素重要次序和最佳工艺,见表5。
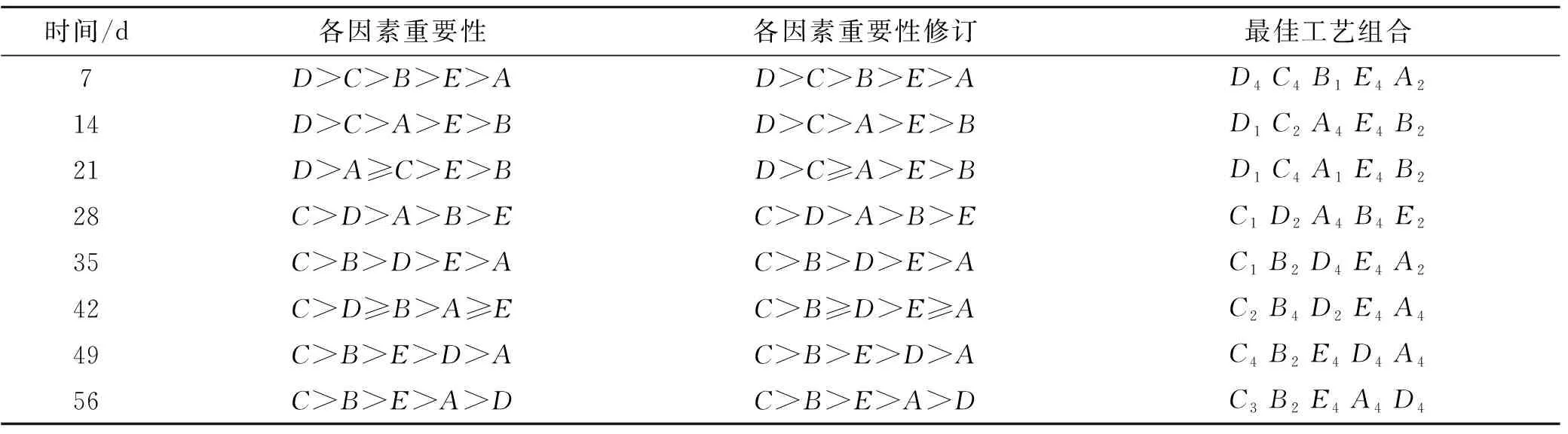
表5 研究区正交设计试验各因素重要性
对表5数据进行分析,为了清楚整个修复过程因素动态变化,现对数据进行图形化处理,以时间为横坐标,因素重要性为纵坐标。例如把因素的重要性分为5级,与排序相反,以7 d因素A为例,A重要级别为纵坐标,即为1同理因素D为5,画折线图。考虑折线的平滑性以及因素的均值大小对表5因素重要性进行校正,数据如图2。
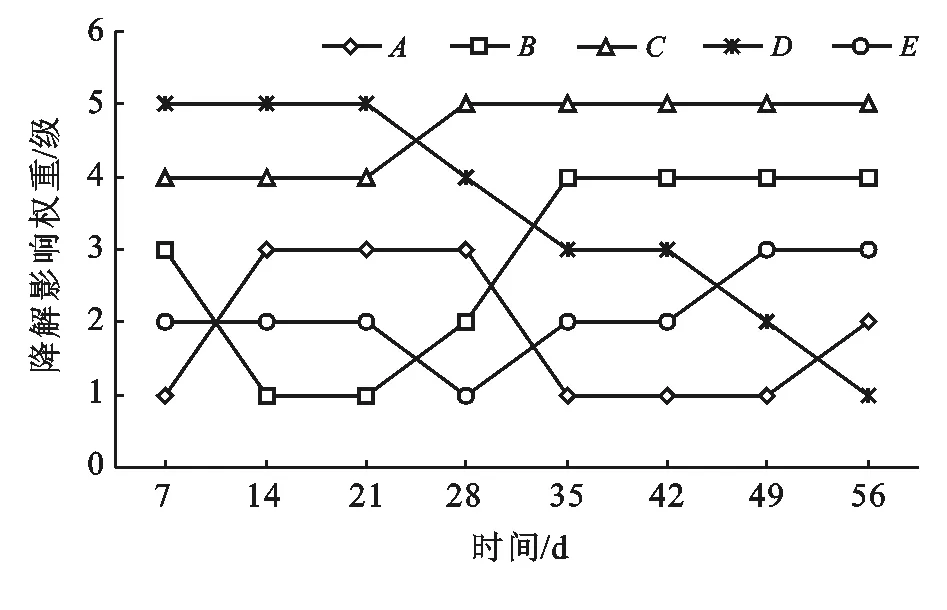
图2 研究区各因素对生物修复的重要性
从图2可知:因素A污染强度在0~7 d内权重为1级,即对生物修复影响最小,8~28 d权重为3级,35~49 d权重最低降至1级。分析原因,微生物进入土壤后,有一个生物延迟期,微生物调整底物代谢的酶系统。污染强度在0~28 d内对降解率有影响。可见在一定条件内,微生物可利用的石油组分越多,石油绝对降解量越大,但对整个修复期间降解率的影响不显著。因素B营养物:在0~7 d内权重3级,微生物处于生理延迟期,细胞需要紧急启动新底物代谢酶系统,因此对氮磷过量积累。而14~28 d,权重降为1级,可能跟土壤固有营养供给和前期过量吸收短时间需求量不大有关;土壤固有营养消耗殆尽后,外加补给作用更加明显,因此35 d后权重升为4级。如图2在整个修复过程,因素B水平2出现5/6次(扣掉微生物迟缓期第一星期),所以因素B2为最佳比例。
氧化剂C在前21 d内响应指数一直为4级,28 d后权重升为5级,说明氧化剂C在整个修复过程中都具有重要影响,添加氧化剂在整个修复期内都具有重要意义。考虑H2O2是一次添加,7 d内全部消耗掉了,因此只要不产生微生物生理毒性,氧化剂浓度大有好处,因此因素C4为最佳比例。
表面活性剂D在0~21 d权重为5级,影响最大,可见生物修复初期石油乳化效果对生物降解至关重要。28 d后权重降为1级,分析原因:初期外加表面活性剂促进了微生物的增殖,后期大量生物表面活性剂的产生,降低了外源表活剂的权重。因此表面活性剂D4为最佳配比。
接菌量E在前42 d为2级,后期升级为3级,在整个修复期因素E水平均值差异不显著,因此接菌量的多寡决定不了降解效果,即对降解率影响不显著,因此E2比较适合。
3 讨 论
根据图2可知:在整个56 d降解期间内,C因素氧化剂均占较大的权重,其对降解率影响最大。原因是化学氧化使大分子底物分解为小分子,提高了生物可降解率。但也有研究表明,氧化剂浓度过高会对微生物产生毒害作用[18],因此氧化剂添加要有合适浓度,在本试验确定C4为适合氧化剂浓度。D因素表面活性剂具有增溶作用,石油为非极性物质,具有疏水性,而微生物表面具有亲水特性,添加的表面活性剂能增加石油与微生物之间的接触机会,提高石油污染物质的可利用性,缩短土壤修复时间;而本试验因素C在0~21 d内权重最大,证明了上述观点。随着外加的表面活性剂被微生物降解[19],其权重逐渐降低。到56 d时,D因素的权重已降至最小,证明表面活性剂大量被微生物消耗(表面活性剂一次性投入,不在不加);另一方面到了降解后期微生物自身能够大量产生生物表面活性剂,所以到了后期D因素对降解的影响权重自然变小。相比之下,E因素接菌量在整个修复期权重最小(除0~7 d延迟期),推测其原因是微生物超强的自我繁殖能力,微生物数量的大量增殖,降低了因素E接菌量的影响,导致本试验微生物接菌浓度水平对于石油降解率影响很大,试验数据处理方差均值不显著也证明了此观点。
4 结 论
(1) 本试验从石油污染样品中,以石油为唯一碳源进行筛选、分离得到石油降解菌株16株,选取5株高效降解菌作进一步协同试验。其中包含3株真菌(DPF1,DPF2,DPF4)和2株细菌(DPB004,DPB009),这些株菌均能使石油乳化。经复配研究,真菌(DPF2,DPF4)协同效果较好,7 d石油降解率可达87.77。
(2) 采用真菌(DPF2,DPF4)的复合菌群,设计5因素4水平的正交试验室内模拟微生物修复油污土壤的试验。结果表明,在56 d内,石油污染强度为10的油污土壤降解率最高,达94.12%,石油污染强度为25的油污土壤,降解率为90.17%。
(3) 采用SPSS统计软件17.0对降解过程进行分析,发现在21 d内,表活剂影响权重第一,氧化剂权重第2。21 d后氧化剂权重上升为第1,表活剂权重逐渐降低,营养剂则在28 d后上升至第2位置。石油烃污染强度仅在35 d前有一定权重(影响),在修复后期影响最小。在整个修复过程,接菌量在所有因素中方差均值都最小,对降解率权重(影响)不大。
