小檗碱和大黄酸对LPS诱导巨噬细胞炎症反应及TLR2/NF-κB信号通路的影响
2018-12-04冯伟科于华芸王媛赵月吴智春
冯伟科,于华芸,王媛,赵月,吴智春
(山东中医药大学,济南250355)
黄连和大黄是历代本草明确记载的寒性中药,具有清热泻火解毒等功效[1,2]。前期基因芯片研究结果显示,二药均可调控应答刺激免疫反应相关基因表达,以增强机体防御和应答功能,发挥一定抗炎、抗菌作用,这可能是其寒以清热的主要分子机制[3,4]。Toll样受体(TLR)家族是介导炎症反应的关键受体蛋白[5],其中TLR2可通过增强核转录因子κB(NF-κB)的活化介导细菌及其产物对机体细胞的激活和损伤[6],而白细胞介素4受体相关激酶(IRAK4)是TLR2/NF-κB信号通路下游的关键因子。炎症反应可导致炎性因子水平升高,如IL-1β、IL-6等。2017年2月,我们以巨噬细胞RAW264.7为研究对象,观察黄连和大黄的主要活性成分小檗碱和大黄酸[7,8]对LPS诱导的炎症反应及TLR2/NF-κB信号通路的影响,为进一步阐明寒性中药抗炎分子机制提供实验依据。
1 材料与方法
1.1 主要材料 RAW264.7细胞购自齐氏生物科技有限公司,DMEM完全培养基购自HyClone公司;LPS购自Sigma公司;IL-1β、IL-6 ELISA检测试剂盒购自华美生物工程有限公司;TRIzol购自Invitrogen公司,TIANScript RT Kit、SuperReal PreMix Plus(SYBR Green)购自天根生物科技有限公司;荧光定量PCR仪购自美国ABI公司,IRAK4、NF-κΒ p65、TLR2、β-actin引物由上海生工生物工程股份有限公司合成;TLR2、IRAK4、NF-κΒ p65抗体购自Abcam公司。
1.2 实验方法
1.2.1 细胞培养与分组干预 RAW264.7细胞培养于DMEM完全培养基中,37 ℃、5% CO2恒温培养箱孵育。将细胞随机分为4组:空白组以完全培养基常规培养,LPS诱导组加入10 ng/mL LPS诱导4 h,小檗碱组和大黄酸组分别用20 μmol/L小檗碱和30 μmol/L大黄酸预处理2 h后,加入10 ng/mL LPS诱导4 h。
1.2.2 细胞上清液中炎性因子IL-1β和IL-6检测 采用ELISA法。收集各组细胞,以1 000 r/min离心10 min,保留细胞上清液。按照试剂盒说明书进行操作,酶标仪检测样品450 nm波长吸光度,绘制标准曲线;根据样品吸光度值,从标准曲线查得上清液中IL-1β和IL-6水平,评价炎症反应程度。实验重复3次。
1.2.3 细胞中TLR2、IRAK4、NF-κB p65 mRNA检测 采用实时荧光定量PCR法。TRIzol试剂提取各组细胞总RNA,按TIANScript RT Kit说明书反转录得到cDNA,利用SuperReal PreMix Plus试剂盒及荧光定量PCR仪进行实时荧光定量PCR分析。反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火60 s,40个循环。以β-actin为内参,以2-ΔΔCt表示样品中目的基因相对表达量。实验重复3次。TLR2/NF-κB信号通路相关基因及内参引物序列,见表1。

表1 TLR2/NF-κB信号通路相关基因及内参引物序列
1.2.4 细胞中TLR2、IRAK4、NF-κΒ p65蛋白检测 采用Western blotting法。提取各组细胞蛋白质,BCA法检测蛋白质浓度;调整蛋白浓度,取相同总量的蛋白上样至10% SDS-PAGE中,电泳,转膜。转膜完毕后,加入5%脱脂牛奶封闭1 h;加入一抗,4 ℃摇床孵育过夜,TBST室温下脱色摇床洗膜3次;加入二抗,室温孵育30 min,TBST清洗3次;化学发光,显影,定影。采用Image J软件分析电泳条带灰度值,以目的蛋白与β-actin灰度比值表示目的蛋白的相对表达量。实验重复3次。

2 结果
2.1 各组细胞上清液中IL-1β、IL-6水平比较 LPS诱导组、小檗碱组和大黄酸组细胞上清液中IL-1β、IL-6水平均高于空白组(P均<0.05);小檗碱组和大黄酸组细胞上清液中IL-1β、IL-6水平均低于LPS诱导组(P均<0.05)。见表1。
2.2 各组细胞中TLR2、IRAK4和NF-κΒ p65 mRNA表达比较 LPS诱导组、小檗碱组和大黄酸组细胞中TLR2、IRAK4和NF-κΒ p65 mRNA表达量均高于空白组(P均<0.05),小檗碱组和大黄酸组细胞中TLR2、IRAK4和NF-κΒ p65 mRNA表达量均低于LPS诱导组(P均<0.05)。见表2。
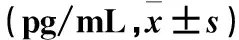
表1 各组细胞上清液中IL-1β、IL-6水平比较
注:与空白组比较,*P<0.05;与LPS诱导组比较,#P<0.05。
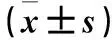
表2 各组TLR2、IRAK4和NF-κΒ p65 mRNA表达比较
注:与空白组比较,*P<0.05;与LPS诱导组比较,#P<0.05。
2.3 各组细胞中TLR2、IRAK4和NF-κΒ p65蛋白表达比较 LPS诱导组、小檗碱组和大黄酸组细胞中TLR2、IRAK4和NF-κΒ p65蛋白表达量均高于空白组(P均<0.05),小檗碱组和大黄酸组细胞中TLR2、NF-κΒ p65蛋白表达量均低于LPS诱导组(P均<0.05),小檗碱组细胞中IRAK4蛋白表达量均低于LPS诱导组(P<0.05)。见表3。
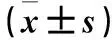
表3 各组细胞中TLR2、IRAK4和NF-κΒ p65蛋白表达比较
注:与空白组比较,*P<0.05;与LPS诱导组比较,#P<0.05。
3 讨论
细菌、病毒等病原体引起的急性感染,中医临床辨证多属“热证”范畴,“治热以寒”,临证据法当以寒凉中药为主组方[9]。前期基因芯片研究显示,寒性代表中药黄连和大黄可影响炎症反应相关基因LBP、TLR2等的表达[3,4]。LBP编码的LPS结合蛋白可以增强细胞对LPS的反应性,激发机体炎症反应;TLR2编码的TLR2蛋白可诱生多种促炎症细胞因子,介导机体免疫应答,增强机体防御反应。这些可能是黄连和大黄发挥清热泻火作用的机制之一。本实验拟在此基础上对基因芯片结果进行验证,进一步揭示寒性中药发挥抗炎作用的信号机制。
中药有效单体成分清楚,质量可控,效力专宏,往往起关键作用[10]。目前,基于中药有效单体成分的新药开发,是研发具有自主知识产权新药的重要途径之一[11]。现代药理学研究表明,黄连抗内毒素的药效物质基础是生物碱类,其中小檗碱约占5%,是黄连的主要活性单体[7];大黄酸则为大黄给药1 h后血清指纹谱中含量较高成分[8],是大黄主要活性单体之一。本实验采用LPS诱导巨噬细胞RAW264.7建立炎症细胞模型,以黄连和大黄主要活性单体小檗碱和大黄酸进行干预研究。
RAW264.7为鼠源巨噬细胞系,是研究炎症反应的常用细胞模型。革兰阴性菌细胞壁中的LPS可诱导该细胞表达多种炎性因子,其中IL-1β可趋化并激活中性粒细胞,IL-6可诱导T淋巴细胞和B淋巴细胞分化,放大炎症反应,从而导致组织细胞损伤[12]。本实验结果亦显示,LPS诱导RAW264.7细胞IL-1β、IL-6分泌显著增多,小檗碱和大黄酸预处理均可明显抑制此升高趋势。由此可见,小檗碱和大黄酸可减少LPS诱导的炎性因子IL-1β、IL-6的产生,具有明显的抗炎作用。
TLR是机体抵抗感染性疾病的第一道屏障,可以被病原体激活并迅速启动炎症反应。其中,TLR2可通过增强NF-κB的活化介导细菌及其产物对机体细胞的激活和损伤[6]。TLR2识别LPS后,通过下游信号分子髓样分化因子88募集IRAK4[13,14]。IRAK4兼具丝氨酸/苏氨酸激酶活性和酪氨酸激酶活性,在TLR介导的信号通路中起正向调节作用[15]。内源性的IRAK4以前炎症细胞因子依赖的方式与IRAK1和肿瘤坏死因子受体活化因子6(TRAF6)相互作用,促进IκB磷酸化降解,从而去除了对NF-κB的抑制作用,导致NF-κB活化[16,17]。活化的NF-κB是由p50亚单位和p65亚单位组成的异源二聚体,可以进入细胞核,引起炎症介质基因的转录和表达[18]。本实验结果显示,LPS诱导RAW264.7细胞TLR2、IRAK4和NF-κB p65 mRNA及蛋白表达均升高,小檗碱和大黄酸均可明显下调上述信号分子的表达,提示影响TLR2/NF-κB信号通路可能是小檗碱和大黄酸抗炎的分子机制之一。
综上所述,寒性中药黄连和大黄的主要活性单体小檗碱和大黄酸可下调TLR2/NF-κB通路信号分子表达,减少炎性因子产生,发挥一定抗炎作用,这可能是黄连和大黄清热泻火功效的物质基础和分子机制之一。本实验仅观察了小檗碱和大黄酸的抗炎作用及相关机制,黄连、大黄的其他活性单体的作用及机制有待于进一步研究探讨。
