仿生圆周取向微米纤维支架构建组织工程椎间盘纤维环
2018-11-29杜立龙徐宝山杨强程招军许海委
杜立龙,徐宝山,杨强,程招军,许海委
退行性椎间盘疾病的发病率和致残率较高,给患者的工作和生活带来了极大的不便,也造成了巨大的经济损失[1]。尤其是椎间盘退变引起的椎间盘突出症,症状严重且保守治疗无效,往往需要手术治疗。椎间盘髓核摘除术是治疗椎间盘突出症最常用的外科手术方式。虽然手术治疗可有效缓解疼痛和改善功能,但仍有5%~20%的患者术后复发[2]。其主要原因是髓核摘除术后遗留纤维环部分缺损,而纤维环自我修复能力有限,破裂缺损的椎间盘进一步退变,导致突出复发,引起慢性腰腿痛和功能障碍,严重者需再次手术。因此,修复纤维环破裂缺损是一个亟待解决的问题。
当前,国内外学者尝试了多种修复破裂缺损纤维环的方法,如纤维环缝合、特制的纤维环修补装置等[3]。这些方法主要是传统的外科修补策略,均未能恢复纤维环的生物学功能,远期效果不理想,迫切需要探索新的治疗措施[4]。椎间盘组织工程技术为纤维环的再生修复提供了新的治疗策略。以往的组织工程纤维环支架结构多是三维蜂窝状多孔状或是无规则的纤维,未能模拟天然纤维环的圆周取向结构[5]。本研究通过湿法纺丝技术制备仿生圆周取向的微米纤维支架,接种兔纤维环细胞,在体外构建组织工程化纤维环,旨在探讨其作为仿生组织工程化纤维环的可行性。
1 材料与方法
1.1 实验材料 新鲜椎间盘组织取自于体质量约2 kg的雌性新西兰大白兔(4只,由天津医院动物实验室提供),用于兔纤维环细胞提取,相关动物实验方案已获天津医院实验动物伦理委员会批准。聚己内酯(Polycaprolactone,PCL)、鬼笔环肽、番红O染料、DAPI、DiI、免疫荧光抗体(Sigma公司,美国);Live/dead染色试剂(Invitrogen,美国);Ⅰ型胶原抗体(Abcam,美国);羊抗兔IgG二抗(Santa Cruz Biotechnology,美国);DMEM培养基、胎牛血清(Gibco,美国);扫描电子显微镜(SEM,Hitachi,日本);Micro-CT(西门子,德国)。
1.2 仿生圆周取向PCL微米纤维支架的制备 将PCL颗粒溶解在CHCl3/THF(3∶1,v/v)中获得10%(w/v)PCL溶液。然后将上述PCL纺丝原液置入10 mL注射器中,通过注射泵以恒定速度(1 mL/h),经10 mL注射器、5号针头注射到300 mL食用油和100 mL正己烷的混合溶液中,控制磁子搅拌速率,调节接收器与针头出口间的距离,使纤维能够从针头中稳定抽出并持续取向缠绕在3 mm直径的接收转轴上(图1A);在挤出所需体积的PCL溶液后,从转轴上取出收集的纤维(图1B),正己烷洗涤除去油渍,并在真空干燥器中抽吸2 d以除去残留的试剂。用手术刀片裁成2 mm厚,获得外径6 mm、内径3 mm、高2 mm的三维仿生纤维环支架(图1C)。
1.3 圆周取向支架理化性能表征 (1)大体观察。用体式显微镜观察圆盘状支架的大体形态及结构。(2)Micro-CT三维成像分析。参照Vanlenthe[6]的方法,样品在3%的锇酸中4℃浸泡过夜后冻干,置于Micro-CT下进行三维成像分析。(3)扫描电子显微镜(SEM)观察。通过SEM分别对喷金后支架的横切面和纵断面的纤维形貌特征进行观察。(4)支架纤维直径测量。通过Image J软件分析支架纤维的扫描电子显微镜(500倍)图像,并通过测量超过50根纤维的直径来测算PCL支架的纤维直径。(5)支架孔隙率测定。参照Wang等[7]的方法,用质量体积法测量孔隙率,将支架切成形状大小规则的样品,游标卡尺测量样品尺寸,计算样品体积。每组3个样品,称量样品质量,每个样品测量3次。公式如下:孔隙率=[1-(m/V×ρ)]×100%。其中:m为PCL支架的质量,V为支架的表观体积,ρ为PCL材料的密度ρ=1.145 g/cm3。
1.4 组织工程椎间盘纤维环的构建 (1)分离培养兔纤维环细胞。大白兔用CO2处死后,即刻对背部皮肤消毒。背部正中切口,暴露脊柱,取胸10至腰5节段,切取完整的椎间盘,分离纤维环组织,置于平皿中,用Hank’s缓冲液漂洗3遍后剪碎成约1 mm3均匀的组织块。随后加入0.2%Ⅱ型胶原酶,在37℃下消化2~3 h,过滤掉未消化的组织,1 000 r/min离心10 min,用含10%胎牛血清的DMEM培养基将所得的细胞沉淀重悬,接种到培养瓶中培养待用。(2)支架预处理。支架经60Co射线辐照灭菌后,浸泡于DMEM培养基中过夜,以待接种细胞。(3)细胞接种。用无菌滤纸将上述浸泡待用支架中的培养基吸干,置于24孔培养板中,用微量移液器吸取40µL P2代纤维环细胞悬液(密度1×107/mL),均匀接种到支架表面后,置于细胞培养箱内培养3~4 h,使细胞在支架材料上完全黏附、铺展(图1D)。随后,加入2~3 mL新鲜培养基,连续培养14 d,每天更换培养基。
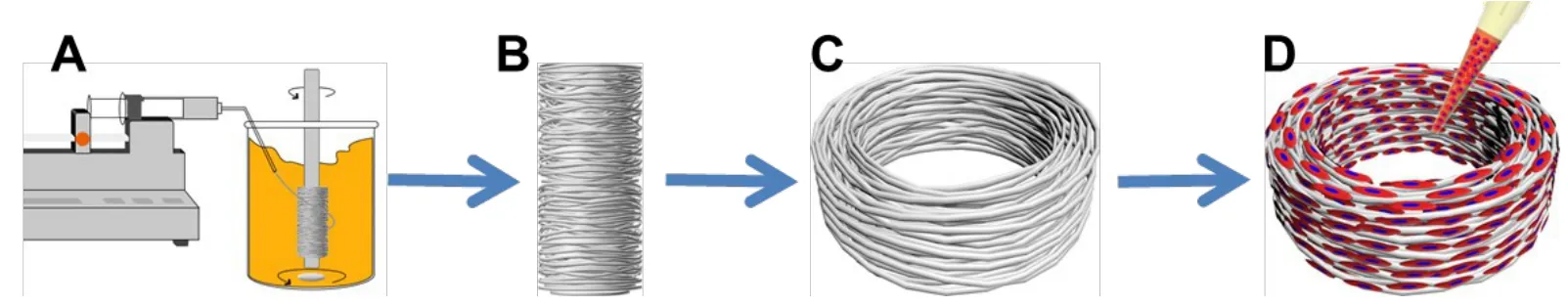
Fig.1 The schematic illustration of fabrication of the biomimetic circumferentially oriented microfiber scaffold and the AF-scaffold composite图1 仿生圆周环形取向性PCL微米纤维环支架的制备流程及组织工程纤维环的构建
1.5 纤维环细胞在支架中的行为评估 (1)SEM观察。将培养14 d后的支架复合物浸泡于2.5%戊二醛中固定过夜,使用梯度乙醇逐级脱水,干燥后表面喷金,用SEM对细胞在支架表面的黏附铺展情况进行观察。(2)Live/dead染色观察。培养14 d后,吸出培养基,用PBS冲洗细胞-支架复合物2次,加入配置好的Live/dead染液,于37℃、5%CO2培养箱中孵育30 min后,使用激光共聚焦显微镜对细胞活(绿)死(红)情况进行观察。(3)罗丹明-鬼笔环肽(Rhodamine-phalloidin)染色。使用4%多聚甲醛固定培养14 d后的细胞支架复合物20 min,0.1%tritonX-100/PBS破膜;然后加入200µL罗丹明-鬼笔环肽溶液(2.5 mg/L)对细胞骨架进行染色,避光孵育1 h;PBS漂洗5次后,加入200µL DAPI溶液,复染细胞核,使用激光共聚焦显微镜观察细胞骨架伸展形态。(4)细胞迁移情况评估。在体外无菌条件下,用2.5 mmol/L DiI(细胞膜红色荧光探针)对纤维环细胞进行标记,然后按1.2(3)步骤接种到支架上;培养14 d后,使用冷冻切片机对样品进行切片(横向和纵向),样品置于荧光显微镜下,观察细胞迁移情况。
1.6 组织学分析 (1)H&E染色和番红-O染色。将培养14 d后的细胞-支架复合物置于4%多聚甲醛中固定1 h,脱水浸蜡后,使用石蜡包埋机包埋,切成6µm厚的样品片。对样品片常规脱蜡复水后,行H&E染色和番红-O染色,分别观察纤维环细胞分布及蛋白多糖分泌情况。(2)Ⅰ型胶原免疫组化和免疫荧光染色。将石蜡组织切片脱蜡处理后,在3%H2O2溶液中处理10 min,含5%牛血清白蛋白37℃孵育30 min,后加入一抗(兔抗Ⅰ型胶原蛋白抗体),4℃过夜,洗涤后与生物素化的羊抗兔IgG二抗置于湿盒中4℃冰箱孵育过夜,用DAB显色处理,显微镜下观察。免疫荧光染色采用Alexa Fluor 488标记亲和山羊抗兔IgG二抗,其余步骤不变。
1.7 统计学方法 应用SPSS 16.0进行统计分析,符合正态分布的计量数据以均数±标准差(±s)表示。
2 结果
2.1 大体观察 由体式显微镜观察可知,通过湿法纺丝技术所制备的PCL纤维环支架呈圆盘状,具有类似于天然纤维环的外形结构;微米纤维圆周分布,壁厚(2 mm)均匀,测内径约为2 mm,外径6 mm。见图2A~C。
2.2 Micro-CT成像和扫描电镜观察 Micro-CT三维成像显示整个纤维环支架呈3D环状取向结构,且纤维之间存在均匀的空隙,见图2D。SEM结果表明,整个PCL纤维环支架呈圆周取向结构,纤维形状为规则的圆柱形,直径均匀,呈现取向性分布,纤维之间无粘连,见图2E~H。
2.3 支架孔隙率、纤维直径测定 经测算支架的孔隙率为69.33%±6.67%,纤维直径为(16.13±2.77)µm。
2.4 细胞行为分析 (1)SEM观察可见,细胞在支架上接种14 d后呈长梭形并沿纤维方向铺展,周围有细胞外基质(ECM)分泌,见图3A。(2)Live/dead染色显示,细胞在支架上培养14 d后仍具较高的存活率,基本无死细胞(红),而且还呈现取向性生长的趋势,见图3B。(3)鬼笔环肽染色显示,支架上的纤维环细胞的细胞肌丝均沿PCL纤维取向方向伸展,见图3C。(4)体外培养14 d后,样品纵切面显示DiI荧光标记的细胞迁移渗透到整个支架内部,见图3D。
2.5 组织学分析 H&E染色可见,培养后的细胞呈长梭形,能够沿着微米纤维取向均匀地黏附铺展在支架表面及内部,见图4A;番红O染色(图4B)、Ⅰ型胶原免疫组化和免疫荧光染色可见纤维环胞浆和细胞外周有大量ECM,并且沿微米纤维取向性分布,见图4C~F;DAPI染色可见细胞核呈纺锤形沿微米纤维伸长,见图4E。
3 讨论
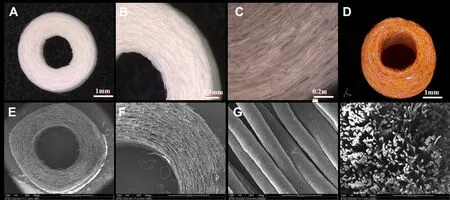
Fig.2 The structures of the biomimetic circumferentially oriented microfiber scaffold图2 仿生圆周取向性纤维环支架的结构观察
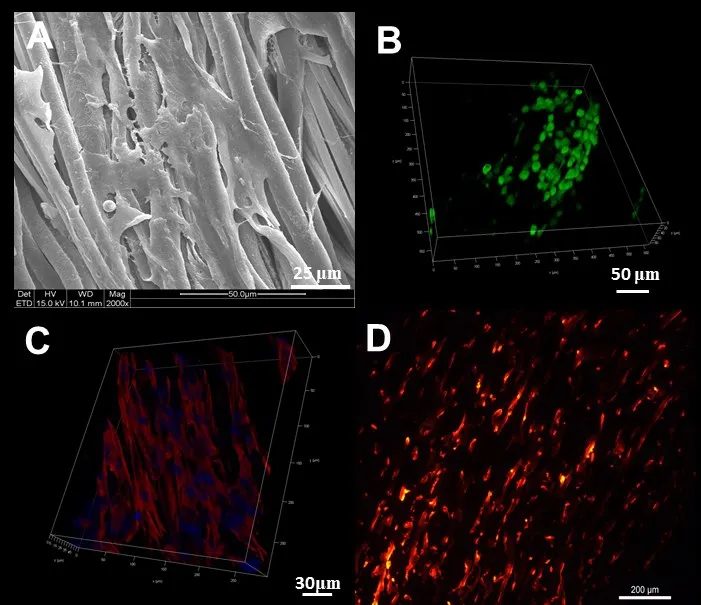
Fig.3 Evaluation of the cell behaviors inside the scaffold图3 组织工程纤维环中纤维环细胞的行为评价
3.1 组织工程椎间盘纤维环支架的特点 椎间盘纤维环由10~25层同心胶原纤维排列而成[8]。成功的组织工程纤维环支架应当模拟天然纤维环的微观结构[9]。早期纤维环支架多为相互连通的多孔蜂窝状结构[10-11],其不具有仿生结构;也有研究者采用天然脱细胞多孔支架材料,如脱钙脱细胞骨基质环等[12],但存在免疫原性及可能传播疾病的缺陷。近年来,许多研究者模拟上述天然纤维环的取向纤维结构,而不局限于单相的多孔均一结构或无规则纤维结构。静电纺丝技术在制备取向纤维支架方面具有独特的优势,是目前制备纤维环支架的常用方法[15]。如 Koepsell等[14]利用静电纺丝技术,以 PCL为材料制备纳米纤维膜,并复合AF细胞体外构建组织工程纤维环;Zhu等[16]发现纤维环来源的干细胞能在取向性静电纺丝聚醚碳酸酯纤维上定向生长,比在无规则纤维上分泌更多的Ⅰ型胶原和聚集蛋白聚糖。然而传统的静电纺丝纳米纤维支架是由紧密堆积的纳米纤维组装而成,其仅仅提供了细胞生长的表面结构,而限制细胞迁移渗透入支架内部,这是静电纺丝支架的一个不可避免的限制因素。因此,制备兼具有高孔隙率高,并能促进细胞生长迁移的三维取向纤维环支架仍是一个挑战。
湿纺成形技术是一种新型湿法挤出工艺,可制备自组装的非编制微米纤维支架,目前已应用于神经、肌腱、肌肉等组织修复[17]。湿纺成形系统中,笔者采用溶剂去除技术,通过将纺丝持续滴入聚合物(PCL)的非溶剂浴中(食用油∶正己烷=3∶1),PCL中三氯甲烷溶剂与非溶剂立即进行逆扩散,使得PCL在非溶剂浴析出成形,并在匀速旋转的液体剪切力作用下形成纤维,通过不锈钢棒收集组装纤维,获得环形纤维支架[17-18]。本研究中,笔者采用湿法纺丝方法,通过调节纺丝原液的浓度、流出速度及针头大小来控制纤维的粗细,可获得直径介于几微米到几百微米的纤维;并且可通过调节收集速度、非溶剂比例调节直径的孔隙率和连通度。同时,本研究选用FDA批准的PCL材料,其具有优越的力学性能和良好的生物相容性,是制备纤维环支架的优越材料。采用搭建的湿纺成形系统成功制备了圆周取向的微米纤维环支架。体式显微镜、SEM及micro-CT观察结果显示支架为三维圆周取向的圆环结构,支架内部的PCL纤维定向分布,纤维之间无粘连,纤维直径规则、均匀,约(16.13±2.77)µm。另外,支架的孔隙率达69.33%±6.67%,结构稳定,不易分层,是构建组织工程纤维环的有效支架。

Fig.4 The histology and immunohistochemistry analyses of the cell-scaffold composite图4 组织工程纤维环组织学及免疫组织化学染色
3.2 PCL微米纤维支架对细胞行为的影响 理想的组织工程纤维环支架需为种子细胞提供拟天然的空间和微环境[5]。以往有研究证实定向纤维可引导细胞肌丝沿纤维铺展生长。诸多研究证实了无规则纤维和定向纤维对种子细胞的影响,发现在长梭形细胞的比例远高于无规则纤维[19]。与之相同,本研究中将兔AF细胞接种于构建的仿生纤维环支架上,SEM和细胞肌丝染色分析显示AF细胞沿定向的PCL纤维生长分布。这可能由于AF细胞肌丝感应黏附基质形态,两者相互作用,引起细胞黏附斑构型变化,进而引起细胞传递形态变化,表现出与微米纤维方向一致的长梭形[20]。另外,Live/dead染色显示AF细胞在支架上表现出良好的生长活性,表明支架无细胞毒性作用,也呈现沿纤维取向生长的趋势。我们观察到DiI细胞膜荧光标记的细胞接种到支架14 d后,AF细胞可完全迁移长入整个支架内部;而在静电纺丝支架中,种子细胞则难以长入,仅局限于支架表面[19]。其原因主要是与静电纺丝支架相比,湿纺纺丝制备的纤维支架孔径大、结构疏松,为细胞的生长、增殖和迁移提供了合适的空间,并有利于细胞营养物质与代谢产物的交换,这也是构建三维组织工程化纤维环的难点。
3.3 组织工程纤维环的再生重塑 仿生支架结构可通过引导种子细胞拟天然生长进而促进纤维环组织的再生重塑[21]。组织学染色显示,纤维环细胞及其分泌的ECM均在微米纤维支架上取向性生长和分布,其原因是由于细胞形态的改变引起的分泌ECM结构的改变,以及支架的空间取向孔隙结构对于ECM的引导作用。在本研究中组织学评估发现Ⅰ型胶原免疫组化和免疫荧光染色阳性,提示大量Ⅰ型胶原蛋白沉积,这也是天然纤维环的主要胶原成分。同时本研究也证实了椎间盘AF细胞具有分泌和沉积与天然纤维环组织相似组成和结构的ECM组织的能力。这种仿生支架取向引导细胞和重塑再生ECM的作用对于椎间盘纤维环的再生修复是至关重要的,尤其是在椎间盘原位修复微环境中的组织功能重建和整合。
综上所述,湿纺成形法制备仿生圆周取向的PCL纤维环支架具有合适的孔径、较高的孔隙率和良好细胞相容性;其有利于AF细胞的迁移渗透,并能够引导AF细胞取向性生长和ECM的拟天然再生重塑,是构建组织工程纤维环的理想支架载体,有望用于破裂退变纤维环的再生修复。
