糖原累积病研究进展*
2018-11-28曾召琼综述谢小兵审校
曾召琼,易 帆 综述,谢小兵 审校
(湖南中医药大学第一附属医院医学检验中心,长沙 410007)
糖原累积病(GSD)是一组由于参与糖原合成与分解过程的酶生成障碍而引起一系列不同症状的先天性糖代谢异常疾病,主要涉及肝脏、肌肉和脑中的糖原代谢异常。GSD累及肝脏主要表现为低血糖和肝肿大;累及肌肉主要表现为运动不耐受、肌痛、横纹肌溶解、肌无力和心肌病。各型突变基因,遗传模式见表1。对各型的研究综述如下。
1 GSD 0型
糖原合成酶(GS)是肝糖原合成的关键酶,分两个亚型:GYS1和GYS2。目前文献报道该型不足30例[1]。GS的活性受损导致肝脏中糖原储存大量减少。GYS1表达于骨骼肌和心肌,其突变表现为易疲劳,运动不耐受,累及心脏可引起肥厚性心肌病,突发心脏骤停。GYS2表达于肝脏中,催化α-1,4-葡萄糖残基连接到糖链的非还原端,其突变引起婴儿期或儿童期出现非胰岛素依赖性糖尿病症状,长期禁食后酮症性低血糖和低乳酸血症,进食后缓解,餐后高血糖和高脂血症,伴有肝肿大。
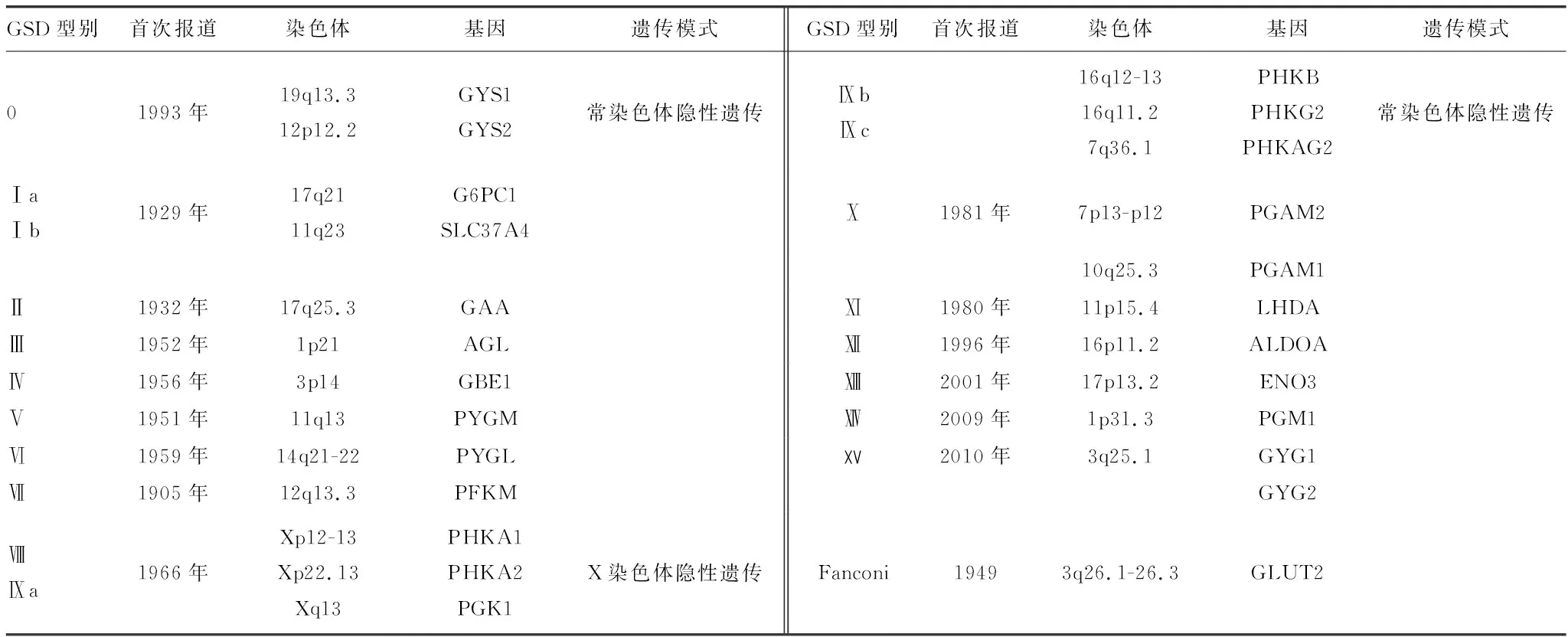
表1 各型突变基因遗传模式
2 GSDⅠ型
由葡萄糖-6-磷酸转移酶(G6Pase)活性缺乏所致,是婴幼儿中常见的一种GSD。该酶作用于糖原分解和糖异生的终末步骤,多在肝、肾、小肠中表达。骨代谢紊乱是Ⅰ型典型特征。将GSDⅠ型分为Ⅰa、Ⅰb、Ⅰc、Ⅰd 4种亚型。GSDⅠa型又名Von Gierke病,该亚型约占80%。主要表现为肝、肾肿大,肥胖、呼吸困难、身材矮小,幼儿患者可因严重低血糖而夭折;GSDⅠb型,G6Pase缺乏所致。其突出特点是患儿体内中性粒细胞、巨噬细胞、单核细胞功能缺陷,患儿易反复细菌感染,如口角炎、克罗恩病[2]。GSDⅠc型,肝脏中微粒体磷酸盐转运蛋白缺乏,患者具有G6P酶缺陷和焦磷酸酶的活性低下的临床表现;GSDⅠd型,葡萄糖转运酶缺乏,我国罕见。饮食治疗是GSDⅠ型的基本治疗方法。
3 GSDⅡ型
Pompe病,酸性-α-葡萄糖苷酶(GAA)缺乏使糖原分解障碍,糖原在组织中累积。主要侵及心脏、骨骼肌、平滑肌,部分累及大脑基底动脉。据发病年龄分为4型:婴儿型、儿童型、青少年型、成年型。婴儿型通常在出生后6个月内出现严重的张力减退、呼吸道感染、运动迟缓、肝肿大、心肺功能不全,多致死;儿童期的症状呈进展性,主要为近端肌肉无力;青少年型和成人型多累及骨骼肌,主要表现为下肢近端肌肉无力,伴躯干受累,偶有呼吸功能不全。病情严重程度与体内残余酶活性及发病年龄呈负相关。该型可通过抗人肝酸性-α-糖苷酶在酸性条件下检测白细胞中GAA活性下降程度而发现。其发病机制可能涉及机体自噬功能[3]。目前采用酶替代治疗在该型中已取得较好疗效。
4 GSDⅢ型
Coris、Forbes病,糖原脱支酶(GDE)具有双重催化功能,即寡聚-(1,4→1,4)-葡萄糖转移酶和淀粉-1,6-葡萄糖苷酶。GDE活性缺失,使葡萄糖分解障碍,大量异常糖链蓄积于肝脏或肌肉中。主要表现为肝肿大、生长发育迟缓,常并发肝纤维化、心肌病,后期可进展为肝癌和肥厚性心肌病,部分存在认知障碍[4]。该型分为4种亚型,Ⅲa型:约占Ⅲ型的85%,肝脏和肌肉缺乏GDE,主要累及心、肝、骨骼肌,多表现为肝肿大,低血糖,生长迟缓,心肌肥大;Ⅲb型:肝脏中缺乏GDE,约占Ⅲ型的15%,主要表现为肝脏疾病;Ⅲc型:葡萄糖苷酶活性缺乏,仅累及肌肉;Ⅲd型:葡萄糖苷酶活性正常,葡萄糖转移酶缺陷,累及肌肉和肝脏。低蛋白、低脂肪饮食可使心肌病症状得到改善[5]。
5 GSDⅣ型
糖原分支酶(GBE)缺乏,致支链淀粉样多糖沉积于各组织器官中。该型可分为3种亚型:婴幼儿型、青年型和成人型。婴幼儿型,即安徒生病,GBE完全缺乏,具有严重致死性,主要表现为全身多个器官系统受累,包括中枢和周围神经系统,以肝、脾、心肌损伤最明显,患儿多死于肝衰竭,多数患儿于1岁前出现生长停滞。青年型主要累及心脏和肝脏。成人型主要累及神经系统,又称成人多聚糖蛋白体病(APBD),最常见的临床表现为神经源性膀胱病和轴索神经病变[6],患者常以泌尿功能障碍就诊于泌尿科,约有50%患者会出现痴呆的表现[7]。
6 GSDⅤ型
McArdle氏病,是肌肉糖原紊乱最常见的疾病。肌磷酸化酶(PYGM)缺乏使糖原分解障碍,在肌纤维内大量堆积,影响肌肉收缩功能。发病率约为1/10万~1/16.7万。成人患者表现典型,主要特征为易疲劳、运动不耐受、运动后横纹肌溶解、肌红蛋白尿反复发作,second-wind现象[8],甚至引起急性肾衰竭。血清肌酸激酶水平升高,高血钾、高血钙。其机制可能与糖酵解过程受损相关。该型筛查可用静息血清肌酸激酶水平,前臂运动试验以及电生理学研究,确诊用基因分析和肌磷酸化酶活性测定。
7 GSDⅥ型
Hers病,肝磷酸化酶(PYGL)可催化糖原分解为葡糖-1-磷酸,启动多种代谢途径。PYG有3种存在形式:PYGM、PYGL和PYGB。体内PYGL缺乏,致糖原分解障碍,ATP生产不足和功能障碍。其显著特征为多在婴幼儿期出现症状,主要表现为肝肿大、发育障碍、酮症性低血糖,身材矮小、对胰高血糖素反应性低,少数人出现轻度低血糖,心脏、骨骼肌症状少见[9],部分患者出现显著肝纤维化[10],后期可发展为肝腺瘤,肝细胞癌及局灶性结节增生。Ⅵ型和Ⅲ型需重点鉴别诊断。
8 GSDⅦ型
Tarui-Layzer综合征,磷酸果糖激酶(PFK)是无氧条件下糖酵解的关键酶,作用于糖酵解的早期,催化果糖-6-磷酸转化为1,6-二磷酸果糖[11]。PFK分3种亚型:PFKM、PFKL、PFKP。骨骼肌中仅表达PFKM,红细胞中可表达PFKL和PFKP[12]。该型患者骨骼肌中酶活性完全缺失,而肝脏中酶活性正常。临床表现为儿童期即开始出现劳力性肌病和间歇性溶血综合征,其特征在于肌病与溶血过程共存。部分长期存在轻微运动不耐,肥厚性心肌病。该型与Ⅴ型GSD在临床表现上相似,包括运动肌肉中存在过量的嘌呤降解,ATP平衡紊乱等,二者注意鉴别。
9 GSDⅧ、GSDⅨ型
GSDⅧ型已不存在,均归为GSDⅨ型。糖原磷酸化酶(PhK)缺乏引起的GSD约占25%以上。主要累及肝脏、肌肉,部分累及心脏、肾、神经及血液系统。PhK由4种亚基(α、β、γ和δ)组成,GSDⅨ型分为4型。Ⅸa型:肝PhK缺乏,糖原分解障碍。多于儿童期出现肝肿大,发育迟缓,酮症性低血糖。并发症少见,病情多呈良性趋势[13]。Ⅸb型:多累及肝脏和骨骼肌,于青少年期出现肌痛,肌红蛋白尿,肝肿大,禁食后低血糖,轻度肌张力减低。Ⅸc型:肌PhK缺乏,主要表现为肝肿大,低血糖和转氨酶升高,后期可发展为肝硬化、肝衰竭[14]。Ⅸd:由多种酶突变引起,主要累及骨骼肌,突变基因包括PHKA1、PHKG1、CALM1、CALM2、CALM3。磷酸甘油酸激酶(PGK)存在于除生精细胞以外的所有组织,PGK1缺乏,临床表现与红细胞、骨骼肌、中枢神经系统相关,溶血性贫血和中枢神经系统受累最多见。
10 GSDⅩ型
磷酸甘油酸变位酶(PGAM)作用于糖酵解终末,催化3-磷酸甘油酸向2-磷酸甘油酸转化。PGAM分两个亚型:PGAMM和PGAMB,成人肌肉中主要是PGAMM,其活性很强。该型主要表现为劳累性肌痉挛和肌红蛋白尿,肌痛,肌肉坏死,高血钙,痛风性关节炎,幼年期即可出现横纹肌溶解[15]。部分患者肌肉活检可发现由管状聚集体(TAs)组成的非特异性沉积[16]。肌肉活检糖原含量正常或略有增加。
11 以下为5种少见型别GSD
GSDⅪ型:乳酸脱氢酶(LDHA)活性减低,丙酮酸和乳酸间转化受阻。致组织中乳酸累积和循环性乳酸中毒。患者多在10~38岁出现症状,主要表现为运动不耐受,体内丙酮酸盐和糖酵解中间体明显增多,横纹肌溶解,肌红蛋白尿,以及不同程度肾损伤。肌肉组织内LDHA活性明显降低而血清肌酸激酶稍有升高。GSDⅫ型:醛缩酶A(ALDOA)缺乏症,ALDOA催化糖酵解过程中的果糖-1,6-二磷酸转化为3-磷酸甘油醛和磷酸二羟丙酮。ALDO分3种亚型:A型为组成型表达的管家酶,B型表达于肝、肾和小肠,C型表达于脑。主要表现为重症肌无力和遗传性溶血性贫血,可于儿童早期出现严重肌红蛋白尿,伴有轻微智力障碍[17]。ALDOB缺乏可致遗传性果糖不耐受,表现为严重肝病,可致死,可用精氨酸进行治疗增强体内酶活性和抗氧化作用。GSD型:肌肉特异性烯醇化酶(ENO3),该型为糖酵解代谢异常引起。ENO3含3种亚基:α亚基表达于多种组织,β亚基表达于肌肉组织,γ亚基表达于脑神经元。ENO3催化2-磷酸甘油酸与磷酸烯醇式丙酮酸间相互转化。主要表现为运动后肌痛,肌痉挛,高血钙,前臂运动试验乳酸轻度升高。GSD型:葡萄糖磷酸变位酶1(PGM1)表达于全身组织中,主要存在骨骼肌,催化葡糖-1-磷酸转化为葡萄糖-6-磷酸,并作用于糖原合成的逆反应过程和蛋白糖基化[18]。该型主要表现为先天性的肌无力,肌紧张,横纹肌溶解,运动不耐受,生长迟缓,内分泌异常,以及轻度的神经损伤[19-20]。与McArdle氏病症状相似,包括second-wind现象[21]。GSD型:糖原蛋白(GYG)缺乏症,GYG为一种糖基转移酶,催化葡萄糖残基从UDP-葡萄糖向自身转移。GYG1主要表达于骨骼肌和心脏。GYG1缺乏,骨骼肌中结构异常糖原蓄积[22],主要表现为近端肌肉无力,肌肉疼痛痉挛,常伴肌红蛋白尿,部分患者累及心肌[23]。GYG2主要表达于肝脏中,可在一定程度上代偿GYG1缺陷[24]。
12 Fanconi综合征
葡萄糖转运蛋白2(GLUT2)多表达于胰、肝、肾的上皮细胞,用于维持体内葡萄糖稳定,介导餐后葡萄糖向肝细胞内转运以及空腹状态下葡萄糖向血循环的输出。其临床表现为糖原在肝、肾中累积,伴近端肾小管特征性病变如糖尿,氨基酸尿和高磷酸尿。低血磷性佝偻病为其典型症状,部分文献中以GSDⅨ和GSDⅪ提及,基因测序显示GLUT2基因突变,可确诊。该型治疗多用未经烹煮的玉米淀粉小量多餐,以及维持水电解质平衡。
综上所述,目前对GSD的研究已取得显著成果,基因测序分析是诊断GSD的首选方法,准确,快速,同时避免肝活检对机体带来的损害,另通过羊水或绒毛膜基因检测可进行产前筛查,预防疾病。在治疗上未有成熟的方案,多采用饮食疗法,目前新的疾病疗法如基因治疗、干细胞治疗、酶替代治疗、氨基酸治疗等正在研究中。期望今后研究中能发现在蛋白组学和代谢组学方面新的特异性疾病标志物,从而多方面对患者疾病进展情况进行实时监测。
