酵母PMT1与PMT5双基因缺失对细胞复制性寿命的影响
2018-11-23崔红晶宋浩昌郑慧玲刘新光
崔红晶, 周 涛, 赵 炜, 宋浩昌, 袁 源, 郑慧玲, 刘新光*
(1.广东医科大学衰老研究所,广东 东莞 523808;2.广东省医学分子诊断重点实验室,广东 东莞 523808;3.东莞市衰老与抗衰老重点实验室,广东 东莞 523808)
酿酒酵母(Saccharomycescerevisiae)作为研究寿命调控机制的经典模式生物,与其他模式生物相比较,既有实验操作简便可行的特点,又与真核生物的基因组具有一定同源性。因此,通过研究寿命调控通路在酵母细胞中的具体作用,可以获得调控寿命通路的新信息,为进一步研究高等生物衰老相关疾病的发生机制提供一定的理论依据[1]。酿酒酵母蛋白质O-甘露糖转移酶(ProteinO-mannosyltransferase,PMT)家族是一类进化上保守的酶类,共有七个成员(Pmt1-7p),分为PMT1、PMT2和PMT4三个亚家族,具有50%~80%同源性,彼此之间有功能互补的特点[2]。酵母细胞中PMT1基因编码蛋白质(Pmt1p)与PMT2基因编码蛋白质(Pmt2p)形成聚合体,Pmt1p-Pmt2p、Pmt3p-Pmt5p与Pmt4p-Pmt4p等聚合体是PMT家族的主要成分,参与内质网蛋白质翻译后加工成熟的调控[3]。本课题组前期研究结果提示,酵母PMT1基因通过调控内质网应激反应通路,进而影响细胞复制性寿命[4]。本研究对PMT1与PMT5双基因缺失对酵母细胞寿命和出芽能力的影响做进一步研究,为探讨PMT家族成员在调节酵母寿命中的具体作用,以及为甘露糖基化修饰反应与人类相关疾病的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 酿酒酵母BY4742(MATαhis3Δ1leu2Δ0lys2Δ0ura3Δ0)、感受态大肠埃希菌(DH5α)、载体pRS305-pmt1-ko[4]和pRS306(低拷贝穿梭质粒)为本实验室保存。载体分别带有Leu和Ura营养筛选标签,具有氨苄青霉素抗性。
1.1.2 培养基 ① YPD培养基:胰蛋白胨1 g,酵母提取物0.5 g,加超纯水定容至50 mL,高压灭菌(固体培养基,另加1 g琼脂糖粉),灭菌后加入过滤除菌的40%(质量分数)葡萄糖2.5 mL;② SD/-Ura培养基:不含琼脂糖粉SD培养基1.335 g(固体培养基,含琼脂糖粉SD培养基2.335 g),限制性氨基酸(-Ura Do Supp)0.038 5 g,加超纯水定容至50 mL,高压灭菌;③ SD/-Ura/-Leu培养基:不含琼脂糖粉SD培养基1.335 g(固体培养基,含琼脂糖粉SD培养基2.335 g),限制性氨基酸(-Ura/-Leu/-His Do Supp)0.032 5 g,加超纯水定容至50 mL,高压灭菌,灭菌后加入过滤除菌的50 μL(100×His)。
1.1.3 试剂与仪器 EasyTaqDNA聚合酶(货号:AP111-01)购自北京全式金生物技术有限公司;限制性内切酶MluⅠ购自TaKaRa公司;酵母提取物(货号:LP0021)和胰蛋白胨(货号:LP0042)购自生工生物工程(上海)股份有限公司;SD培养基(货号:630411和630412)和限制性氨基酸(货号:630416和630423)均购自Clontech公司;PCR仪(Mastercycler,德国Eppendorf公司),凝胶成像系统(AlphaImager EC,美国Alpha公司),正立式金相生物显微镜(Scope AⅠ,德国Zeiss公司),全自动生长曲线分析仪(Bioscreen C,芬兰Bioscreen公司)。
1.1.4 引物 引物由上海英骏生物技术有限公司合成(表1)。
1.2 方法
1.2.1PMT5基因缺失菌株的构建和验证 构建方法参照文献[5-6]。以pRS306质粒为模板,PMT5-F和PMT5-R为引物,PCR扩增PMT5基因破坏元件。采用醋酸锂的方法将破坏元件转化酵母细胞,经Ura营养缺陷型培养基筛选。PCR鉴定阳性克隆基因组DNA,鉴定引物分别为PMT5基因开放阅读框外侧引物(V-Pmt5-F/V-Pmt5-R),营养筛选标签URA3基因内部引物和PMT5基因开放阅读框外侧引物(URA-int-F/V-Pmt5-R),采用EasyTaqDNA聚合酶,反应体系和反应条件参照说明书进行。
1.2.2PMT1与PMT5双基因缺失菌株的构建和验证 构建方法参照文献[4,7-8]。MluⅠ酶切线性化重组载体pRS305-pmt1-ko,采用醋酸锂方法将线性化重组载体转化PMT5基因缺失菌株。经Leu和Ura营养缺陷型培养基筛选,PCR鉴定阳性克隆基因组DNA,鉴定引物分别为营养筛选标签LEU2基因内部引物(Leu-int-F/Leu-int-R),PMT1基因开放阅读框外侧引物(Pmt1-C-F/Pmt1-N-R),PMT1基因开放阅读框外侧引物与营养筛选标签LEU2基因内部引物(V-Pmt1-F/Leu-int-R),PMT1基因开放阅读框内部引物(Pmt1-int-F/Pmt1-int-R),以及鉴定PMT5单基因缺失菌株所需的PCR引物。采用TransTaqHiFi DNA聚合酶,反应体系和反应条件参照说明书进行。

表1 本实验所用引物序列Table 1 Nucleotide sequence of primers used for making and verifying yeast strains
1.2.3 复制性寿命检测 检测方法参照文献[9]。利用光学显微镜的纤维操作系统分离酵母母细胞和子细胞,依据酵母母细胞产生子代细胞数量,绘制寿命曲线图。每次实验所用酵母细胞为20个,实验至少重复3次。采用 SPSSS 19.0 统计软件,Wilcoxon秩和检验分析寿命数据。复制性寿命用平均数表示,P<0.05 为差异有统计学意义。
1.2.4 生长曲线 实验方法参照文献[9-10]。制备300 μL酵母细胞新鲜培养物(含2%或0.5%葡萄糖YPD),A600值约为0.04,30 ℃、180 r/min振荡培养24 h;每隔2 h 用全自动生长曲线分析仪测定标本A600值。3次独立重复实验,依据吸光度平均值,绘制酵母细胞生长曲线图。
2 结果与分析
2.1 PMT5基因缺失菌株的构建及鉴定
PMT5基因破坏元件(含URA3基因编码序列)全长1 232 bp,经1%琼脂糖凝胶电泳确认正确(图1A)。PCR验证阳性克隆和BY4742酵母细胞基因组DNA,结果显示,引物V-Pmt5-F和V-Pmt5-R扩增片段大小分别为1 455和2 536 bp;引物URA-int-F和V-Pmt5-R扩增片段大小分别为505和0 bp,结果与预期大小一致(图1B),表明PMT5基因缺失菌株(pmt5Δ)构建成功。
2.2 PMT1与PMT5双基因缺失菌株的构建及鉴定
依据基因同源重组的原理,构建PMT1与PMT5双基因缺失菌株。PCR方法验证阳性克隆和BY4742酵母细胞基因组DNA。结果显示,引物Leu-int-F/Leu-int-R扩增片段大小分别为1 097和0 bp;Pmt1-C-F/Pmt1-N-R扩增片段大小分别为6 740和3 681 bp;V-Pmt1-F/Leu-int-R扩增片段大小分别为3 685和0 bp;Pmt1-int-F/Pmt1-int-R扩增片段大小分别为0和213 bp;V-Pmt5-F/V-Pmt5R扩增片段大小分别为1 454和2 536 bp;URA-int-F/V-Pmt5-R扩增片段大小分别为573和0 bp,结果与预期大小一致(图2),表明PMT1与PMT5双基因缺失菌株(pmt1Δpmt5Δ)构建成功。
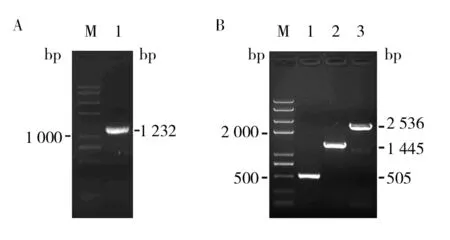
图1 pmt5Δ菌株的验证Fig.1 Verification of the pmt5Δ strain by PCR

图2 pmt1Δpmt5Δ 菌株的验证Fig.2 Verification of the pmt1Δpmt5Δ strain by PCR
2.3 酵母菌株的复制性寿命
选取BY4742、PMT1和PMT5单基因缺失菌株(pmt1Δ和pmt5Δ),以及双基因缺失菌株(pmt1Δpmt5Δ),检测酵母细胞的复制性寿命。结果显示(图3),与BY4742酵母细胞的平均寿命(25代)比较,pmt1Δ酵母细胞的寿命显著延长,与我们早期研究结果一致[4];而pmt5Δ酵母细胞的寿命无明显变化,平均寿命为26代(P>0.05);pmt1Δpmt5Δ菌株的寿命明显缩短,平均寿命为21代(P<0.01)。实验结果表明,PMT5单基因缺失不影响酵母细胞复制性寿命,PMT1和PMT5双基因缺失明显缩短酵母细胞的寿命。

图3 酵母细胞的复制性寿命Fig.3 The replicative lifespan (RLS) curves of yeast cells
2.4 酵母菌株的生长曲线
热量限制(Calorie restriction,CR)可以延长许多物种细胞的寿命。通过检测酵母细胞在CR条件下的分裂增殖情况,进一步反应PMT1与PMT5双基因缺失对酵母细胞增殖的影响。结果显示,在正常培养条件下(含2%葡萄糖),与BY4742酵母细胞比较,pmt1Δ菌株和pmt5Δ菌株的生长曲线无明显差异,pmt1Δpmt5Δ菌株的生长曲线低平;在CR培养条件下(含0.5%葡萄糖),与BY4742酵母细胞比较,pmt1Δ菌株和pmt5Δ菌株的生长曲线无明显差异,pmt1Δpmt5Δ菌株的生长曲线低平,细胞生长活力较差(图4)。结果表明,无论在正常培养条件或CR培养条件下,pmt1Δpmt5Δ菌株都表现为增殖活力下降,这可能是其寿命缩短的重要原因。

图4 酵母细胞的增殖活性Fig.4 The proliferation activity of yeast cells
3 讨 论
蛋白质甘露糖基化修饰过程在真菌、动物和人类细胞中都具有一定的保守性。酿酒酵母PMT家族定位于细胞内质网,糖基化修饰分泌蛋白质或膜蛋白质,参与调控内质网蛋白质的输出和蛋白质的动态平衡,进而影响细胞生物学功能的发挥[3,11-12]。酵母PMT家族成员之间易形成聚合体,且主要以Pmt1p-Pmt2p、Pmt3p-Pmt5p和Pmt4p-Pmt4p等几种聚合体形式存在,并发挥作用。在敲除聚合体中一个基因的前提下,Pmt1p-Pmt3p或Pmt2p-Pmt5p也相互作用,这种协同补偿功能有助于维持细胞内甘露糖转移酶的活性,进而影响细胞的生长与增殖。
本研究通过PMT5基因缺失菌株和PMT1与PMT5双基因缺失菌株的细胞复制性寿命进行研究,进一步确定PMT家族部分成员基因缺失对细胞分裂增殖的影响,结果显示,pmt5Δ菌株的平均寿命无明显变化,说明PMT5基因缺失未影响酵母细胞的分裂增殖能力,推测PMT家族单个基因缺失不影响酵母细胞正常生长的可能原因是其他成员可补偿PMT5基因在细胞内的生理功能。研究还发现pmt1Δpmt5Δ菌株的平均寿命明显缩短,推测PMT1与PMT5双基因缺失可能通过影响酵母细胞的主要生理功能,进而影响细胞的生长与增殖。这与已报道PMT家族中PMT1与PMT2双基因缺失的酵母细胞甘露糖酶活性降低,细胞形态改变,生长缺陷等结论相类似[13]。因此,PMT1与PMT5双基因缺失的酵母细胞也可能存在生长缺陷。
CR可以延长酵母、线虫、果蝇和小鼠等许多物种细胞的寿命[14]。为进一步探讨CR对PMT1与PMT5双基因缺失酵母细胞增殖活性的影响,本研究利用全自动生长曲线分析仪检测酵母细胞的增殖速度,结果显示CR没有增强酵母PMT家族成员基因缺失细胞的分裂增殖能力,没有改善pmt1Δpmt5Δ菌株的生长状态,推测PMT1与PMT5双基因缺失导致酵母细胞生长缺陷,CR不能改善细胞的分裂增殖能力,或者PMT家族的甘露糖基化功能可能是CR延长细胞寿命的必需条件。有研究提示细胞寿命可能与所消耗的蛋白质和碳水化合物的比例相关,认为摄入营养不平衡的食物,机体会提前衰老[15-16]。蠕虫和鱼等物种对与CR相关的药物白藜芦醇很敏感,但果蝇和老鼠的寿命不受其影响,这也说明CR影响寿命的因素极其复杂,这些因素影响寿命的具体调控机理有待进一步研究[17]。
PMT5基因缺失不影响酿酒酵母细胞的复制性寿命,PMT1与PMT5双基因缺失明显缩短酵母细胞的寿命,影响酵母细胞的分裂增殖能力。CR没有改善基因缺失酵母细胞的生长状态,这提示CR没有改善酵母PMT家族基因缺失细胞的分裂增殖能力。因此,PMT1与PMT5双基因调控细胞寿命的具体机制有待进一步研究。
致谢感谢美国华盛顿大学Matt Keaberlein副教授和美国BUCK衰老研究所Brian K Kennedy博士赠送的BY4742菌株和穿梭载体,以及在酵母实验技术方面给予的精心指导。
