干旱胁迫下BR与N、P、K配合对羊草生长及抗旱性的影响
2018-11-19宋吉轩吕俊宗学凤何秀娟徐宇吴潇王三根
宋吉轩,吕俊,宗学凤,何秀娟,徐宇,吴潇,王三根*
(1.贵州省农业科学院生物技术研究所,贵州 贵阳 550006;2.西南大学农学与生物科技学院,重庆400715)
羊草(Leymuschinensis)又名碱草,为禾本科赖草属植物,是草甸草原和典型草原的重要建群种之一,具有高产、优质及耐牧等特点,是我国具有优势的禾本科多年生牧草和生态草[1]。近年来由于受全球变化的影响,我国草原区温度和降水格局变化显著[2],草原区面临着干旱胁迫的威胁,在一定程度上限制了羊草生产力的提高。
干旱胁迫是影响植物生长和代谢的主要逆境因素之一[3-4],它会使植物体内产生一系列的生理生化变化,从而影响到植物正常的生长发育。羊草虽具有较强的抗旱性,但当其生境严重缺水时,其生长发育、产量及品质也会受到严重的影响[5]。利用外源物质对植物进行处理,是提高植物抗逆性简便、可行的方法之一[6]。而油菜素内酯(brassinolide, BR)作为一种新型的植物生长调节剂在植物生长发育中具重要的作用,它可参与细胞伸长和分裂、维管束分化、叶形态和衰老等调控,同时它还能提高植物产量、品质及抗性[7-9]。通过采取不同的措施可以缓解或减轻干旱胁迫对植物的伤害,如用植物生长调节剂与叶面营养等处理[10]。在促进植株生长后,叶面营养氮、磷、钾(nitrogen, N; phosphorus, P; potassium, K)的快速补充尤为重要[11]。叶面补充N、P、K具有养分吸收快、肥效好,养分利用率高、用量少、环境污染风险小等优点[12]。N、P、K由于其快速地补充营养,对植物生长有很好的效果,还能增强其抗性[13]。干旱胁迫下,以羊草作为材料单独喷施BR前期已进行了报道[14],在而后的研究中发现,当利用BR缓解干旱胁迫后,其生长往往因为营养不足而有滞后现象。本研究在干旱胁迫下,对羊草幼苗进行BR与N、P、K处理,研究其对羊草的生长、渗透调节及相关酶特性的影响规律,解析其生理效应,为在生产实践中利用BR与N、P、K配合提高羊草的抗旱性提供依据。
1 材料与方法
1.1 试验设计
试验于2016年4-7月进行。盆栽试验所用羊草种子来自内蒙古锡林郭勒草原中国农业科学院草原研究所野外试验地。首先对羊草种子进行发芽处理[15],以培养出来的羊草幼苗为试验材料。以土壤相对含水量80%为对照(CK1),土壤相对含水量50%(CK2)作干旱胁迫处理。当羊草幼苗生长至18~21 cm时,分别在正常(CK1)和干旱胁迫(CK2)下选取最佳处理浓度的BR与N、P、K进行处理,正常(CK1)情况下,尿素(1%)+磷酸二氢钾(1%)(T1)、BR(0.10 mg·L-1)(T2)和尿素(1%)+磷酸二氢钾(1%)+BR(0.10 mg·L-1)(T3);干旱(CK2)情况下,尿素(1%)+磷酸二氢钾(1%)(T4)、BR(0.10 mg·L-1)(T5)和尿素(1%)+磷酸二氢钾(1%)+BR(0.10 mg·L-1)(T6),共计6种处理。每个处理40株幼苗,3次重复。为避免光照对BR的效果造成影响,处理时间均为傍晚,连续3 d。处理15 d后取样测定,取样时选取植株中等大小的功能叶片测定相应的指标。
1.2 测定指标
株高量取植株茎基部到顶叶尖端的绝对距离;去除羊草表面杂物用水冲洗干净,晾干后称量整株重即鲜重;然后在105 ℃烘箱中杀青15 min,在65 ℃恒温下干燥至恒重,最后称重即干重。
根系活力采用TTC法测定[16]。可溶性糖含量采用蒽酮比色法测定[17];可溶性蛋白质含量采用考马斯亮蓝法测定[18];叶片超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)、抗坏血酸过氧化物酶(aseorbate peroxidase, APX)和谷胱甘肽还原酶(glutathione reductase, GR)活性采用李忠光等[19]的方法测定;植物营养元素氮含量采用凯氏定氮法测定[20];磷含量采用浓硫酸消煮,钼锑抗比色法测定[21];钾含量采用浓硫酸消煮,原子吸收分光光度法测定[22];硝酸还原酶(nitrate reductase, NR)活性采用离体法测定[23];酸性磷酸酶(acid phosphatase, ACP)活性采用比色法测定[24];苹果酸脱氢酶(malate dehydrogenase, MD)活性采用Sayre等[25]的方法测定。丙二醛(malonyldialdehyde, MDA)含量采用硫代巴比妥酸(TBA)法测定[14]。脯氨酸含量采用水合茚三酮法测定[14]。叶片电导率(leaf conductivity, EC)采用电导仪测定[14]。
1.3 数据统计
采用Excel和SPSS软件进行数据统计分析。利用DPS 19.0软件进行单因素方差分析,以Duncan’s 新复极差法比较各处理间的差异性。
2 结果与分析
2.1 干旱胁迫下BR与N、P、K对羊草生长及营养代谢相关酶的影响
由表1可知,与正常土壤水分(CK1)相比,经T1处理,其株高、鲜重、干重和根系活力分别增加了30.35%、72.88%、38.96%和10.04%,其中株高差异显著;T2与CK1相比,株高、鲜重、干重和根系活力分别增加了23.65%、75.82%、38.96%和67.64%,其中鲜重差异显著;T3处理与CK1相比,其株高、鲜重、干重和根系活力各个指标均达到最大值,分别增加39.26%、114.71%、54.55%和95.99%,且差异均达显著水平。
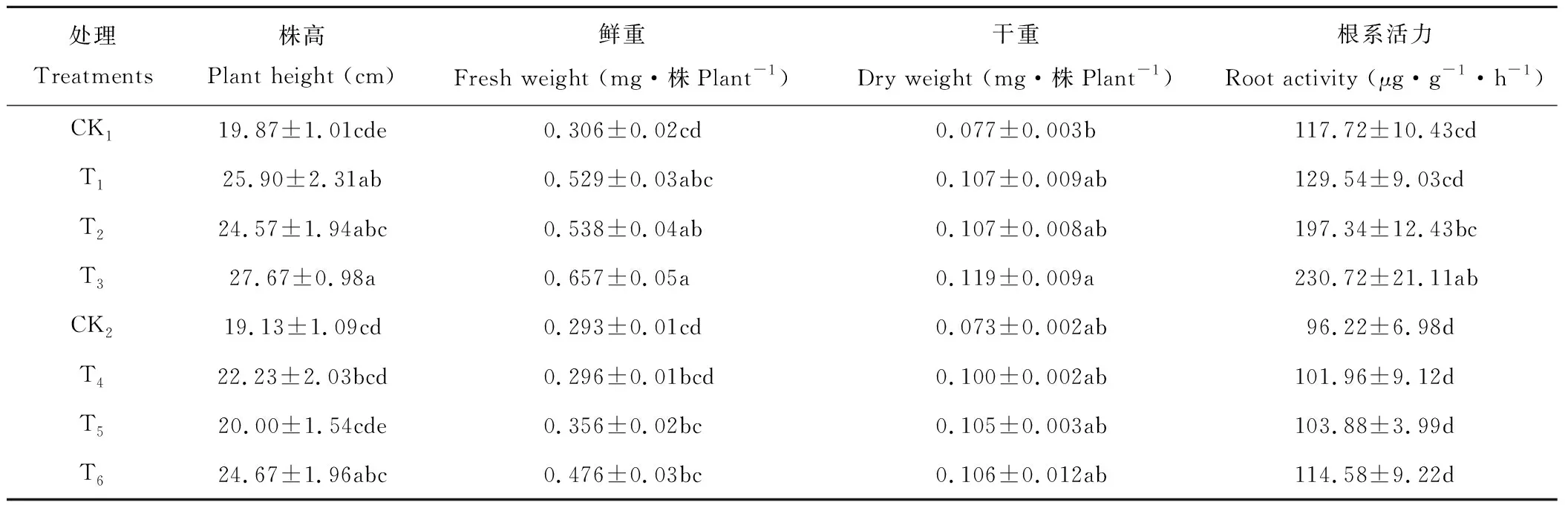
表1 干旱胁迫下BR与叶面营养对羊草生长的影响Table 1 Effects of BR and foliar nutrition on the growth of L. chinensis under drought stress
注:同列不同字母表示差异达显著水平(P<0.05),下同。
Note: Different letters mean significant different at 0.05 level. The same below.
在干旱胁迫下(CK2),羊草的株高、鲜重、干重和根系活力均降低,分别比CK1减少了3.72%、4.25%、5.19%和18.26%。T4与CK2相比,其株高、鲜重、干重和根系活力分别增加了16.20%、1.02%、36.99%和5.97%;T5与CK2相比,其株高、鲜重、干重和根系活力分别增加了4.55%、21.50%、43.84%和7.96%;T6与CK2相比,其株高、鲜重、干重和根系活力均有增加且达到最大值,分别增加28.96%、62.46%、45.21%和19.08%,且这些指标还达到甚至超过了正常土壤水分(CK1)的处理。
由表2可知,与正常土壤水分(CK1)相比,此时T1植株的硝酸还原酶和酸性磷酸酶活性显著增强,分别上升了12.76%和32.99%,而苹果酸脱氢酶活性显著减弱,下降了23.79%;T2与CK1相比,其硝酸还原酶和酸性磷酸酶活性分别增强了1.72%和4.06%,苹果酸脱氢酶活性降低了19.53%;T3与CK1相比,硝酸还原酶和酸性磷酸酶活性分别增加44.48%和27.01%,苹果酸脱氢酶活性则降低28.19%,3种酶活性与对照差异均达到显著水平。
在干旱胁迫下(CK2),羊草的硝酸还原酶和酸性磷酸酶活性分别比CK1降低了45.86%和40.0%,且差异均达显著水平,而苹果酸脱氢酶活性则增加了10.28%。T4与CK2相比,硝酸还原酶和酸性磷酸酶活性分别上升22.93%和49.75%,苹果酸脱氢酶活性下降44.34%,3种酶活性与对照差异均达到显著水平;T5与CK2相比,硝酸还原酶和酸性磷酸酶活性分别上升18.47%和3.21%,苹果酸脱氢酶活性下降38.48%,除酸性磷酸酶活性外其他两个酶活性与对照差异达显著水平;T6与CK2相比,其硝酸还原酶和酸性磷酸酶活性分别增加31.21%和40.44%,苹果酸脱氢酶活性则下降44.61%,且3种酶活性与对照差异均达到显著水平。
由表3可知,与正常土壤水分(CK1)相比,T1植株的N、P和K含量均增加,分别提高13.62%、182.09%和35.96%,且差异均显著;T2与CK1相比N、P和K分别增加7.11%、19.40%和21.35%,其中N、K含量差异达显著;T3与CK1相比,N、P和K含量均显著增加,分别提高了18.70%、228.36%和26.97%,其中N与P含量达到了各处理的最大值。
在干旱胁迫下(CK2),羊草的N、P和K含量比CK1分别降低了6.91%、14.93%和12.36%。T4与CK2相比,其N、P和K均有增加,分别为13.97%、215.79%和47.44%,差异均达到显著水平;T5与CK2相比,N、P和K分别增加10.70%、92.98%和30.77%,且差异均显著;T6与CK2相比,N、P和K分别增加20.74%、236.84%和42.31%,差异均达到显著水平,且均高于CK1。
2.2 干旱胁迫下BR与叶面营养对羊草膜脂过氧化及渗透调节物质的影响

表2 干旱胁迫下BR与叶面营养对羊草营养代谢相关酶活性的影响Table 2 Effects of BR and foliar nutrition on the enzyme activities of nutritional metabolism in L. chinensis under drought stress

表3 干旱胁迫下BR与叶面营养对羊草植株氮、磷、钾含量的影响Table 3 Effects of BR and foliar nutrition on N, P, K in L. chinensis under drought stress (%)
由表4可知,在正常土壤水分(CK1)下,T1可使丙二醛和叶片电导率分别降低2.35%和9.11%,而脯氨酸、可溶性蛋白和可溶性糖分别增加3.02%、4.08%和1.35%;T2与CK1相比,其丙二醛和叶片电导率均分别降低1.10%和19.77%,脯氨酸、可溶性蛋白和可溶性糖含量则分别增加41.16%、19.53%和3.96%,其中只有可溶性蛋白差异达到显著水平;T3与CK1相比,丙二醛和叶片电导率分别降低10.97%和25.71%,两项指标下降到最低值,脯氨酸、可溶性蛋白和可溶性糖分别增加155.74%、27.22%和20.92%,且增加到最高值,其中脯氨酸和可溶性蛋白差异显著。
在干旱胁迫下(CK2),羊草的丙二醛、脯氨酸、可溶性蛋白、可溶性糖和叶片电导率均增加,与正常水分条件的CK1相比差异均显著,分别增加60.89%、201.81%、34.32%、48.18%和78.15%。T4与CK2相比,其中的丙二醛和叶片电导率有所降低,分别下降33.01%和14.48%,而脯氨酸、可溶性蛋白和可溶性糖含量进一步增加,分别上升2.53%、15.81%和3.80%,丙二醛与可溶性蛋白含量与CK2差异显著;T5与CK2相比,其丙二醛和叶片电导率分别降低25.09%和50.33%,而脯氨酸、可溶性蛋白和可溶性糖含量分别增加26.88%、16.30%和5.78%,除可溶性糖外,其他指标与CK2差异均显著;T6与CK2相比,丙二醛和叶片电导率分别降低37.42%和55.79%,两项指标下降到最低值,而脯氨酸、可溶性蛋白和可溶性糖含量分别增加57.20%、22.82%和5.94%,且达到最高值,其中除可溶性糖外,其他指标与CK2差异均显著。

表4 干旱胁迫下BR与叶面营养对羊草膜脂过氧化及渗透调节物质的影响Table 4 Effects of BR and foliar nutrition on membrane oxidation and osmotic adjustment substance in L. chinensis under drought stress
2.3 干旱胁迫下BR与叶面营养对羊草植株抗氧化酶活性的影响
由表5可知,在正常土壤水分(CK1)下,T1植株的POD、SOD、CAT、GR和APX活性分别增加136.48%、16.43%、33.37%、54.55%和163.64%,其中POD、CAT和GR三个酶活性差异达显著水平;T2与CK1相比,5种抗氧化酶活性分别增加136.53%、6.08%、9.06%、245.45%和163.64%,其中POD、SOD和GR三个酶活性差异达显著水平;T3与CK1相比,5种抗氧化酶活性分别增加156.86%、31.61%、40.24%、163.64%和9.74%,与对照(CK1)差异均达显著水平。

表5 干旱胁迫下BR与叶面营养对羊草植株抗氧化酶活性的影响Table 5 Effects of BR and foliar nutrition on antioxidant enzyme activities in L. chinensis under drought stress (U·g-1·min-1)
在干旱胁迫下(CK2),羊草的POD、SOD、CAT、GR和APX活性与正常水分条件的CK1相比,分别增加90.19%、4.75%、57.08%、172.73%和56.58%,除SOD外其他4种酶活性差异显著。T4与CK2相比,5种抗氧化酶活性进一步增加,分别上升106.29%、30.01%、18.50%、2.63%和9.24%,且差异均达显著水平;T5与CK2相比,5种抗氧化酶活性也进一步增加,分别上升86.15%、31.56%、22.78%、30.0%和10.59%,除APX外其他4种酶活性差异达显著水平;T6与CK2相比,POD、SOD、CAT、GR和APX 5种抗氧化酶活性增加幅度最大,分别增加158.40%、38.15%、32.97%、30.0%和28.74%,不但与CK2差异均达显著水平,而且在所有处理中这5种抗氧化酶活性都达到最大值。
3 讨论
叶面营养可以快速地补充植株无机养分,对植物生长有很好的促进效果[26]。通过植物生长调节剂与叶面营养配合施用,可以克服因为植物激素促进生长而营养不足的情况,增加植物产量及提高植物品质[27]。上述研究表明,适当浓度的植物生长调节剂或叶面营养对羊草的株高、鲜重、干重和根系活力均表现出很好的促进作用,变化趋势跟刘美茹[28]在正常情况下采用BR喷施羊草幼苗结果一致。但本试验结果进一步表明,二者配合施用时,效率更高,特别在干旱胁迫下,喷施尿素(1%)+磷酸二氢钾(1%)+BR(0.10 mg·L-1)时,各指标均显著增加且达到最大值。因此本试验采用植物生长调节剂(BR)与叶面营养进行组合试验,在生产实践中具有重要的理论和实践意义。
许多研究指出,叶面喷施营养物质不仅可调节和平衡植物营养,而且还对相关代谢作用也有影响[29-30]。本试验结果表明,叶面营养能有效提高羊草叶片N、P、K含量,超过对照组的50%,这与赖锦山[29]的结果一致。同时,本研究也表明,在植物生长调节剂(BR)与叶面营养配合施用后,不仅N、P、K含量进一步提高,而且与N、P、K代谢相关的酶活性也发生改变,包括硝酸还原酶、酸性磷酸酶和苹果酸脱氢酶,这些酶活性的变化与氮、磷、钾在植物营养中的功能多样性相联系[31-32]。硝酸还原酶与酸性磷酸酶是诱导酶,其活性受相关元素含量的影响,如磷能显著提高植物中的酸性磷酸酶活性,是植物对缺磷胁迫的一种适应性反应[32-33]。苹果酸脱氢酶在植物体内广泛存在,由于其细胞定位及辅助因子的不同等具有很多的同工酶形式,从而具有重要的生理作用,也与钾代谢密切相关[34-35]。BR与叶面营养单独或配合在促进生长与增加N、P、K含量的同时,也引起代谢相关酶活性的变化,其机理值得深入研究。
植物在干旱胁迫下的生长过程中形成相应的适应调控机制,渗透调节能力和渗透调节物质的含量有着密切的关系[10]。植物通过积累脯氨酸、可溶性糖等渗透调节物质,可提高细胞液浓度,降低细胞水势,增加植物的吸水能力[36]。抗性强的植物可溶性蛋白含量增加明显,反之植物的抗性则降低[37]。本试验研究表明,在干旱胁迫下羊草经BR与叶面营养配合处理后,其体内脯氨酸、可溶性蛋白和可溶性糖含量等明显增加,从而继续保持了羊草较低的渗透势,进而增加植株细胞内溶质的浓度,这样就可明显地缓解干旱胁迫对羊草带来更多的伤害。与此同时,丙二醛和叶片电导率均降低,表明在逆境下BR与叶面营养配合处理对细胞有很好的保护作用,降低了膜脂的过氧化作用。
植物在长期进化过程中通过保护酶等方式以防氧毒性的形成,以保持植物活性氧离子代谢的平衡[38]。SOD、POD、CAT、GR和APX等协同作用,可有效地清除植物体内过量的自由基,增强植物适应干旱胁迫的能力[39-40]。本研究表明,羊草的5种保护酶活性在干旱胁迫时增加,经BR与叶面营养配合处理后,这些酶活性进一步增强。联系到上述丙二醛和叶片电导率的降低,可能配合处理进一步消除了干旱胁迫下植株体内产生的大量活性氧自由基与膜脂过氧化作用,从而增加了羊草的抗旱性,促进了生长。
4 结论
适当浓度的BR与叶面营养配合可减轻干旱胁迫对植株造成的伤害,促进羊草生长与物质积累,增强根系活力,增加可溶性糖、可溶性蛋白含量等,这与其能够减缓膜质过氧化作用,稳定膜系统的结构和功能,维持较高的渗透调节物质,增强保护酶活性等生理效应密切相关。
