丛枝菌根真菌和高羊茅对压实土壤的改良效应
2018-11-19李文彬宁楚涵徐孟刘润进郭绍霞
李文彬,宁楚涵,徐孟,刘润进,郭绍霞*
(1.青岛农业大学菌根生物技术研究所,山东 青岛 266109;2.青岛农业大学园林与林学院,山东 青岛 266109)
城市土壤是在原有自然土壤的基础上,长期受到城市地貌、气候、水文与污染的影响,经多次直接或间接的人为扰动或组装起来的现实利用价值较低的一类特殊的人为土壤[1]。由于世界人口和粮食问题,以往土壤研究大多关注农业用地,对城市土壤关注较少。许多研究表明,在城市中土壤压实普遍存在,并会带来一系列的不良后果,如土壤紧实度增加、容重增大等[2]。当土壤容重超出土壤承受能力,土壤孔隙度、透气性和水分渗透率会相对减少,影响土壤中水分的流动,阻碍植物根系的生长和伸展,压实土壤还会影响土壤中养分有效性,改变土壤化学物质等[3-4]。因此,增强植物抗性、修复和稳定城市绿地土壤系统,是值得探究的问题。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是土壤中的真菌菌丝与植物营养根系形成的共生体,已有研究结果表明,AMF能够促进生态系统物质转化、利用与循环,改善寄主植物N、P养分吸收能力,提高植物生物量等[5-7]。AMF菌丝分泌的球囊霉素相关土壤蛋白能够促进水分稳定的土壤团聚体形成,从而改善土壤通透性和持水性,同时提高土壤有机碳积累[8-10]。曹丽霞等[11]研究了接种土著AMF对羊草(Leymuschinensis)土壤中有机碳、碱解氮、有效磷、速效钾、根围土壤易提取球囊霉素相关土壤蛋白(easily extractable glomalin-related soil protein,EE-GRSP)含量、总球囊霉素相关土壤蛋白(total glomalin-related soil protein,T-GRSP)含量的影响,结果表明接种处理提高了羊草根围土壤氮、磷、钾含量,增加了群落物种的丰富度和植物多样性。变形球囊霉(Glomusversiforme)和隐类球囊霉(Paraglomusoccultum)可提高白三叶草(Trifoliumrepens)根围土壤0.25~0.50 mm和0.5~1.0 mm粒径水稳性团聚体含量,增加了根围土壤EE-GRSP和T-GRSP的含量,接种85 d后根系菌根侵染率为35%~75%[12]。付晓峰等[13]以南方红豆杉(Taxuschinensis)实生苗为材料并接种缩隔球囊霉(Septoglomusconstrictum),结果表明接种处理提高了南方红豆杉根围土壤可培养细菌、真菌和放线菌数量。
高羊茅(Festucaelata)是中国北方典型冷季型城市草坪草,不仅适应气候能力强,而且具有较强的抗干旱、耐高温、耐贫瘠、适应性广等特性,明显优于其他草种,因此在国内城市草坪绿地中被广泛使用[14-16]。有研究表明,城市高羊茅草坪绿地能有效减少地表径流量、削减暴雨径流峰值、减少水土流失,对防治土壤压实、侵蚀发挥着不可或缺的作用。本研究旨在探究不同AMF和高羊茅组合对压实土壤的影响,为AMF在压实土壤中的应用提供理论依据和技术基础。
1 材料与方法
1.1 试验材料
供试植物为高羊茅品种‘艾瑞3号’。供试AMF菌种摩西斗管囊霉(Funneliformismosseae,Fm)和根内根孢囊霉(Rhizophagusintraradices,Ri)均为青岛农业大学菌根生物技术研究所自有,由白三叶草扩繁,以保存于其根系及基质中的孢子、菌丝和菌根根段为接种物。供试土壤为砂壤土(园土∶沙=3∶1),pH值6.9,有机质含量10.8 g·kg-1,全氮含量0.64 g·kg-1,全磷含量0.7 g·kg-1,全钾含量15.4 g·kg-1,碱解氮含量51 mg·kg-1,有效磷含量13.4 mg·kg-1,速效钾含量63.4 mg·kg-1,土样混匀后晾晒,过0.9 mm,在121 ℃高温高压蒸汽灭菌2 h,备用。
1.2 试验方法
种植前准备:用10% H2O2浸泡高羊茅种子10 min进行表面消毒,然后置于滤纸上晾干。每盆播种50粒种子。用75%酒精溶液消毒盆栽容器。
接种种植:试验于2017年4-7月在青岛农业大学温室大棚内进行,设土壤压实梯度1.2、1.3、1.4、1.5 g·cm-3,分别接种AMF菌种摩西斗管囊霉、根内根孢囊霉、混合接种(F.mosseae+R.intraradices)和不接种对照(CK),共16个处理,随机排列,每个处理重复5次。供试土壤装入PVC管(内径10 cm、高23 cm),接种AMF的剂量为12000接种势[IP=N×W×K+S,IP为接种势,N为单位长度根段内含有的泡囊数量,W为根重(g),K为单位质量根系长度(cm),S为单位质量或体积接种剂内孢子数量],对照(CK)则接种等量灭菌接种物,以保持相同的其他根围微生物区系环境。根据土壤紧实度要求、容器体积及土壤含水量计算出每个处理所需的土壤重量,然后装土,采用木夯锤击压实至试验设计要求。每个处理土壤装至离管边3 cm处。
栽培与管理:种植7 d前后出芽,出芽前,每周浇2次水,浇水均匀而充足。出芽后每7 d浇1次营养液,以保证养分供给,管理期间注意温度、光线、通气条件的控制,严禁积水。于播种后3个月测定各项指标。
1.3 样品采集
2017年7月初采集PVC管土样,采样前3 d无灌溉、除草等措施。采样时先将植株地上部分及其他杂质清理干净,然后将环刀(底面积30 cm2,高5 cm)缓慢压入PVC管中取样。用于测定土壤容重、土壤孔隙度。另用铝盒装取15~20 g土壤用于测定土壤含水量,自封袋装取500 g土使其自然风干;测定土壤微团聚体、微生物组成以及土壤酶活性。
1.4 指标测定
1.4.1植株干重测定 植物样品地上部和根系洗净后用滤纸吸干,然后放入烘箱中,先在105 ℃杀青30 min,再在80 ℃烘干48 h至样品恒重,分别称取干物质生物量,计算干重。
1.4.2AMF侵染率的测定 根据刘润进等[17]改进的根段频率估测方法测定AMF侵染率,土壤中根外菌丝密度的测定参考Abbott等[18]的方法。
1.4.3土壤微生物组成的测定 采用稀释涂布平板法[19],即取10 g土壤于90 mL无菌水中摇匀并稀释,用移液枪吸取10 μL稀释液于NA培养基平板上,用玻璃棒涂匀后,于30 ℃下培养3 d后计数根围土壤中真菌、细菌和放线菌数量。
1.4.4土壤物理指标测定 土壤含水量采用(105±2) ℃烘干法测定[20];土壤容重采用环刀法测定[20];土壤孔隙度=(1-容重/比重)×100%;土壤pH采用pH计(雷磁pHS-3C)测定;土壤水稳性团聚体含量采用人工筛分法测量[20];全氮采用凯氏定氮法[20];速效磷采用钼锑抗比色法[20];速效钾采用1 mol·L-1NH4OAC浸提,火焰光度法[20];有机质含量采用低温外加热重铬酸钾氧化-比色法测定[20]。
1.4.5土壤酶活性的测定 蔗糖酶活性采用3,5-二硝基水杨酸比色法测定[21],脲酶活性采用靛酚蓝比色法测定[21],过氧化氢酶活性采用高锰酸钾滴定法测定[21],土壤多酚氧化酶活性用邻苯三酚比色法测定[21]。
1.4.6球囊霉素相关土壤蛋白的测定 易提取球囊霉素相关土壤蛋白(EE-GRSP)、总球囊霉素相关土壤蛋白(T-GRSP)采用Bradford法测定[22]。
1.5 数据处理
采用Microsoft Excel 2003软件对数据进行处理和绘图,采用DPS 7.5和SPSS 11.5统计分析软件对数据进行差异显著性检验(LSD法,α=0.05)。
2 结果与分析
2.1 不同土壤容重下AMF和高羊茅对土壤理化性状的影响
同一土壤容重下,双接种AMF处理的土壤含水量和土壤孔隙度显著大于单接种AMF处理和对照,而对土壤pH的影响不显著。接种效果表现为共同接种F.mosseae+R.intraradices>单一接种F.mosseae>单一接种R.intraradices>对照。1.5 g·cm-3土壤容重下,共同接种F.mosseae+R.intraradices处理的土壤含水量比对照提高38%,土壤孔隙度提高9%,土壤容重下降9%(表1)。
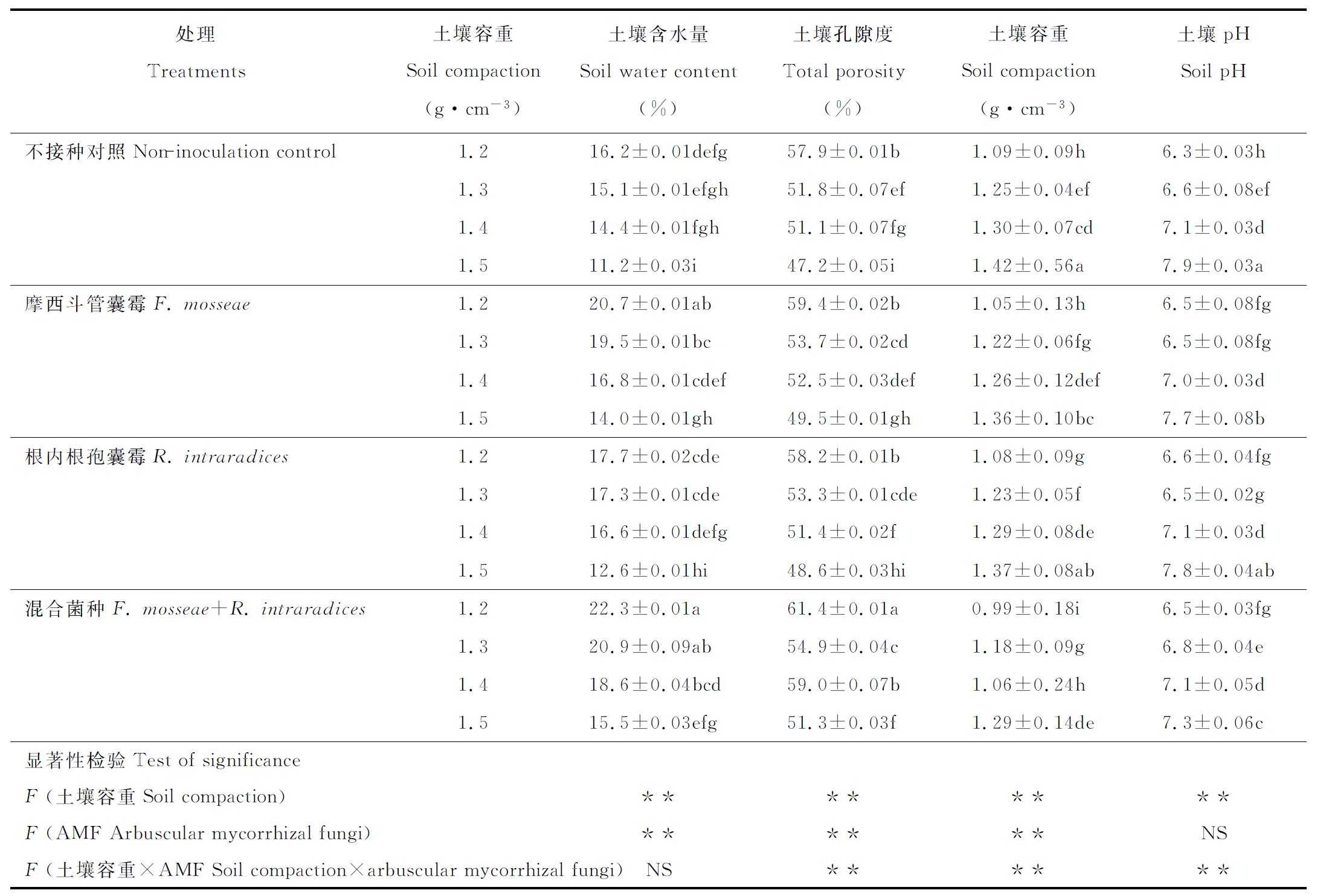
表1 不同土壤容重下AMF和高羊茅对土壤理化性状的影响Table 1 Effects of AMF and F. elata on soil physical and chemical properties under different soil compaction
注:AMF:丛枝菌根真菌;NS表示不显著;*表示在5%水平差异显著;**表示在1%水平差异显著;同列不同小写字母表示处理间差异显著(P<0.05)。下同。
Note: AMF:Arbuscular mycorrhizal fungi;NS means no significant difference;*means significant difference at 5% level; **means significant difference at 1% level. In each column, different lowercase letters mean significant difference among treatments (P<0.05). The same below.
2.2 不同土壤容重下AMF和高羊茅对土壤团聚体组成的影响
土壤容重能够显著影响土壤团聚体结构,随土壤容重的增加,微团聚体(<0.25 mm)的含量先增加后减少,而>2 mm的土壤团聚体含量变化无明显规律。同一土壤容重下与未接种处理相比,接种AMF处理的微团聚体(<0.25 mm)含量减少,0.5~2.0 mm、>2 mm的土壤团聚体含量增加。1.5 g·cm-3土壤容重下,共同接种F.mosseae+R.intraradices处理的土壤团聚体(0.25~0.50 mm)达到最大含量15.1%(表2)。方差分析表明,AMF与土壤容重的交互作用对土壤团聚体(>2 mm、<0.25 mm)含量的影响显著。
2.3 不同土壤容重下AMF和高羊茅对微生物群落组成的影响
土壤压实显著影响土壤中微生物数量,随土壤容重的增加,土壤中细菌、真菌、放线菌的数量呈减少趋势。与未接种对照相比,接种F.mosseae+R.intraradices、F.mosseae和R.intraradices均能够增加土壤中细菌、真菌、放线菌的数量,且F.mosseae+R.intraradices处理优于单一接种处理。1.5 g·cm-3土壤容重下,共同接种的真菌、细菌与放线菌数量分别为3.11×104cfu·g-1、2.25×105cfu·g-1,4.88×105cfu·g-1。AMF和土壤容重的交互作用对土壤中真菌、细菌和放线菌的数量影响不显著(表3)。
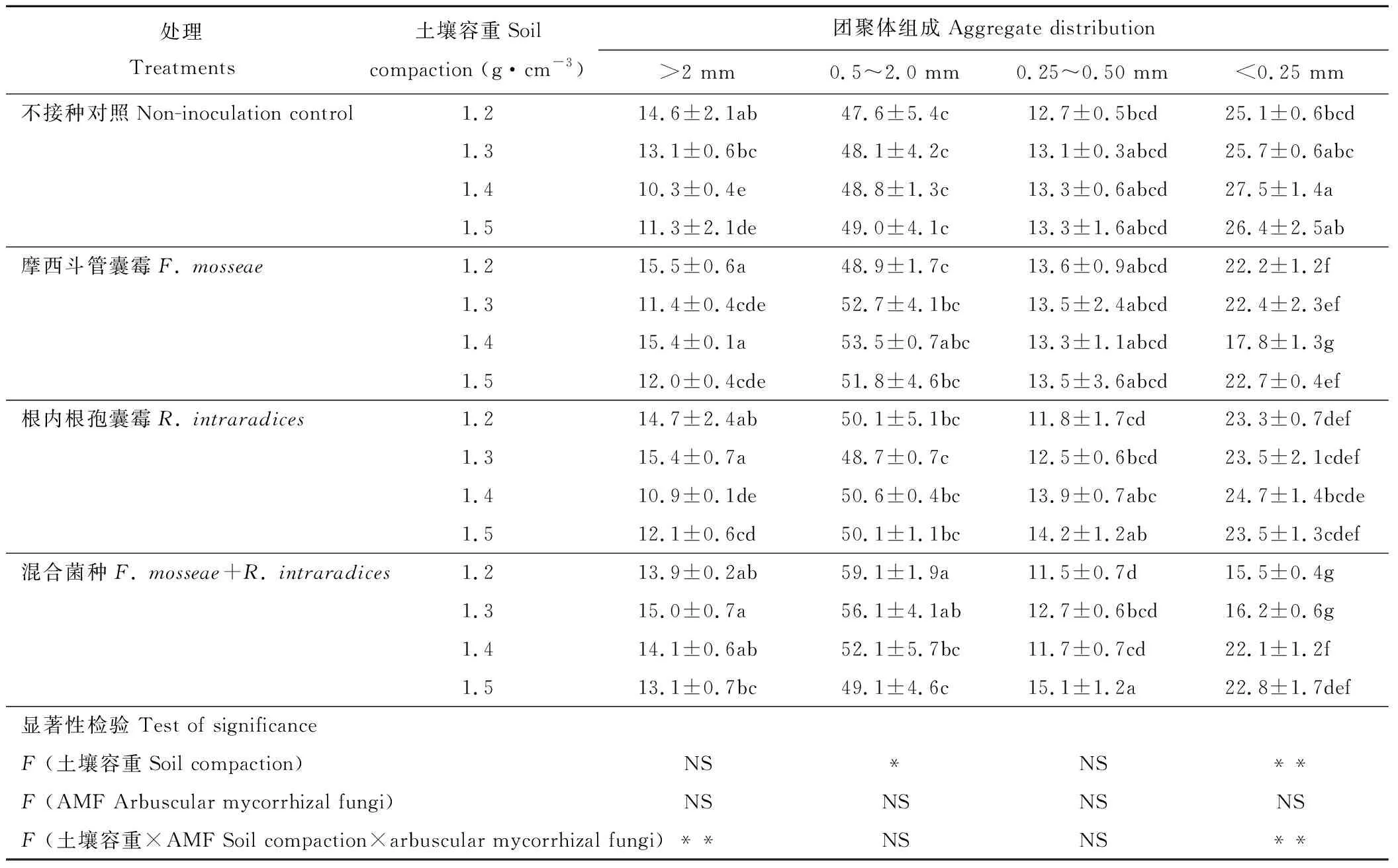
表2 不同土壤容重下AMF和高羊茅对土壤团聚体组成的影响Table 2 Effects of AMF and F. elata on soil aggregate distribution under different soil compaction (%)

表3 不同土壤容重下AMF和高羊茅对微生物群落组成的影响Table 3 Effects of AMF and F. elata on microbe numbers under different soil compaction
2.4 不同土壤容重下AMF和高羊茅对土壤养分含量的影响
同一土壤容重下,不同接种处理对土壤养分的影响不同。全氮含量在土壤容重1.5 g·cm-3下接种F.mosseae处理达到570.6 mg·kg-1,有机质含量在土壤容重1.2 g·cm-3下接种F.mosseae处理达到最大值1.694%。接种AMF显著提高了土壤速效钾及速效磷的含量,且接种效果表现为共同接种F.mosseae+R.intraradices>单一接种F.mosseae>单一接种R.intraradices>对照。1.5 g·cm-3土壤容重下,与对照相比,速效钾含量增加123%,速效磷含量增加176%。土壤容重和AMF两者交互作用对土壤全氮、速效钾、速效磷和有机质含量影响极显著(表4)。

表4 不同土壤容重下AMF和高羊茅对土壤养分含量的影响Table 4 Effects of AMF and F. elata on soil nutrient contents under different soil compaction
2.5 不同土壤容重下AMF和高羊茅对土壤酶活性的影响
土壤压实胁迫下,共同接种F.mosseae+R.intraradices处理的蔗糖酶、脲酶、过氧化氢酶、多酚氧化酶活性显著大于单一接种和对照。与对照相比,1.5 g·cm-3土壤容重下共同接种处理下蔗糖酶活性提高271%,脲酶活性提高249%,过氧化氢酶活性提高98%,多酚氧化酶活性提高268%。方差分析表明,土壤酶活性在接种AMF与不同土壤容重间存在互作效应(表5)。
2.6 不同土壤容重下AMF和高羊茅对土壤中球囊霉素相关土壤蛋白含量的影响
接种AMF可提高土壤中易提取球囊霉素相关土壤蛋白(EE-GRSP)、总球囊霉素相关土壤蛋白(T-GRSP)含量,且共同接种处理的球囊霉素显著高于单一接种。1.5 g·cm-3土壤容重下,与对照相比,共同接种F.mosseae+R.intraradices产生的EE-GRSP含量提高241%;T-GRSP含量提高288%,与对照差异显著(P<0.05)(图1)。

表5 不同土壤容重下AMF和高羊茅对土壤酶活性的影响Table 5 Effects of AMF and F. elata on activities of invertase, urease, catalase and polyphenol oxidase in soil under different soil compaction

图1 不同土壤容重下AMF和高羊茅对土壤中易提取球囊霉素相关土壤蛋白和总球囊霉素相关土壤蛋白含量的影响Fig.1 Effects of AMF and F. elata on soil EE-GRSP content and T-GRSP content under different soil compaction Fm:摩西斗管囊霉F. mosseae;Ri:根内根孢囊霉R. intraradices.不同小写字母表示处理间差异显著(P<0.05)。 Different lowercase letters mean significant difference among treatments (P<0.05).
2.7 各处理AMF侵染与高羊茅生长状况
在同一土壤容重下,共同接种处理的AMF侵染率、菌丝密度以及高羊茅干物质质量最高。共同接种F.mosseae+R.intraradices在土壤容重1.5 g·cm-3下菌根侵染率达到37.1%,菌丝密度为1.81 m·g-1,干重为5.87 g。在土壤容重1.2~1.5 g·cm-3梯度下,随土壤容重的增加,AMF侵染率、菌丝密度和高羊茅干重显著下降。说明土壤容重越大对菌根侵染率和菌丝密度有一定的抑制作用(表6)。
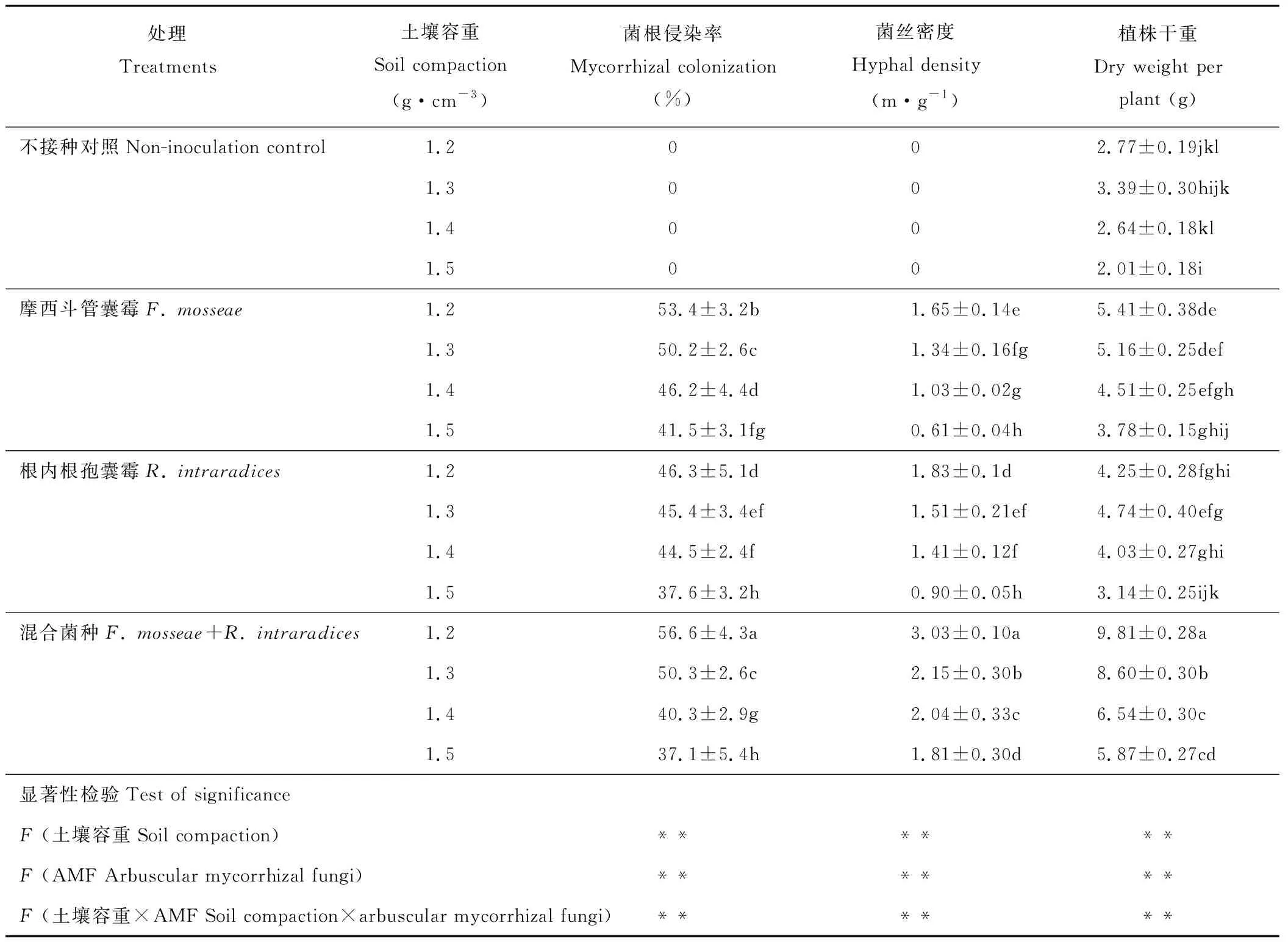
表6 各处理AMF侵染与高羊茅生长状况Table 6 AMF colonization and the growth of F. elata under various treatments
3 讨论
城市土壤体系中广泛分布真菌、细菌和放线菌等微生物,土壤微生物活动会促进植物根系分泌物的增加,而根系分泌物不仅能够改变土壤根区微生物种群组成、数量及其活力,增加土壤微生物碳源利用率,还能促进根围重要土壤活力的增加,改变土壤中物种的丰富度和均一度[23-24]。本试验表明,在不同土壤容重下,接种AMF和高羊茅对提高土壤含水量和孔隙度、土壤酶活性、球囊霉素含量、菌根侵染率、土壤根外菌丝密度等方面具有较好效果,其中最佳处理为F.mosseae+R.intraradices和高羊茅组合。其原因可能是共同接种F.mosseae和R.intraradices,AMF菌丝侵染率最高且菌丝密度大,与高羊茅根系结合后扩大了水分、养分吸收面积,增加了高羊茅的生物量,进而降低土壤容重,缓解压实胁迫。
已有研究表明,接种AMF对于白三叶草(Trifoliumrepens)和紫花苜蓿(Medicagosativa)根围中的细菌、放线菌以及真菌数量都有促进作用。本试验结果表明,随土壤容重增加,土壤真菌、细菌和放线菌数量下降,接种AMF后土壤中微生物数量则显著增加,且放线菌和细菌的数量多于真菌数量。这可能是因为土壤灭菌后一段时间内真菌数量增长较快,进而改变了细菌以及放线菌的数量,这与Oliveria等[25]的研究结果一致;同时高羊茅根系分泌物可能提高了土壤微生物活性,进一步对微生物数量产生促进作用,其具体的促进机制还需进一步试验证实。
AMF可以通过合成1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate synthase,ACC)脱氨酶及球囊霉素相关土壤蛋白(glomalin related soil protein,GRSP)等降低植物对环境胁迫的效应[26]。GRSP是球囊霉属AMF菌丝分泌产生的并可以脱落到土壤中的一种金属离子的糖蛋白[27]。研究表明,GRSP作为一种长期的土壤络合物不仅能够改善土壤的物理性质,修复植物根围生态环境[28],而且还是土壤有机质的主要成分之一,是土壤碳氮的重要来源,可提供15%~20%碳源,自然条件下保持菌丝内营养物质和水分供应,土壤质量变化时产生相应变化[29-30]。同时菌根的发育可以通过增加土壤有机质含量来增加团粒结构、改善土壤组成成分,从而提高土壤通气性、水分渗透能力和保水能力[31]。研究表明,接种摩西斗管囊霉的野樱桃(Prunusdiscadenia)、文冠果(Xanthocerassorbifolium)其土壤碱解氮、GRSP含量显著增加,土壤速效磷、速效钾含量显著降低,显著改善了采煤沉陷区土壤化学和生物学性状[32]。更为重要的是,AMF可以通过分泌一些酸性化合物,直接进行活化土壤养分,提高速效养分含量。本试验表明,1.2~1.5 g·cm-3土壤容重下,随土壤容重的增大土壤全氮含量随之增大。而速效磷、速效钾的含量与土壤容重呈负相关性;土壤中有机质含量呈先增大后减小的趋势。接种AMF增加了土壤全氮、速效钾、速效磷含量,而有机质含量因接种方式和土壤容重的不同呈现出不同的结果,在1.2、1.4、1.5 g·cm-3土壤容重下摩西斗管囊霉接种处理的有机质含量大于其他接种处理。这可能是由于土壤中的微生物矿化土壤中的氮素后极易溶解迁移和挥发,使得土壤中的全氮量下降。大量研究已经证实,接种AMF能有效降低土壤有机质,增加土壤速效磷、速效钾等化学元素[33]。本试验中有机质的含量因接种AMF而减少,可能是AMF促进土壤原有有机质的分解而缺少植物残体的补充,其具体效应机制还需进一步试验证明。
土壤酶是土壤环境中的活性物质,参与各种生物代谢过程。土壤酶可加速土壤微生态环境中的生化反应,提高微生物数量和活性。蔗糖酶、脲酶、过氧化氢酶和多酚氧化酶是土壤中重要的氧化还原酶[21]。过氧化氢酶能够促进过氧化氢的氧化,从而消除过氧化氢对根系正常生化反应的破坏。本研究表明,接种AMF后土壤中真菌、细菌和放线菌数量增加,真菌对根系的侵染会影响寄主植物生长,促使AMF分泌土壤酶,或通过根外菌丝分泌土壤酶,这些均与前人研究结果一致[34]。
AMF侵染植物根系并与其形成菌根共生体,菌根侵染率是反映菌根真菌侵染寄主植物根系程度的指标,菌根侵染率的高低与其促进植物生长等功能具有直接关系[35],并受到多种因素的综合影响,包括AMF菌种类型、植物类型、土壤环境以及人类活动等[36-37]。本试验中,接种AMF提高了高羊茅根系侵染率和菌丝密度,且高羊茅干重增加。这可能是因为菌根形成过程中根系分生组织活性变强,高羊茅不定根和侧根数量增多,根毛运输养分、水分能力增强,从而提高了接种处理的高羊茅生物量[38]。
4 结论
综合分析,土壤容重1.5 g·cm-3条件下,共同接种F.mosseae+R.intraradices和高羊茅组合可改善土壤理化性质,增加土壤孔隙度和含水量,提高根围土壤中细菌、真菌和放线菌数量;同时接种AMF可提高土壤中脲酶、蔗糖酶、多酚氧化酶和过氧化氢酶活性,降低土壤容重,缓解土壤压实情况,对城市土壤肥力潜力具有实践意义。对于AMF+高羊茅改良压实土壤的机制、高羊茅根系分泌物成分、调控高羊茅在压实胁迫下的基因表达以及AMF类型与高羊茅对压实土壤的遗传适应机制等有待进一步深入研究。
