KF-KBF4熔盐结构的Raman光谱表征
2018-11-17胡宪伟
胡宪伟,李 博,张 璇,万 涛
KF-KBF4熔盐结构的Raman光谱表征
胡宪伟,李 博,张 璇,万 涛
(东北大学 冶金学院,沈阳 110819)
利用Raman光谱法研究不同温度下的KF-KBF4熔盐的离子结构。结果表明:KF摩尔分数为0.1~0.7的熔盐体系中,存在BF63−和BF4−两种络合离子团,其中BF63−的1振动峰的Raman位移在710 cm−1附近。随着温度的增加,各振动基团结构松散,原子间的作用力变弱,振动无序性增加。随着混合物中KF含量的增加,由于K+对络合离子团中F−的吸引力和B3+的排斥力的增加,络合离子团的结构更加松散,同时BF63−的相对含量增加。获得了BF63−和BF4−的1振动对应的特征峰的强度比与温度的定量关系,可以以此为依据进行熔盐体系中络合离子团浓度的计算。
Raman光谱学;BF63−;KF-KBF4熔盐;离子结构;络合离子团
在现代预焙槽电解铝工艺中,以炭质材料做阴极,这会造成两方面的不利影响,首先,阴极易受钠、电解质和铝液的侵蚀,造成其破损,影响电解槽寿命;其次,阴极炭块与电解质间的铝液层易受到电磁场的扰动,这使得电解铝生产不稳定[1−2]。为了取代碳阴极,人们不断努力寻找新型材料[3],TiB2是目前被认为制备铝电解可湿润性阴极的首选材料[4]。熔盐电化学沉积法是制备TiB2镀层的重要方法,在该方法中,常用以KF-K2TiF6-KBF4为基的电解质体系[5−11]。
另外,在SHI等[12]进行的采用熔盐电解法制备MgB2镀层的研究中,使用了KF-KBF4-MgF2熔盐体系。
综上所述,KF-KBF4熔盐是十分重要的基础熔盐;而熔盐结构的研究具有重要的意义。首先,电解质的物理化学性质是其离子结构的外在表征;其次,电极过程机理的研究与熔盐结构的研究密不可分;再次,熔盐与材料的作用机理研究也是以熔盐结构的研究为基础的。
20世纪70年代初期,就有研究者进行了碱金属氟硼酸盐的晶体和水溶液的结构研究[13−16],在他们的研究中,使用的为Raman光谱法和红外光谱法。QUIST等[17]研究了熔融NaBF4和8%NaF-92%NaBF4(摩尔分数)的结构,开创了熔融氟硼酸盐结构研究的新局面。BATE等[14]进行了碱金属氟硼酸盐系列熔盐的Raman光谱测定,进一步确定了熔融氟硼酸盐的结构。PERELYGIN等[18]采用量子化学计算的方法,研究了Li+、Na+等碱金属阳离子与BF4−之间的作用规律及对其振动光谱的影响。LUTZ等[19]采用Raman光谱法和红外光谱法研究了TlBF4和NH4BF4等的晶体结构特征。陈功[20]研究了KF-KBF4体系在室温和480 ℃熔融状态下的Raman光谱,探讨了晶体和熔融结构的区别。
然而,上述研究中,极少涉及到KF-KBF4混合熔盐体系的结构研究。另外,近年来,Raman光谱在研究液体络合结构方面的理论与技术日益成熟,特别是随着高温Raman光谱测试分析技术的进步[21−22],Raman光谱法在氟化物熔盐结构的研究中发挥了越来越重要的作用[23−24]。基于上述分析,本文作者将采用Raman光谱法对KF-KBF4熔盐的离子结构及其变化规律进行系统的研究。
1 实验
实验用所有药品为分析纯,在423 K下干燥以去除附着水,为了精确获得所需要的试样组成,在Mbraun MB200B手套箱中称取15 g混合样品于玛瑙研钵中充分混合后,置于石墨坩埚中进行预熔化。取0.1 g样品进行Raman光谱测定。
使用Spectra-Physics公司的177−G1205型氩离子激光器产生波长为488.97 nm的激发光,入射到样品上的功率约为5 mW;通过Olympus公司50×0.50显微镜头观测试样;使用Horiba Jobin Yvon 公司LabRAM HR800 Raman光谱仪进行Raman光谱测定,积分时间30 s,积分次数两次,狭缝宽度300 μm,扫描波数范围:200~1000 cm−1。
实验所用显微热台和样品池如图1所示。整个显微热台分为4部分,其中紫铜热台盖与主体间用螺纹连接,中间以透光性能良好的石英片以及密封圈密封;热台主体分为两部分,以螺纹连接,以方便炉膛的安装;带有伸腿的刚玉炉膛由垫片固定在热台内部,炉膛外部有螺纹,用于缠绕加热铂丝,炉膛内部下方的内径较小,用于放置盛样坩埚;底座材质为铝,其与热台主体间以紫铜支柱连接。
考虑到热台炉膛内的温度梯度,事先测定炉膛内温度与输入功率之间的关系,并通过测量NaNO3和NaCl的熔化温度来对该关系进行校正,最后通过记录输入功率来进行温度的测定。LACASSAGNE等[25]进行NMR测定的加热池,也使用了类似的温度测量方法。热台的测温精度为±5 ℃。

图1 Raman光谱测量用显微热台和样品池图示
2 结果与讨论
2.1 Raman光谱测定结果及特征峰的归属
不同组成的KF-KBF4混合物在不同温度下的Raman光谱如图2所示,对光谱进行了去基线和归一化处理。
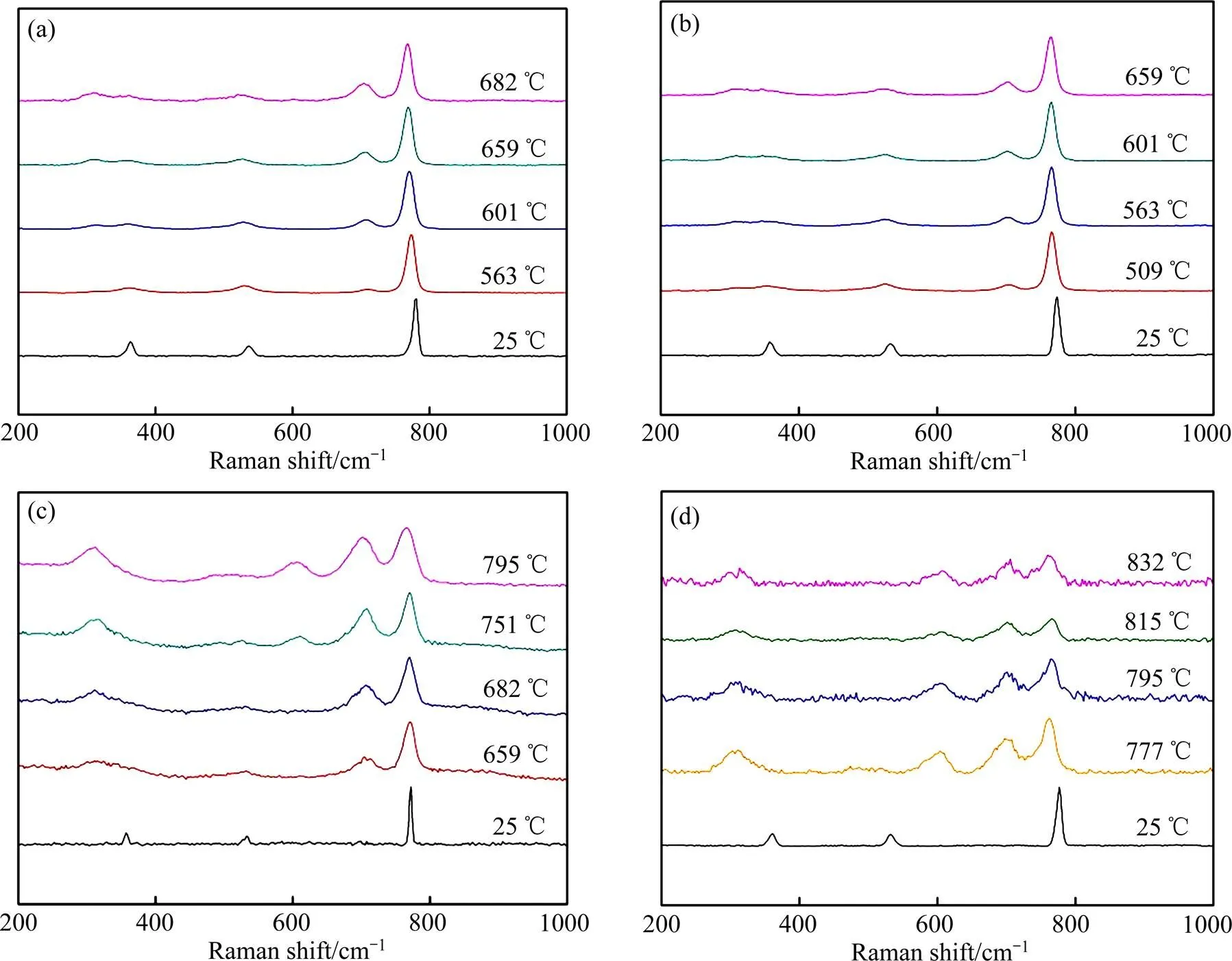
图2 不同KF含量的KF-KBF4在不同温度下的Raman光谱
观察图2所示的各Raman光谱图,发现不同组成的KF-KBF4在常温下有3个Raman特征峰,分别在360、533和775 cm−1附近,它们都是KBF4的特征Raman峰,分别对应于BF4−的2、4和1特征峰[13]。当混合物熔化后,3个特征峰的Raman位移明显降低,且随着温度的升高进一步红移,这是因为随着温度的升高,原子的热运动加强,原子间的作用力变弱的缘故;另外,当混合物熔化后,上述3个特征峰的半高宽都增加,这是结构体振动无序性增加的结果。
同时,观察图2所示的各Raman光谱图,发现当试样熔化后,位于360 cm−1处的BF4−的2振动峰发生谱峰分裂,即在约为313 cm−1处,存在一个新的峰,且其强度随着试样初始组成中KF含量的增加而增大。QUIST等[17]在研究熔融NaBF4和8%NaF-92%NaBF4(摩尔分数)体系时,也观察到了类似的谱峰分裂现象,并将其归因于BF4−所处的各项异性环境和/或熔盐中2振动与自由或受阻转动的相互作用,这又受阴阳离子相互作用的影响。
此外,观察图2所示的各Raman光谱图,还发现当混合物熔化后,在710 cm−1附近出现了一个新的特征峰;并且,对于含有高KF含量(摩尔分数0.5、0.7)的混合物,在高温区Raman光谱中,在605 cm−1附近也出现了一个新的特征峰,这两个特征峰的相对强度随温度的升高而增加,随混合物初始组成中KF含量的增加而增加。QUIST等[17]测定的NaBF4和8%NaF-92%NaBF4(摩尔分数)熔盐体系的Raman光谱中,在710~720 cm−1处也存在一个峰,他认为,该峰是由氟化物熔盐试样与石英管反应生成的SiF4溶解于熔盐生成的SiF5−产生的,由于在本文的样品池设计中,并没有石英与熔盐发生实际接触,因此这种可能性不予考虑。另外,这两个峰与BARNER等[26]研究所得的B2OF62−结构中BF3结构单元的对称伸缩振动引起的Raman特征峰,以及B3O3F63−中B3O3环的呼吸振动特征峰的Raman位移相接近,然而,在本文的研究中,所用的原料并不含有O元素,而且在我们所进行的常温样品的Raman光谱测量中,也并没有观察到其他的、可能与含O物质相对应的Raman特征峰,而在高温熔盐中,并不能溶解如此之多的O元素以形成前述的B-O-F络合离子团。通过以上分析,认为光谱中处于710 cm−1和605 cm−1附近的Raman特征峰并非由B—O—F络合离子团振动产生。
如前所述,在文献[26]中,处于710 cm−1附近的特征峰是由B2OF62−结构中BF3结构单元的振动所引起的,于是另一种可能的假设是熔盐中存在着类似结构的B—F络合离子团,其也包含BF3结构单元,那么按照B2OF62−的结构形式,这种可能的络合离子团应为两个BF3通过一个F−桥连,其化学式为B2F7−,于是熔盐中存在如式(1)所示的平衡,
2BF4−=B2F7−+F−(1)
然而,如前所述,处于710 cm−1附近的特征峰的相对强度随着混合物中KF含量的增加而增大,而Raman特征峰的相对强度与其相对含量相关,如果该特征峰对应的为B2F7−的振动,当混合物中KF含量增加,意味着引入熔盐中F−的量增加,式(1)所示平衡左移,B2F7−的相对含量应该降低,这显然与实际不符。
经过前述分析,处于710 cm−1和605 cm−1附近的两个特征峰对应的振动基团的相对含量是随混合物初始组成中KF含量的增加而增加的,因此认为,这两个特征峰是由B3+与相对于BF4−更多的F−离子配位形成的结构体振动所引起的。以前的研究者[27−33]发现,与B处于同一主族的Al、Ga、In等元素,都有六配位和/或五配位的络合氟化物离子团,其1振动峰如表1所示。
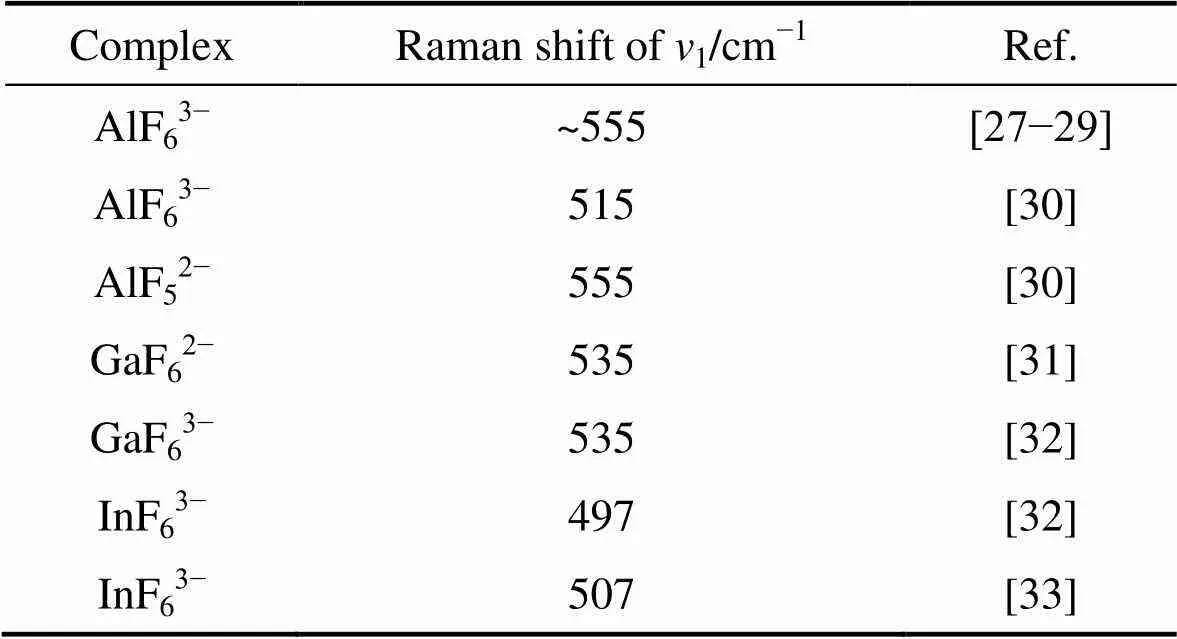
表1 五、六配位的第三主族金属氟化物络合离子团的v1特征峰的Raman位移
由表1可以发现,诸多文献都报道了第三主族金属的六氟络合离子团,而且,尽管关于AlF63−的1特征峰的Raman位移存在一些分歧,但是整体上来看,第三主族金属原子六氟络合离子团的1特征峰的Raman位移随着金属元素原子序数的增加呈现减小的趋势,这种现象被称为“阳离子效应”[30];只有GIBLERT等[30]指认了五氟络合离子团的Raman特征峰。观察图2所示的Raman光谱,并考虑到处于710 cm−1和605 cm−1附近的特征峰的相对强度随混合物中KF含量的增加而增加这一规律,认为两个特征峰有以下两种可能的归属:1) 处于710 cm−1的特征峰是由BF52−振动引起的,而处于605 cm−1的特征峰则对应于BF63−的振动;2) 两个特征峰都是由BF63−的振动所引起的,但是对应于不同的振动模式,从特征峰的强度来看,处于710 cm−1的特征峰是该振动基团的主振动峰。振动基团的其他振动模式太弱或者被Raman光谱中其他峰所掩盖。
观察表1所示的各振动基团的1特征峰数据,只有Al的五氟配位的文献报道,在该文献中,关于六氟铝离子团的特征峰峰位,与其他文献报道的同族金属的六氟离子团的对应特征峰的Raman位移并没有体现出“阳离子效应”。因此,本文作者认可上述分析的第二种可能性。
2.2 Raman特征峰参数拟合
按照文献[30]的方法,使用Gaussian方程和Lorentzian方程加权和的方法,对图2所示的各光谱进行拟合,可以得到相应的特征峰参数。
在图2所示的Raman光谱中,由于每种组成熔盐的初晶温度不同,因此选取了不同温度测试区间,但是图中同样有相同的测试温度,因此可以考察温度对特征峰参数的影响。拟合得到的图2中,BF63−和BF4−的1特征峰Raman位移与混合物组成的关系分别如图3(a)和(b)所示。
由图3可以看出,除个别组成(KF摩尔分数为0.5)外,从整体上来说,两种离子团的1特征峰的Raman位移随混合物组成中KF含量的增加而降低。这是由于熔盐中存在着十分活泼的K+,它不会与阴离子形成络合离子团,但是,会对形成络合离子团的离子产生作用力,随着混合物组成中KF含量的增加,由于K+含量的增加,其对络合离子团中F−的吸引力和B3+的排斥力会增加,使得络合离子团的结构更加松散,其对应的特征峰Raman位移降低。
将拟合得到的图2中,处于710 cm−1附近与775 cm−1附近特征峰的强度比与温度的关系做图,如图4所示。
由图4可见,对于任何一种组成的KF-KBF4熔盐体系,其Raman光谱中与BF63−和BF4−的1振动对应的特征峰的强度比随温度的增加而增加。随着混合物组成中KF含量的增加,强度比随温度的增加率也基本呈增加的趋势。
如前所述,Raman光谱的特征峰强度是与其对应的振动基团的含量相关的,以两种振动基团的Raman特征峰强度比为基础,在明晰两种振动基团散射系数比的前提下,通过熔盐体系中的物质平衡,可以计算两基团的浓度[34]。然而,振动基团散射系数比需要通过测定已知浓度的熔盐Raman光谱进行标定[35],但是目前还没有关于BF63−的文章报道,因此还不能获得待测熔盐中BF63−和BF4−的浓度,但是本文所获得的关于两种振动基团Raman特征峰的强度比数据,可以为计算二者的浓度奠定基础。

图3 KF-KBF4熔盐中络合离子团的Raman特征峰的Raman位移与混合物中KF摩尔分数的关系
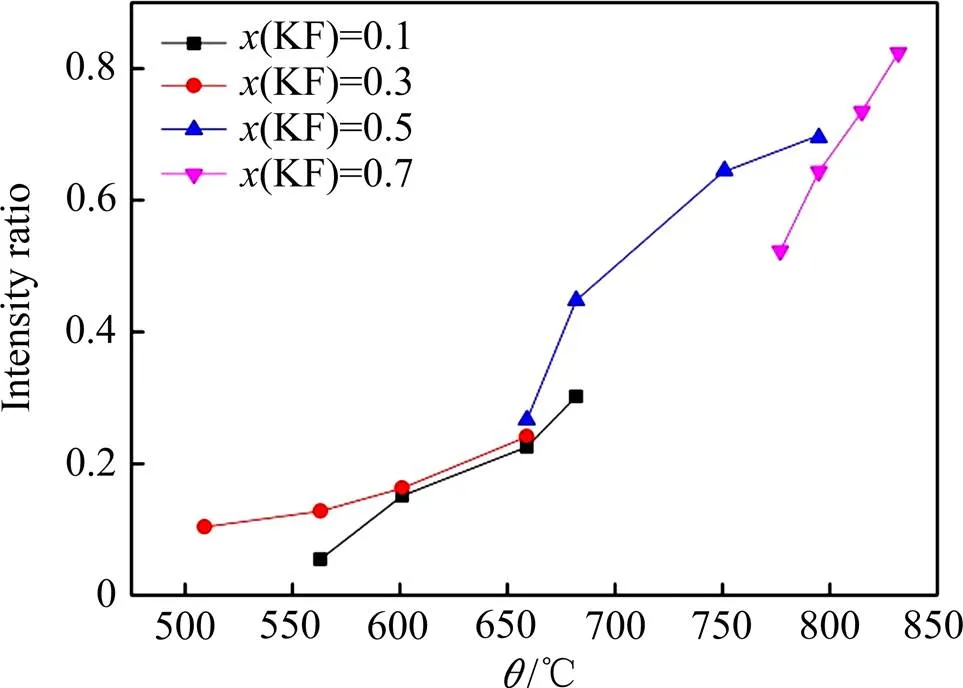
图4 Raman光谱中710 cm−1附近与775 cm−1附近峰的强度比
3 结论
1) 在KF摩尔分数为0.1~0.7的熔盐体系中,存在BF63−和BF4−两种络合离子团;其中BF63−的1振动峰的Raman位移在710 cm−1附近;在605 cm−1附近,存在BF63−的另一个Raman特征峰。
2) 随着温度的增加,各振动基团结构松散,原子间的作用力变弱,振动无序性增加;随着混合物中KF含量的增加,由于K+对络合离子团中F−的吸引力和B3+的排斥力的增加,导致各络合离子团的结构更加松散。
3) 随着混合物中KF含量的增加,BF63−的相对含量增加。获得了BF63−和BF4−的振动对应的特征峰的强度比与温度的定量关系,可以以此为依据进行熔盐体系中络合离子团浓度的计算。
[1] 徐君莉, 石忠宁, 邱竹贤. 熔盐电镀制取铝电解用TiB2惰性阴极[J]. 东北大学学报(自然科学版), 2004, 25(9): 873−875. XU Jun-li, SHI Zhong-ning, QIU Zhu-xian. Preparation of TiB2inert cathode by electrodeposition process for aluminum electrolysis[J]. Journal of Northeastern University (Natural Science), 2004, 25(9): 873−875.
[2] 唐慧鑫, 俞小花, 谢 刚. 铝电解槽阴极TiB2涂层的研究进展[J]. 材料导报, 2011, 25(S18): 203−205. TANG Hui-xin, YU Xiao-hua, XIE Gang. Research progress of TiB2cathode coating in aluminium electrobath[J]. Materials Review, 2011, 25(S18): 203−205.
[3] BILLEHAUG K, ØYE H A. Inert cathodes for aluminum electrolysis in Hall-Heroult cells-Ⅰ[J]. Aluminum, 1980, 56(10): 642−648.
[4] 李 冰, 邱竹贤, 李 军, 叶以富, 赵祖欣. 在石墨基体上电沉积TiB2镀层的研究[J]. 稀有金属材料与工程, 2004, 33(7): 764−767. LI Bing, QIU Zhu-xian, LI Jun, YE Yi-fu, ZHAO Zu-xin. Study on electrodeposition of TiB2coating on graphite substrate[J]. Rare Metal Materials and Engineering, 2004, 33(7): 764−767.
[5] BROOKES H C, GIBSON P S, HILLS G J, NARAYAN N, WIGLEY D A. The electrochemistry of the boriding of ferrous metal surfaces[J]. The International Journal of Surface Engineering and Coatings, 1976, 54(1): 191−195.
[6] MAKYTA M, MATIASOVSKY K, FELLNER P. Mechanism of the cathode process in the electrolytic boriding in molten salts[J]. Electrochimica Acta, 1984, 29(12): 1653−1657.
[7] MAKYTA M,MATIAŠOVSKÝ K, TARANENKO V I. Mechanism of the cathode process in the electrochemical synthesis of TiB2in molten salts — I. The synthesis in an all-fluoride electrolyte[J]Electrochimica Acta, 1989, 34(6): 861-866.
[8] TARANENKO V I, ZARUTSKII I V, SHAPOVAL V I, MAKYTA M, MATIAŠOVSKÝ K. Mechanism of the cathode process in the electrochemical synthesis of TiB2in molten salts —Ⅱ. Chloride-Fluoride electrolytes[J]. Electrochimica Acta, 1992, 37(2): 263−268.
[9] 石青荣, 段淑贞, 武世民. 氟化物熔盐中B(Ⅲ)的电化学还原[J]. 北京科技大学学报. 1994, 16(6): 599−603. SHI Qing-rong, DUAN Shu-zhen, WU Shi-min. Electrochemical reduction of B(Ⅲ) in molten fluorides[J]. Journal of University of Science and Technology Beijing, 1994, 16(6): 599−603.
[10] 班允刚, 杨少华, 阚洪敏, 王兆文. TiB2镀层制备及其耐腐蚀性能研究[J]. 东北大学学报(自然科学版), 2007, 28(12): 1729−1732. BAN Yun-gang, YANG Shao-hong, KAN Hong-min, WANG Zhao-wen. Preparation of TiB2coating and its corrosion resistance to electrolyte[J]. Journal of Northeastern University (Natural Science), 2007, 28(12): 1729−1732.
[11] 李 军, 李 冰. 高择优取向TiB2电沉积层的制备及其表征[J].稀有金属材料与工程, 2006, 35(5): 832−835. LI Jun, LI Bing. Preparation and characterization of highly preferred orientation TiB2coatings[J]. Rare Metal Materials and Engineering, 2006, 35(5): 832−835.
[12] SHI Zhang-ning, LI Min, LI Lan-lan, GAO Bing-liang, HU Xian-wei, WANG Zhao-wen. Electrochemical behaviors of Mg2+and B3+deposition in fluoride molten salts[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(7): 1655−1659.
[13] BATES J B, QUIST A S, BOYD G E. Infrared and Raman spectra of polycrystalline NaBF4[J]. The Journal of Chemical Physics, 1971, 54(1): 124−126.
[14] BATES J B, QUIST A S. Vibrational spectra of solid and molten phases of the alkali metal tetrafluoroborates[J]. Spectrochimica Acta, 1975, 31(9): 1317−1327.
[15] BONADEO H A, SILBERMAN E. The vibrational spectra of sodium, potassium and ammonium tetrafluoroborates[J]. Spectrochimica Acta, 1970, 26(12): 2337−2343.
[16] QUIST A S, BATES J B, BOYD G E. Raman spectra of the high-temperature phase of polycrystalline NaBF4[J]. The Journal of Chemical Physics, 1971, 55(6): 2836−2838.
[17] QUIST A S, BATES J B, BOYD G E. Raman spectra of molten NaBF4to 606℃ and 8% NaF-92% NaBF4to 503℃[J]. The Journal of Chemical Physics, 1971, 54(11): 4896−4901.
[18] PERELYGIN I S, SHATOKIN S A, KARIMOVA N G. Regularities in vibrational spectra of the coordinated tetrafluoroborate ion[J]. Journal of Applied Spectroscopy, 1991, 55(6): 1220−1223.
[19] LUTZ H D, HIMMRICH J, SCHMIDT M. Lattice vibration spectra. Part LXXXVI. Infrared and Raman spectra of baryte-type TlClO4, TlBF4, and NH4BF4single crystals and of11B-enriched NH4BF4[J]. Journal of Alloys and Compounds, 1996, 241(1): 1−9.
[20] 陈 功. 氟化物熔盐体系石墨阳极的电化学氟化与钝化机理[D]. 沈阳: 东北大学冶金学院, 2015: 62−63. CHEN Gong. Electrochemical fluorination and passivation mechanism of graphite anode in fluoride molten salts system[D]. Shenyang: School of Metallurgy, Northeastern University, 2015: 62−63.
[21] 蒋国昌, 尤静林, 余丙鲲, 黄世萍. 高温Raman光谱测试技术进展[J]. 光谱学与光谱分析, 2000, 20(2): 206−209. JIANG Guo-chang, YOU Jing-lin, YU Bing-kun, HUANG Shi-ping. Developments of high temperature Raman spectroscopic techniques[J]. Spectroscopy and Spectral Analysis, 2000, 20(2): 206−209.
[22] 陈 辉, 蒋国昌, 尤静林, 吴永全. 高温拉曼光谱技术的实现及应用[J]. 光谱学与光谱分析, 2007, 27(12): 2464−2467. CHEN Hui, JIANG Guo-chang, YOU Jing-lin, WU Yong-quan. High temperature Raman spectroscopy techniques and its applications[J]. Spectroscopy and Spectral Analysis, 2007, 27(12): 2464−2467.
[23] MALHERBE C, GILBERT B. Direct determination of the NaF/AlF3Molar ratio by Raman spectroscopy in NaF-AlF3-CaF2melts at 1000 ℃[J]. Analytical Chemistry, 2013, 85(18): 8669−8675.
[24] VILLA-ALEMAN E, WELLONS M S. Characterization of uranium tetrafluoride (UF4) with Raman spectroscopy[J].Journal of Raman Spectroscopy, 2016, 47(7): 865−870.
[25] LACASSAGNE V, BESSADA C, FLORIAN P, BOUVET S, OLLIVIER B, COUTURES J, MASSIOT D. Structure of high-temperature NaF-AlF3-Al2O3melts: A multinuclear NMR study[J]. The Journal of Physical Chemistry B, 2002, 106(8): 1862−1868.
[26] VON BARNER J H, ANDERSEN K B, BERG R W. Vibrational spectroscopic study on fluorooxoborate formation in fluoride melts: Indications of B2OF62−and B3O3F2−[J]. Journal of Molecular Liquids, 1999, 83(1/3): 141−151.
[27] SOLOMONS C, CLARKE J H R, BOCKRIS J O M. Identification of the complex ions in liquid cryolite[J]. The Journal of Chemical Physics, 1968, 49(1): 445−449.
[28] RATKJE S K, RYTTER E. Raman spectra of molten mixtures containing aluminum fluoride. Ⅰ. The LiF-Li3AlF6eutectic mixture[J]. The Journal of Physical Chemistry, 1974, 78(15): 1499−1502.
[29] BROOKER M H. Raman study of the hexafluoroaluminate ion in solid and molten FLINAK[J]. Inorganic Chemistry, 2000, 39(16): 3682−3689.
[30] GILBERT B, MATERNE T. Reinvestigation of molten fluoroaluminate Raman spectra: The question of the existence of AIF52−ions[J]. Applied Spectroscopy, 1990, 44(2): 299−305.
[31] IGNATEVA L N, SUROVTSEV N V, MERKULOV E B, BUZNIK V M. Structural features of glasses in the GaF3-SnF2system[J]. Russian Journal of Inorganic Chemistry, 2006, 51(6): 1039−1043.
[32] IGNATIEVA L N, POLISHCHUK S A, BOUZNIK V M. Quantum chemical and spectroscopic study of fluoride glasses[J]. Reviews in Inorganic Chemistry, 1999, 19(1/2): 31−44.
[33] ALMEIDA R M, PEREIRA J C, MESSADDEQ Y, AEGERTER M A. Vibrational spectra and structure of fluoroindate glasses[J]. Journal of Non-Crystalline Solids, 1993, 161(2): 105−108.
[34] 胡宪伟, 王兆文, 陈广华, 路贵民, 崔建忠, 曹晓舟. 酸性NaF-AlF3熔盐离子结构的Raman光谱[J]. 中国有色金属学报, 2008, 18(10): 1914−1919. HU Xian-wei, WANG Zhao-wen, CHEN Guang-hua, LU Gui-min, CUI Jian-zhong, CAO Xiao-zhou. Raman spectra of ionic structure for acidic NaF-AlF3melts[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(10): 1914−1919.
[35] HU X W, QU J Y, GAO B L, SHI Z N, LIU F G, WANG Z W. Raman spectroscopy and ionic structure of Na3AlF6-Al2O3melts[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(2): 402−406.
Structure of molten KF-KBF4: Raman spectra characterization
HU Xian-wei, LI Bo, ZHANG Xuan, WAN Tao
(School of Metallurgy, Northeastern University, Shenyang 110819, China)
The ionic structure of molten KF-KBF4at different temperatures was studied by Raman spectroscopy. The results show that two kinds of complex, BF63−and BF4−, are co-existed in the melts in which the molar fraction of KF is from 0.1 to 0.7, and1characteristic peak of BF63−is located at about 710 cm−1. Higher temperature leads to looser structure of the complexes, weaker interatomic force and more disorder vibration. With the increase of the molar fraction of KF in the mixture, the complexes become looser due to the increase of attraction force between K+and F−and repulsion force between K+and B3+in the complexes. Meanwhile, the relative content of BF63−increases. The intensity ratio of1characteristic peak corresponding to BF63−to BF4−is obtained, which lays a foundation for calculation of concentration of the complex in the melts.
Raman spectroscopy; BF63−; KF-KBF4molten salts; ionic structure; complex
Project(51474060) supported by the National Natural Science Foundation of China; Projects (N150204010, N162502002) supported by the Fundamental Research Funds for the Central Universities of China; Project(2017 YFC0805100) supported by the National Key R & D Program of China
2018-03-01;
2018-07-22
HU Xian-wei; Tel: +86-24-83682831; E-mail: huxw@smm.neu.edu.cn
国家自然科学基金资助项目(51474060);中央高校基本科研业务费资助项目(N150204010,N162502002);国家重点研发计划资助项目(2017 YFC0805100)
2018-03-01;
2018-07-22
胡宪伟,副教授,博士;电话:024-83682831;E-mail: huxw@smm.neu.edu.cn
10.19476/j.ysxb.1004.0609.2018.10.20
1004-0609(2018)-10-2120-07
O645.4
A
(编辑 李艳红)
