高糖环境下不同浓度硫氢化钠对人肾小管上皮氧化应激的影响
2018-11-15刘爱东刘晓红曾俊伟
刘爱东,王 箐 ,田 琳,刘晓红,曾俊伟
(1.遵义医学院 生理学教研室,贵州 遵义 563099;2.遵义医学院 机能学实验室,贵州 遵义 563099)
有研究表明,高糖环境下肾脏细胞产生的氧化应激(Oxidative stress,OS)损伤可能是糖尿病肾病(Diabetic nephropathy,DN)发病的重要机制之一[1-2],高糖诱导的线粒体呼吸链产生过量的活性氧自由基(Reactive oxygen radicals,ROS)是糖尿病并发症的始动环节[3-4]。硫化氢(Hydrogen sulfide,H2S)具有较强的抗炎症、抗氧化应激和抗细胞凋亡等功能[5]。硫氢化钠(Sodium hydrosulfide,NaHS)是外源性H2S供体硫化盐的一种,在溶液中可分离出Na+和HS-,随后HS-和H+生成H2S。NaHS作为H2S供体已经广泛应用于H2S的研究当中。本研究的目的在于通过培养人肾小管上皮细胞HK-2,观察NaHS在低糖条件和高糖诱导下对肾小管上皮细胞氧化应激的影响。
1 材料与方法
1.1 材料与仪器 人肾小管上皮细胞株HK-2购于上海生命科学院;NaHS(纯度72%)购于Sigma公司;DMEM(Dulbecco's modified eagle medium)细胞培养基和胎牛血清(Fetal bovine serum,FBS)购于Hyclone公司;青链双抗购于上海生工生物工程有限公司;D-葡萄糖(纯度≥99.5%)购于阿拉丁试剂公司,二甲基亚砜(Dimethyl sulfoxide,DMSO)购于Sigma公司;超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Malondialdehyde;Malonic dialdehyde,MDA)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-px)、过氧化氢(Hydrogen peroxide,H2O2)试剂盒购自南京建成生物工程研究所;超氧化物阴离子荧光探针(Dihydroethidium,DHE荧光探针)购于上海碧云天生物技术有限公司。
细胞培养箱 (美国Thermo,型号:Labserv CO-150);超净工作台(苏州安泰科技有限公司);离心机(德国Eppendorf公司,型号:5418);分光光度计(BIO-RAD公司);恒温水浴(Leica公司,型号:HI1210);激光共聚焦显微镜(Leica公司) 。
1.2 方法
1.2.1 细胞培养 取冻存的HK-2细胞,37 ℃快速解冻后,1 200 rpm离心5 min,用DMEM培养基清洗2次后用DMEM基础培养基重悬再离心;加入完全培养基进行培养,每天换一次培养基;待细胞达70%~80%汇合后接种于6孔培养板,每孔1 mL,37 ℃,5% CO2培养箱内培养24 h。
1.2.2 实验分组与处理 待同步化培养24 h后,将细胞分为8 组:①低糖对照组(5.5 mmol/L D-葡萄糖);②低糖+NaHS低剂量组(5.5 mmol/L D-葡萄糖+NaHS 50 μmol/L);③低糖+NaHS中剂量组(5.5 mmol/L D-葡萄糖+NaHS 100 μmol/L);④低糖+NaHS高剂量组(5.5 mmol/L D-葡萄糖+NaHS 200 μmol/L);⑤高糖组(40 mmol/L D-葡萄糖);⑥高糖+NaHS低剂量组(40 mmol/L D-葡萄糖+NaHS 50 μmol/L);⑦高糖+NaHS中剂量组(40 mmol/L D-葡萄糖+NaHS 100 μmol/L);⑧高糖+NaHS高剂量组(40 mmol/L D-葡萄糖+NaHS 200 μmol/L);每组设3个复孔。于37 ℃培养箱中培养处理24、48 h后,分别收集各组细胞和培养液用于后续实验。
1.2.3 SOD活性、MDA含量、GSH-px活力的测定 取各组于24、48 h收集的上清液,用比色法测各组培养液中的SOD活性、MDA含量和GSH-px活力。
1.2.3.1 检测SOD活性 按照说明书的具体步骤加样混匀,室温放置10 min,于波长550 nm处,1 cm光径比色皿,蒸馏水调零,比色。代入计算公式测得细胞培养液中SOD活性(U/mL)。
1.2.3.2 检测MDA含量 按照说明书的具体操作步骤加样后漩涡混匀器混匀,试管口用保鲜膜扎紧,用针头刺一小孔,95 ℃水浴40 min,取出后流水冷却,532 nm处,1 cm光径,双蒸水调零,测各管吸光值。依照计算公式测得细胞培养液中MDA(nmol/mL)。
1.2.3.3 检测GSH-px活力 第一步进行酶促反应,按照说明书的具体操作步骤加样后混匀,3 500 rpm离心10 min,取上清1 mL作显色反应。第二步显色反应,按照说明书的具体操作步骤加样后混匀,室温静置15 min后,波长412 nm,1 cm光径,双蒸水调零,测定各管吸光值。代入公式计算GSH-px活力(nmol/mL)。
1.2.4 比色法测各组培养液中的H2O2水平 取各组于 24、48 h收集的上清液,按照说明书的具体操作步骤加样混匀,于405 nm处,1 cm光径,蒸馏水调零,测各管吸光值。带入计算公式得出培养液中的各组培养液中H2O2水平(mmol/mL)。
1.2.5 激光共聚焦观察各组ROS水平 待细胞长满后接种于96孔培养板,每孔100 μL,37 ℃,5%CO2培养箱内培养24 h,观察细胞密度达80%。在各组加药24、48 h后吸弃培养液,加入浓度为10 μmol/L的DHE荧光探针溶液,在37 ℃细胞培养箱内孵育20 min后,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DHE。用激光共聚焦显微观察细胞荧光强度并拍照。

2 结果
2.1 测定细胞培养液SOD活性、MDA含量以及GSH-px活力结果 高糖组24、48 h的SOD活性和GSH-px活力较低糖对照组下降(P<0.01,P<0.05),而MDA含量增高(P<0.05)。细胞培养24、48 h,低糖+NaHS低、中、高剂量组SOD活性和GSH-px活力较低糖对照组增高(P<0.05),MDA含量降低(P<0.05);高糖+NaHS低、中、高剂量组SOD活性和GSH-px活力较高糖组增高(P<0.01,P<0.05),MDA含量降低(P<0.05,见表1)。
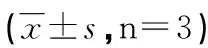
组别SOD活性(U/mL) 24 h 48 hMDA含量(nmol/mL)24 h 48 hGSH-px活力(nmol/mL)24 h 48 h 低糖对照13.555±0.47113.762±0.7888.215±0.06110.326±0.16025.550±0.70328.038±0.760低糖+NaHS低剂量14.560±0.144*14.771±0.3908.509±0.029*10.705±0.185#30.045±0.673*32.961±0.494#低糖+NaHS中剂量16.488±0.499*16.694±0.636#9.443±0.135*11.776±0.318#30.675±1.576*33.680±1.943#低糖+NaHS高剂量17.355±0.142*17.494±0.259#9.514±0.083*10.653±0.154#43.154±1.384*47.366±1.482#高糖对照 5.178±0.543** 5.633±1.081##17.164±0.173#21.087±0.304#15.324±0.959*16.808±0.922#高糖+NaHS低剂量11.424±0.227△△11.791±0.449▲▲15.652±0.128△19.331±0.272▲21.555±1.327△23.647±1.359▲高糖+NaHS中剂量14.143±0.650△△15.148±1.660▲▲11.996±0.075△19.923±0.358▲33.253±1.432△36.509±1.677▲高糖+NaHS高剂量12.985±0.221△△13.139±0.499▲▲13.029±0.121△16.089±0.277▲27.829±1.516△30.538±1.800▲
与24 h低糖对照组比较,*:P<0.05,**:P<0.01; 与48 h低糖对照组比较,#:P<0.05,##:P<0.01;与24 h高糖对照组比较,△:P<0.05,△△:P<0.01; 与48 h高糖对照组比较,▲:P<0.05,▲▲:P<0.01。
2.2 测定细胞培养液H2O2水平的结果 高糖组24、48 h的H2O2水平较低糖对照组明显增加(P<0.01)。细胞培养24、48 h,低糖+NaHS低、中、高剂量组H2O2水平与低糖对照组相比,以中剂量的NaHS对H2O2水平降低效果明显(P<0.05);高糖+NaHS低、中、高剂量组H2O2水平与高糖组相比,有不同程度的降低,其中以中剂量的NaHS对H2O2水平降低效果更为明显 (P<0.05,见表2)。
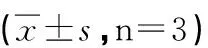
组别H2O2水平(mmol/L) 24 h 48 h低糖对照125.005±4.035190.288±9.658低糖+NaHS低剂量130.533±4.462198.428±9.600低糖+NaHS中剂量 115.474±4.340*176.431±15.984#低糖+NaHS高剂量126.999±4.141 193.233±10.332高糖对照244.388±7.969**369.031±19.720##高糖+NaHS低剂量230.388±7.480 345.516±17.980高糖+NaHS中剂量 160.787±21.396△242.361±18.870▲高糖+NaHS高剂量199.845±6.287△300.587±15.490▲
与24 h低糖对照组比较,*:P<0.05,**:P<0.01; 与48 h低糖对照组比较,##:P<0.01;与24 h高糖对照组比较,△:P<0.05; 与48 h高糖对照组比较,▲:P<0.05。
2.3 测定各组ROS水平的结果 高糖对照组24、48 h的ROS水平较低糖对照组明显增加。细胞培养24、48 h,低糖+NaHS低、中、高剂量组ROS水平与低糖对照组相比,均有不同程度的降低,其中以中剂量的NaHS对ROS水平降低效果较明显;高糖+NaHS低、中、高剂量组ROS水平与高糖对照组相比,也有不同程度的降低,其中以中剂量的NaHS对ROS水平降低效果较明显 (见图1~2)。
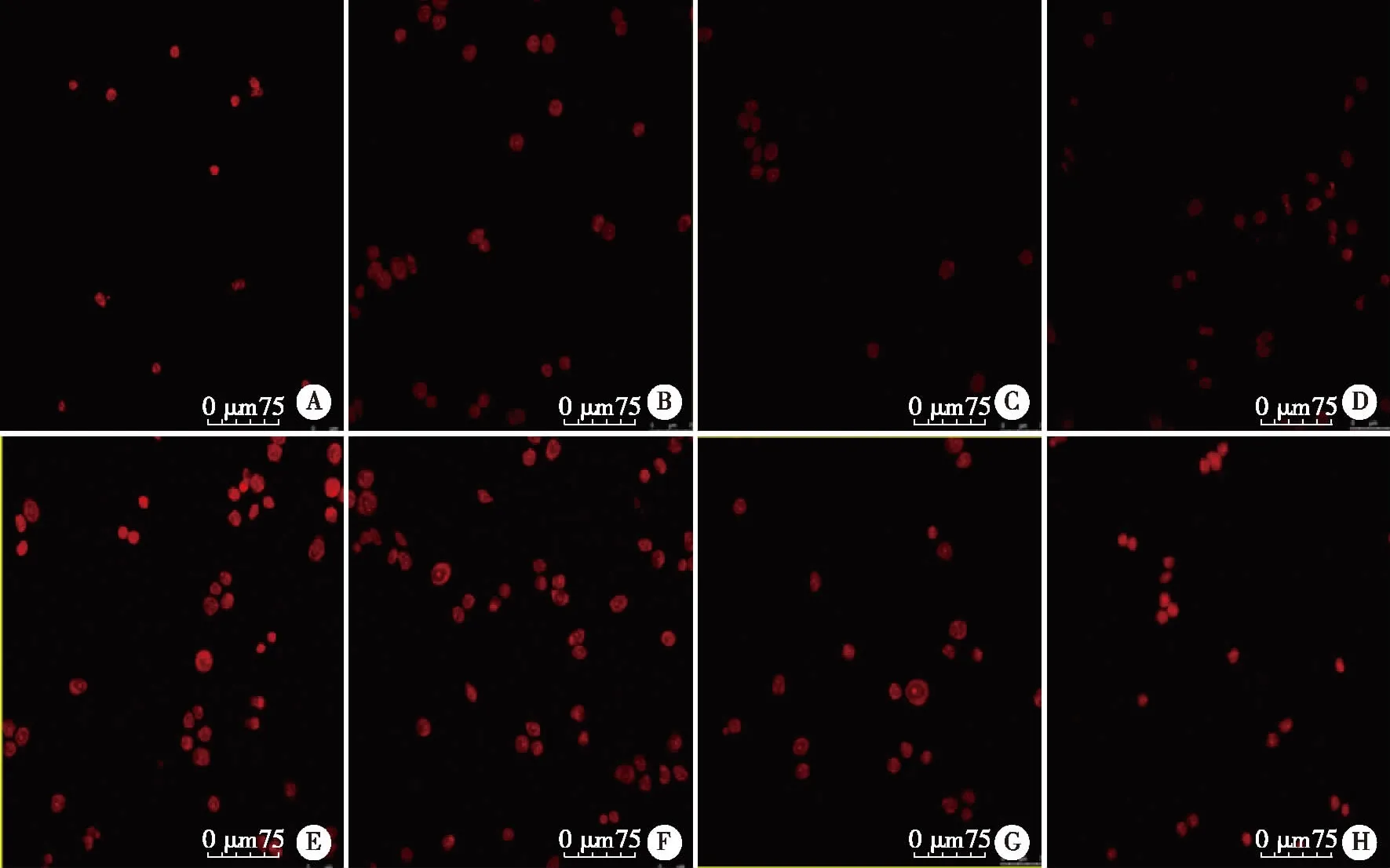
A:低糖对照组; B:低糖+NaHS低剂量组; C:低糖+NaHS中剂量组; D:低糖+NaHS高剂量组; E:高糖对照组; F:高糖+NaHS低剂量组; G:高糖+NaHS中剂量组; H:高糖+NaHS高剂量组。图1 细胞培养24 h高糖及NaHS对各组HK-2细胞ROS水平影响
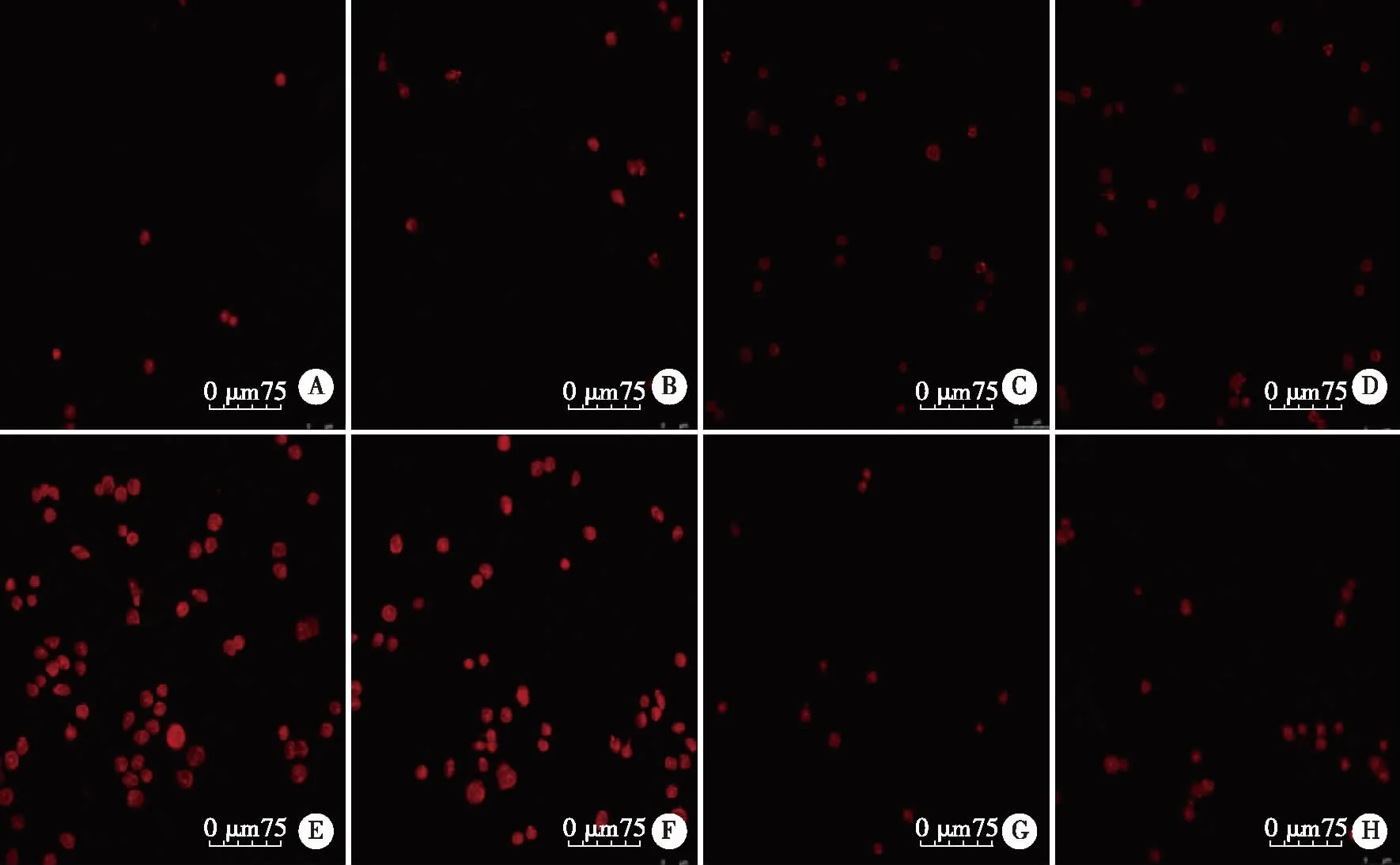
A:低糖对照组; B:低糖+NaHS低剂量组; C:低糖+NaHS中剂量组; D:低糖+NaHS高剂量组; E:高糖对照组; F:高糖+NaHS低剂量组; G:高糖+NaHS中剂量组; H:高糖+NaHS高剂量组。图2 细胞培养48 h高糖及NaHS对各组HK-2细胞ROS水平影响
3 讨论
DN是糖尿病严重的微血管并发症,也是导致慢性肾功能衰竭的主要原因。高血糖是公认的DN中起关键作用的因子,肾小管结构或功能的损伤在早期糖尿病肾病的形成中具有重要作用[6]。高血糖环境下,可引起肾组织发生氧化应激,损伤肾小管上皮细胞[7]。氧化应激反应产生的ROS在DN发生和发展中起关键性作用[8]。在正常情况下,适量的 ROS在细胞内信号转导过程中发挥作用,而当细胞内的ROS水平异常升高时,氧自由基的清除剂SOD不能及时将过量的ROS 清除,导致细胞膜上的脂质发生过氧化,引起细胞膜通透性的改变,进而引起氧化损伤,并可引起细胞内信号传递发生紊乱,从而促进细胞凋亡[9-10]。
SOD能清除超氧阴离子自由基(O2 -) ,其活力的高低直接反应了机体清除自由基的能力,GSH-px 是机体内广泛存在的一种重要的过氧化物分解酶,保护细胞膜的结构及功能不受过氧化物的损害,反映机体的抗氧化能力。MDA 是过氧化脂质分解产物,其含量测定常与 SOD 的测定相互配合,MDA 的浓度和SOD 活力可作为膜脂质过氧化损害程度的主要标志。高糖环境可引起内源性H2S产生减少,导致细胞发生病理改变,补充外源性H2S或(和)内源性H2S的增多有效抑制了DN的病理改变,抑制细胞凋亡[11~13]。H2O2作为细胞内信号分子可进行信号传导,在生理状况较低水平可模拟生长因子的某些效应,如增殖和(或)存活。但H2O2浓度的急剧增高可引起细胞氧化应激、DNA氧化及损伤,继而发生细胞突变和凋亡[14]。
本实验结果显示高糖培养HK-2 细胞24、48 h后,细胞内产生ROS 增多,培养液中H2O2水平增高,MDA含量逐渐增高,而 SOD 活性降低、GSH-px活力减退,说明高糖诱发细胞处于氧化应激状态,表明氧化应激参与了糖尿病肾病的发生。给予不同浓度的NaHS,可减少高糖环境下ROS 生成,减少H2O2的产生,降低MDA 含量,提高SOD活性和GSH-px活力,对肾小管起一定的保护作用。在本实验研究中,还发现外源性H2S可减少低糖条件下ROS 生成,减少低糖条件下的H2O2的产生,降低MDA 含量,提高SOD 活性以及GSH-px活力。在以往的实验结果还显示外源性H2S可抑制低糖和高糖条件下的HK-2细胞的凋亡[13]。
综上所述,无论在低糖条件还是高糖环境,外源性H2S可通过减轻肾小管细胞的氧化损伤,抑制细胞凋亡而发挥其对肾脏的保护作用。
