基于转录组学分析预测潜在的γ-和β-珠蛋白基因表达调控因子
2018-11-14王南宇崔申申张祝琴刘德培
王南宇,杨 科,崔申申,张祝琴,刘德培
(中国医学科学院 北京协和医学院 基础医学研究所 医学分子生物学国家重点实验室,北京 100005)
人的β-珠蛋白基因簇随着个体发育进程,依次表达ε-珠蛋白、γ-珠蛋白基因、β-珠蛋白基因,该珠蛋白基因表达转换过程受到严格的时空特异性调控,是一个复杂精细的真核基因表达调控事件[1]。由于成年期β-珠蛋白基因编码结构的突变或表达量的减少导致的β-血红蛋白病是世界上最大的单基因遗传病,而在成年期开启胎儿期表达的γ-珠蛋白基因,可以治疗β-血红蛋白病[2]。因此,研究γ-向β-珠蛋白基因的表达转换,不仅在基因表达调控理论上还是临床应用上都具有很大的意义。
但是参与该过程的重要调控因子KLF1和BCL11A的敲除并不能在成年期有效开启γ-珠蛋白基因的表达,提示更多的调控因子参与了γ-向β-珠蛋白基因的表达转换[3]。本研究通过对不同组织来源细胞间γ-和β-珠蛋白基因差异表达的两组RNA-seq数据进行分析,预测潜在的γ-和β-珠蛋白基因表达调控因子,以期对γ-和β-珠蛋白基因表达调控的研究提供一定的指导。
1 材料与方法
1.1 材料
用不同组织来源细胞间γ-和β-珠蛋白基因差异表达的两组RNA-seq数据(美国国立生物信息中心的基因表达综合数据库GEO,http://www.ncbi.nlm.nih.gob/geo/),其一组的登录号为GSE102201,是将人类胎肝和成年外周血中的CD34+造血干祖细胞(HSPC)进行体外诱导红系分化,在分化第11天和第14天分别收样并用Illumina NextSeq 500进行RNA-seq[4];另一组为GSE107218、GSE53983,是对人类脐带血和外周血来源的CD34+HSPC分别进行体外诱导红系分化,并分离红系分化各个时期如原始红细胞(proerythroblast,PRO)、早期早幼红细胞(early basophilic erythroblast,EBASO)、晚期早幼红细胞(late basophilic erythroblast,LBASO)、中幼红细胞(polychromatophilic erythroblast,POLY)、晚幼红细胞(orthochromatic erythroblast,ORTHO),用Illumina HiSeq 2500对其进行RNA-seq[5-6]。
1.2 方法
1.2.1 RNA-seq数据处理与差异表达基因的分析:用fastq-dump命令下载两组RNA-seq数据,并用FastQC和Trimmomatic-0.36分别对数据进行质量检测和去除低质量和测序接头序列后用HISAT2和featureCounts分别将序列比对至人类参考基因组上并对应到具体的基因得到相应的counts值,完成对该数据的定量分析。接着用DESeq2对相同分化时期不同组织来源细胞间差异表达基因进行分析,筛选P<0.05且│log2 FoldChange│≥1的基因为差异表达基因。
1.2.2 差异表达基因的IPA分析:IPA(Ingenuity Pathway Analysis)是基于庞大的Ingenuity Knowledge Base数据库,可搜索基因、蛋白、疾病与经典通路等相关信息,并预测分子集群参与的经典通路、生物过程、上游调控子等信息[7]。本研究利用IPA对相应差异表达基因进行上游调控因子的预测。
1.2.3 差异基因编码蛋白以及上游调控因子的相互作用分析及关键基因的预测:将差异表达基因编码蛋白以及其预测出的上游调控因子一起导入STRING数据库,分析各因子间的相互作用,进而用Cytoscape中的CentiScape插件预测其调控关键基因。
2 结果
2.1 差异表达基因的筛选
从GSE102201数据中筛选出分化第11天外周血与胎肝来源细胞间差异表达基因为1 857个,分化第14天的差异表达基因为1 530个,共同的差异表达基因为635个;从GSE107218、GSE53983数据库中筛选出原始红细胞时期外周血与脐带血来源细胞间差异表达基因为578个,早期早幼红细胞时期为610个,晚期早幼红细胞时期为358个,中幼红细胞时期为1 987个,晚幼红细胞时期为1 812个,共同的差异表达基因为173个(表1)。
2.2 差异表达基因的IPA分析
不同的组织来源决定了γ-和β-珠蛋白基因的差异表达模式,因此差异表达基因的上游调控因子也可能是潜在的调控因子。通过IPA对外周血与胎肝来源间不同分化时期共有的差异表达基因进行上游调控因子的预测,共预测出111个;对外周血与脐带血来源间不同分化时期共有的差异表达基因进行上游调控因子的预测,共预测出30个,如表2所示前20个。
2.3 γ-和β-珠蛋白基因表达调控因子的预测
过STRING数据库和Cytoscape对外周血与胎肝来源间不同分化时期共有的635个差异表达基因及其预测出的111个上游调控因子进行蛋白质间相互作用分析和展示(图1),并利用Centiscape计算蛋白质间相互作用的强度, 按照Degree unDir大小进行排序,预测出148个潜在的调控因子(其Degree unDir大于BCL11A); 对外周血与脐带血来源间不同分化时期共有的173个差异表达基因及其预测出的30个上游调控因子进行同样的分析,共预测出41个潜在的调控因子。其中,共同预测出潜在的调控因子有14个,为MAPK1、TNF、IFNG、MPO、LGALS3、CEBPA、BRD2、COL18A1、CA2、SELPLG、COL4A5、THBD、MAPKAPK3、CAMK2D。
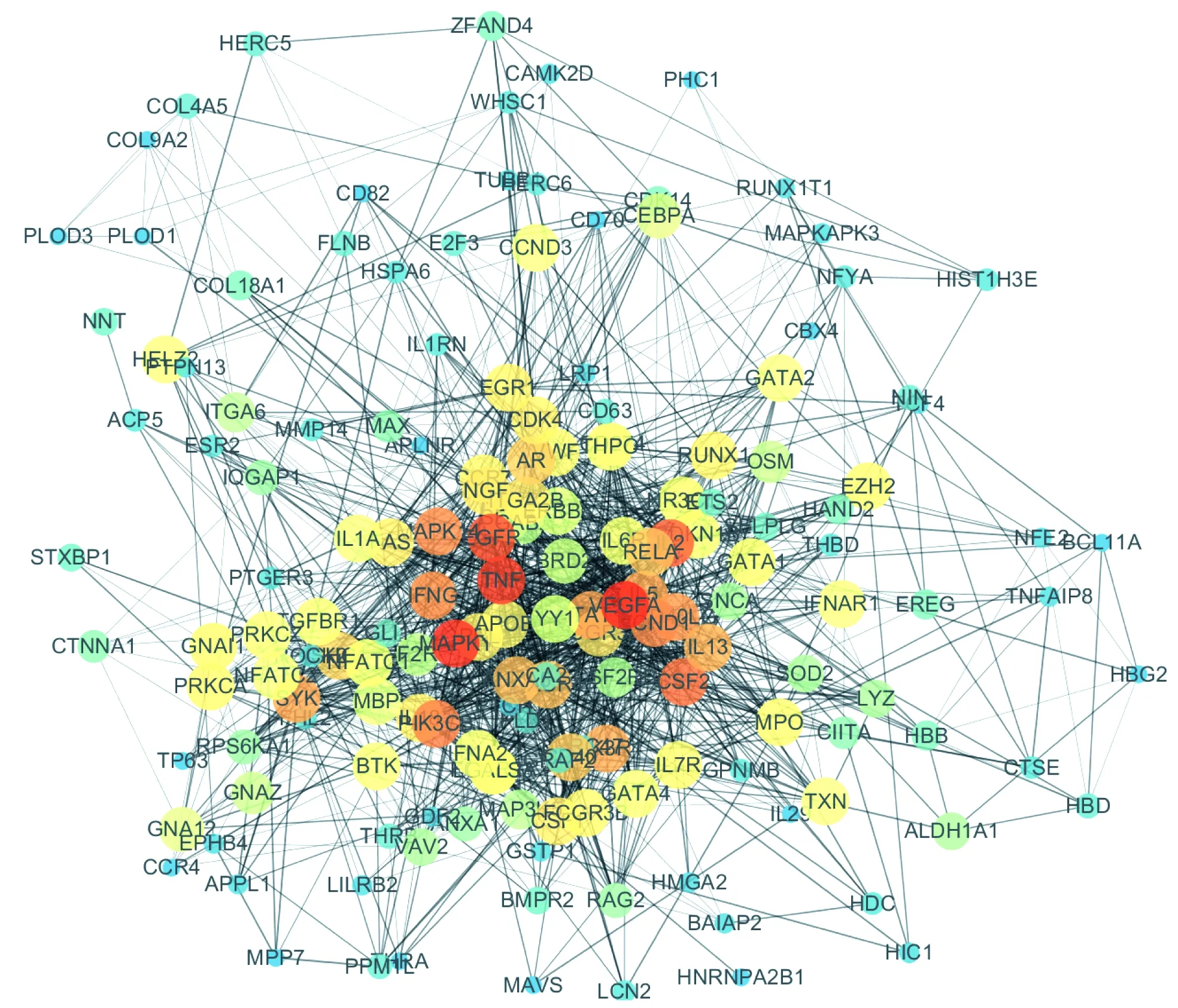
图1 外周血与胎肝来源间差异表达基因及上游调控因子间的蛋白质间相互作用网络图Fig 1 Protein-protein interaction network of differentially expressed genes and upstream regulators derived from peripheral blood and fetal liver
3 讨论
γ-和β-珠蛋白基因表达受众多调控因子的调控,大量有关γ-和β-珠蛋白差异表达组织转录组数据的出现,使利用生物信息学手段挖掘更多参与珠蛋白表达的调控因子成为可能。本研究通过对珠蛋白基因差异表达相关的RNA-seq结果进行分析,利用相应的共有差异表达基因及其预测的上游调控因子进行蛋白质间相互作用网络的构建,其中包括BCL11A、NF-E2、GATA1、GATA2、YY1等已知的γ-和β-珠蛋白基因表达调控因子,并预测到14个潜在的调控因子。其中预测出的前3个潜在因子MAPK1、TNF、IFNG均与β类珠蛋白基因的表达有关,如MAPK1参与到了一些小分子药物通过表观修饰改变影响γ-珠蛋白基因表达的过程中[8],除此之外,在红系分化过程当中,G蛋白偶联受体也可通过JUN和MAPK1信号通路激活γ-珠蛋白基因的表达[9-10];IFNG可通过NF-κB/Jun信号通路抑制活化素A/NF-E2对红系基因包括ζ-珠蛋白基因的表达激活作用[11],也发现IFNG在脐带血、成年外周血来源的红细胞中均可影响珠蛋白基因的表达,而且在脐带血、成年外周血来源的红细胞中均可影响珠蛋白基因的表达,而且在镰刀型细胞贫血症和地中海贫血患者来源的红系祖细胞中IFNG可抑制γ-珠蛋白基因的表达[12], TNF的单克隆抗体在治疗强直性脊柱炎(ankylosing spondylitis, AS)时也可明显提升血红蛋白的表达水平[13]。而预测出的潜在的γ-和β-珠蛋白基因表达调控因子的准确性需要后续的分子生物学实验进行验证。
