应用CRISPR/Cas9体系对番茄PSY 1基因的定点编辑
2018-11-08焦彦生苗如意
成 妍 焦彦生 乔 宁 苗如意
(山西省农业科学院蔬菜研究所,山西太原 030031)
近年来兴起的CRISPR(clustered regularly interspaced short palindromic repeats)/Cas(CRISPR associated)体系是继 ZFNs(Zinc-finger nucleases)(Urnov et al.,2010) 和 TALENs(transcription activator like effector nucleases)(Joung & Sander,2013)之后的第3代基因组编辑技术(Sanagala et al.,2017)。CRISPR是广泛存在于细菌和古细菌基因组中的特殊DNA重复序列,由可俘获的外源DNA组成,当含有同样序列的外源DNA入侵时,可被细菌机体识别,并进行剪切使之表达沉默,达到保护自身安全的目的(Barrangou et al.,2007)。Cas蛋白存在于CRISPR位点附近,是一种双链DNA核酸酶,能在sgRNA(small guide RNA)引导下对靶位点进行切割(Jinek et al.,2012)。目前已经发现多种类型的CRISPR/Cas系统,其中CRISPR/Cas9系统组成最为简单,只需要1个Cas9蛋白就可切割DNA双链,形成双链DNA缺口(Mali et al.,2013)。然后细胞借助HR机制(homologous recombination) 或 者 NHEJ机 制(non-homologous end joining)对断裂的DNA进行修复(Voytas,2013)。由于CRISPR/Cas9技术在载体构建等方面比ZFNs和TALENs有许多优势,目前该技术已成功应用在多种细菌、动物、植物和人类的基因编辑中(Nekrasov et al.,2013;Wang et al.,2013;Liu &Fan,2014;Liu et al.,2015;杨学飞 等,2017)。
八氢番茄红素合成酶(phytoene synthase,PSY)是植物类胡萝卜素生物合成途径中促进番茄红素合成的上游关键酶,催化两分子的牻牛儿基牻牛儿基焦磷酸(geranylgerany pyrophosphate,GGPP)缩合形成八氢番茄红素,目前已从番茄中分离得到 PSY 1(Fraser et al.,1999)和 PSY 2(Kato et al.,2004)2个编码基因。PSY基因在番茄成熟过程中发挥着重要的作用。番茄作为蔬菜中模式植物,经常被应用于基因组遗传操作的研究。英国诺丁汉大学植物科学系Graham Seymour实验室一直致力于番茄果实成熟调控机制的研究(Liu et al.,2015;Uluisik et al.,2016),目前已完成番茄果实成熟过程中的转录组测序,并对调控这一过程的关键基因进行了筛选,为了进一步研究这些基因的功能,对这些基因进行基因组水平编辑已成为必要。本试验拟在此基础上建立一种以CRISPR/Cas9系统介导的能够稳定敲除番茄基因的新方法,以期为番茄重要性状相关基因功能鉴定提供依据,为构建番茄果实成熟的调控网络,揭示果实成熟机制提供试验基础。
1 材料与方法
1.1 试验材料
番茄材料AC++种子由英国诺丁汉大学植物科学系Graham Seymour教授提供。
所用载体、根癌农杆菌、大肠杆菌感受态细胞均由英国诺丁汉大学植物科学系提供。
1.2 试验方法
1.2.1 番茄PSY 1基因CRISPR/Cas9体系中sgRNA的合成 根据Mali等(2013)的方法在番茄PSY 1基因序列第1外显子区寻找PAM基序和sgRNA序列,并根据sgRNA序列设计特异引物(F1:5′-TG TGGTCTCAATTGGCAGGCAGCCTTGGTGAAGGTTTTAGAGCTAGAAATAGCAAG-3′;F2:5′-TGTGGTCTCA AGCGTAATGCCAACTTTGTAC-3′)。PCR 反应体系为 25 μL,包含 9.9 μL ddH2O,12.5 μL Q5 Master mix(QIAGEN),1.25 μL上游引物,1.25 μL下游引物,0.1 μL 载体 pICH86966::AtU6p::sgRNA_PDS(Addgene plasmid 46966)。进行35个循环的扩增,2%的琼脂糖凝胶电泳分析。
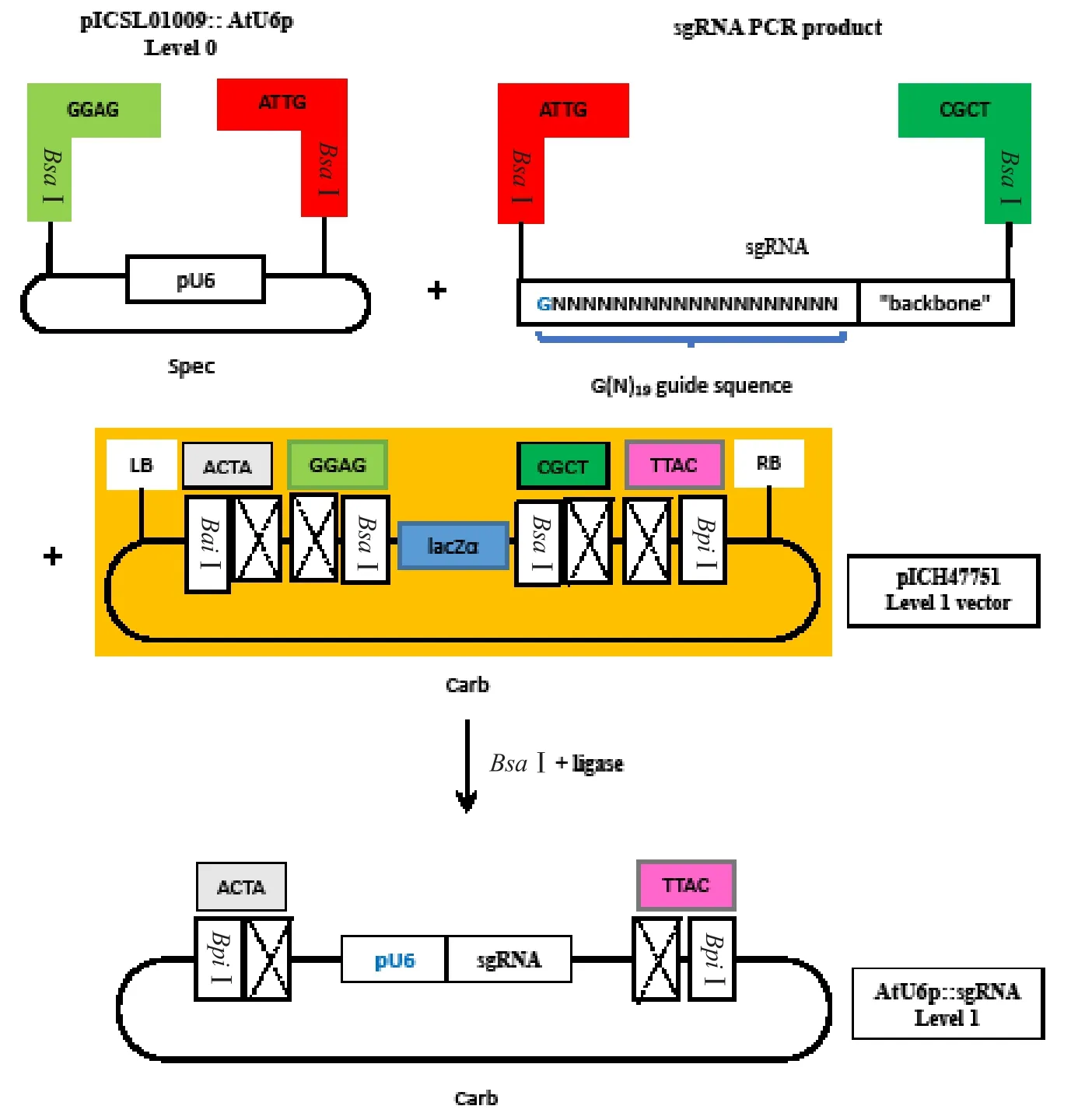
图1 番茄PSY 1基因CRISPR-Cas9 Level 1载体构建图解
1.2.2 CRISPR/Cas9 Level 1载体构建 采用GenElutTMPCR Clean-Up Kit(SIGMA)进行sgRNA PCR产 物 纯 化。4.4 μL纯 化 产 物 与 0.3 μL pICSL01009::AtU6p、0.3 μL pICH47751、1.0 μL 10 mmol·L-1ATP、1.0 μL T7buffer、1.0 μL Bsa I、1.0 μL T7ligase、1.0 μL Cut smart buffer混合进行CRISPR-Cas9 Level 1载体连接反应(图1)(Weber et al.,2011)。转化大肠杆菌DH5α(DH8142)感受态细胞并克隆。用特异性引物(F1和F2)进行菌液PCR鉴定,2%的琼脂糖凝胶电泳分析。提取阳性菌液的质粒DNA,送公司(Eurofins MWG Operon)测序。分析比对测序结果,检测是否成功将双链sgRNA连接到U6-sgRNA载体上。1.2.3 CRISPR/Cas9 Level 2载体构建 取0.3 μL构建好的 Level 1载体与 0.2 μL pICH47732: NPTⅡ、0.2 μL pICH47742: Cas9、0.3 μL pICH41766、1.0 μL pAGM4723、2.0 μL ddH2O、1.0 μL cut smart buffer、1.0 μL 10 mmol·L-1ATP、1.0 μL Bpi I、1.0 μL T7ligase、1.0 μL T7buffer混合进行CRISPRCas9 Level 2载体连接反应(图2)。转化大肠杆菌DH5α(DH8142)感受态细胞并克隆。用特异性菌液PCR引物(F1和F2)进行PCR鉴定,2%的琼脂糖凝胶电泳分析。挑选3个阳性菌液提取质粒DNA,测序。分析比对测序结果,检测是否成功将双链sgRNA连接到Cas9载体上。1.2.4 番茄CRISPR/Cas9/PSY 1 Level 2载体转化农杆菌 摇菌10 mL(LB+Kanamycin),使其OD600约为1.5左右,然后依据PuriLink Quick Plasmid DNA Miniprep Kits(Invitrogen)提取连接了PSY 1-sgRNA的CRISPR-Cas9质粒,使最终质粒浓度大于100 ng·μL-1。取40 μL农杆菌EHA105感受态细胞与2 μL Level 2质粒DNA混匀,并转移到预冷的电转杯中,在电转仪上进行转化(2.5 kV,400 Ω,25 μFD)。之后立即加入 1 mL预冷的LB培养基,转移到1 mL离心管中,28 ℃振荡培养3 h。吸取100 μL培养液涂LB平板(含100 mg·L-1Kanamycin),28 ℃培养过夜。在LB平板上挑取白色单克隆到10 mL LB培养基中(含100 mg·L-1Kanamycin),28 ℃培养过夜。用特异性引物(F3:5′-GAAATTTAGATTGAAGCTGG-3′;F4:5′-GTGTTTTCAACTGGGTGTTC-3′)进行菌液 PCR鉴定,2%的琼脂糖凝胶电泳分析。菌液与50%的甘油混合,-80 ℃保存。

图2 番茄PSY 1基因CRISPR-Cas9 Level 2载体构建图解
1.2.5 CRISPR/Cas9/PSY 1 农杆菌转化番茄子叶对番茄种子进行表面消毒,在MS培养基上播种,密度为3粒·cm-2。播种后10~12 d取子叶进行预培养24 h后,放入农杆菌菌液中浸泡15 min,再放回到原来的培养基上26 ℃暗培养2 d。将子叶转移到添加有80 mg·L-1Kanamycin和500 mg·L-1Carbenicilin的MS培养基中培养。每3~4周转移1次子叶至新鲜的培养基中。当有小植株从愈伤组织中长出时,转移至添加有0.87 mg·L-1IAA、80 mg·L-1Kanamycin和500 mg·L-1Carbenicilin的MS培养基中生根培养。将生根良好的瓶苗栽植到基质中。
1.2.6 突变检测 利用DNeasy Plant Mini Kit(QIAGEN)提取野生型和转基因植株的基因组DNA,并检测浓度。以提取的基因组DNA为底物,用特异性引物(F3:5′-GAAATTTAGATTGAA GCTGG-3′;F4:5′-GTGTTTTCAACTGGGTGTTC-3′)检测再生植株是否为转基因植株。再对PCR鉴定为转基因的再生植株用特异性引物(F5:5′-TTGG TTTGCCTGTCTGTGGT-3′;F6:5′-TGTGTTTGTGCGC GTAACTG-3′)进行PCR扩增。然后用2%的琼脂糖凝胶进行检测。采用GenElutTMPCR Clean-Up Kit(SIGMA)进行PCR产物纯化。吸取15 μL纯化的PCR产物送公司(Eurofins MWG Operon)测序,F5为测序引物。利用DNAMAN软件将测序的结果与野生型进行比对,分析确定目的区间的突变情况。1.2.7 表型性状鉴定 正常管理遗传转化植株,待其果实成熟时,观察果皮颜色。
2 结果与分析
2.1 番茄PSY 1基因CRISPR/Cas9体系中sgRNA的合成
理论上,用 pICH86966::AtU6p::sgRNA_PDS为模板扩增能合成174 bp的sgRNA(图3)。本试验利用特异引物扩增sgRNA获得180 bp左右的PCR产物(图4),与试验设计理论结果一致。
2.2 CRISPR/Cas9 Level 1载体验证
以Level 1载体菌液为模板,重复sgRNA PCR扩增反应,同样获得180 bp左右的PCR产物(图5),初步断定sgRNA部分已经整合到Level 1载体中。克隆测序结果进一步表明Level 1载体中包含有Bpi I酶切位点(ACTA和TTAC)、pU6、sgRNA骨架,且均没有发生碱基突变。
2.3 CRISPR/Cas9 Level 2载体验证

图3 番茄PSY 1基因CRISPR-Cas9体系中的sgRNA序列
图5 Level 1载体的扩增产物
以Level 2载体菌液为模板,重复sgRNA PCR扩增反应,同样获得180 bp左右的PCR产物(图3),初步断定sgRNA部分已经整合到Level 2载体中。克隆测序结果进一步表明Level 2载体中包含有NPT Ⅱ(图6)、Cas9、sgRNA和L3E部分,且均没有发生碱基突变。
图6 Level 2载体的扩增产物
2.4 转化农杆菌的验证
以转化后的农杆菌菌液为模板,对Cas9部分序列进行PCR扩增反应,获得1 800 bp左右的PCR产物(图7),断定Level 2载体序列已经整合到农杆菌中。

图7 农杆菌转化后的扩增产物
2.5 转基因植株的验证
通过选择培养基筛选具有Kanamycin和Carbenicilin抗性的再生植株,进行Cas9部分序列的PCR扩增反应,能获得1 800 bp左右的PCR产物。对这些再生植株进行目标区域PCR扩增反应,获得831 bp的PCR产物(图8),测序后进行序列比对,发现36个转基因植株中有22个(61%)PSY 1基因目标区出现不同数目的碱基缺失、增加或互换(表1)。待转基因植株果实成熟时,发现PSY 1基因目标区碱基发生改变的转基因植株果皮颜色由野生种的红色变成了黄色或橙色(表1)。其中有14株在PSY 1基因目标区发生了碱基缺失,其果皮颜色全部表现为黄色。另外的8株在PSY 1基因目标区发生了碱基变异,颜色全部表现为橙色。表明定点敲除PSY 1基因使番茄果色发生了改变,验证了PSY 1基因在番茄红果色形成中的作用。
图8 转基因植株的特异引物扩增产物
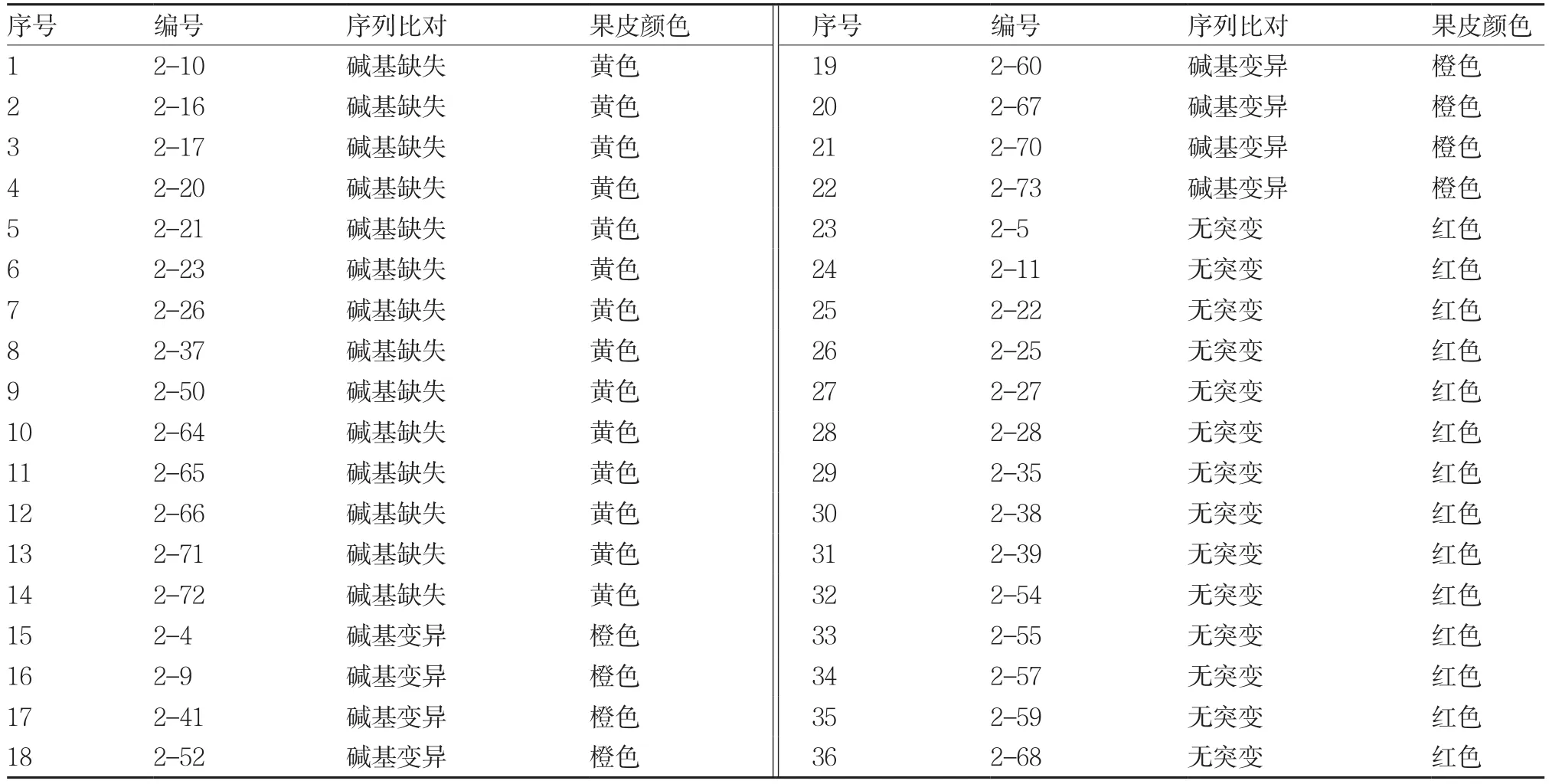
表1 T0植株的序列比对和果色观察结果
3 结论与讨论
相对于ZFNs和TALENs这两种目前研究较为成熟的打靶技术,CRISPR/Cas9系统载体更容易构建(Voytas,2013)。利用ZFNs和TALENs进行基因定点突变,每1个位点需要构建2个相应的核酸酶,且步骤繁琐,而CRISPR/Cas9系统对特异位点的识别仅靠sgRNA的引导(姚祝平 等,2017)。本试验根据目标基因序列按照G(N)19NGG标准设计了sgRNA,仅通过两步连接反应就成功构建了基因定点突变载体。更具优势的是,1个CRISPR/Cas9系统可以由多个sgRNA组成,对应不同的DNA识别位点,Cas9可以通用,因此构建1个载体即可实现对多个不同位点的打靶(Cong et al.,2013)。而且针对每个特异位点的sgRNA只有几十个碱基,整个载体较小,容易实现转化(Wang et al.,2013)。
CRISPR/Cas9系统能在sgRNA的引导下识别出特异的靶序列,且发现靶基因所在位点的双链DNA都会被Cas蛋白中的核酸内切酶剪切,实现RNA指导的DNA沉默(Liu et al.,2015)。Brooks等(2014)通过CRISPR/Cas9系统定点突变验证了SlAGO7基因在番茄中的作用,并证明了番茄中由CRISPR/Cas9系统介导的SlAGO7基因突变是高效的。蒲艳等(2018)基于S1U6启动子的CRISPR/Cas9基因组编辑载体,在番茄中成功实现对内源基因的编辑。本试验中有61%的转基因植株实现了PSY 1基因的定点敲除,使番茄果色发生了改变,再次证明了CRISPR/Cas9系统在番茄基因敲除中的高效性。
但由于sgRNA与靶位点DNA配对时存在种子序列,产生不严谨配对,在整个遗传操作过程中还是会有脱靶现象(Kleinstiver et al.,2015)。在本试验中也有39%的再生植株在PCR检测中表现为转基因植株,但对目标区域进行序列测定后发现没有发生序列改变。通过改变sgRNA的二级结构、改变sgRNA的长度、通过互补的切口酶预先制造双链DNA断裂,均有效降低了CRISPR/Cas9系统的脱靶率(Doench et al.,2014;Kleinstiver et al.,2016),但这些技术在具体应用中的效果还需进一步证实。
本试验通过CRISPR/Cas9系统成功编辑了番茄PSY 1基因,所有变异均发生在试验设计的PSY 1基因第1外显子区的目标区域,使PSY 1基因失去了功能。试验中发生碱基缺失的果实表现为黄色,说明这些果实中没有番茄红素,PSY 1基因彻底失去了功能,呈现出少量胡萝卜素的黄色;而发生碱基变异的果实都表现为橙色,说明这些果实中还含有少量的番茄红素,与胡萝卜素共存,呈现为橙色。这些少量的番茄红素是如何合成的,则需要对橙色转基因番茄做一步的研究。
