药物基因组学在心血管疾病治疗中的研究进展
2018-11-08王群林文华
王群,林文华
心血管疾病(CVD)指的是心脏和循环系统的所有疾病。其是由基因和环境因素的复杂关系引起的,被认为是一种无声的慢性疾病,只有在出现严重症状的时候才被发现,心血管病有许多危险因素包括异常胆固醇,高血压,糖尿病(DM),吸烟,不健康饮食、过量饮酒、腹部肥胖、压力和久坐不动的生活方式。治疗通常包括改善生活方式、药物和手术。心血管疾病的治疗正在进入个体化医疗的时代。药物基因组学作为个体化医疗的一种工具,它的主要目标是根据个体患者的基因组决定最优的药物治疗。而且通过研究药物基因组学也可增强我们对CVD机制的理解,揭示新的药物靶点和确定药物耐药性的机制。本文将重点讨论不同的基因多态性型是如何影响一些不同抗心血管疾病药物的临床效用。
1 他汀类药物
他汀类药物是心血管疾病一级和二级预防的基石。通过竞争性抑制胆固醇合成限速酶HMG-CoA还原酶,使胆固醇合成减少,血清和组织细胞内胆固醇浓度均降低,促进浓度依赖的低密度脂蛋白(LDL)受体活性提高,加速LDL的分解代谢,并能减少极低密度脂蛋白(VLDL)的生成,使VLDL转化成LDL减少,从而进一步降低LDL-C(低密度脂蛋白-胆固醇)水平。目前有7种他汀类药物经食品和药物管理局(FDA)批准,用于治疗心血管疾病,由于他汀治疗心血管疾病的成功,其处方适应症和目标人群继续扩大,尽管他汀类药物取得巨大成功,但很大一部分目标人群药物反应性差,同时不良反应较多。他汀诱导肌毒性(SIM)包括肌病,肌炎和其他相关肌肉症状,SIM是他汀治疗中最常见的副作用,SIM常导致药物依从性差或不能长期坚持他汀治疗[1,2],肝毒性是另一种与他汀类药物相关的副作用,然而,一个应用他汀类药物治疗高脂血症进行的随机对照试验的荟萃分析发现使用他汀类药物治疗组和安慰剂组之间肝毒性无显著差异[3]。很有争议的是,他汀类药物也与中枢神经系统毒性有关[4],在过去的二十年中,通过研究数百个不同基因位点的基因变异对他汀类药物药代动力学的影响去尝试理解与避免药物毒性及无反应者。等位基因与他汀类药物反应有着密切的联系(表1)。
溶质载体有机阴离子转运体成员1B1(SLCO1B1)基因编码有机阴离子转运多肽(OATP1B1)蛋白质,被证明可以调节肝细胞对他汀的吸收[5],其特异性分布在肝细胞膜基底部外侧,负责底物从门静脉系统到肝细胞的主动转运,其功能的变化将影响转运药物的肝脏摄取和消除,这降低他汀类药物进入肝细胞的能力,由于他汀类药物的系统性积累,减弱降低血脂效果和增加SIM风险。近200种常见的SLCO1B1变异,但521C或SLC01B1 5(rs4149056)等位基因与临床最相关,一项研究表明[6],某些特定SLCO1B1基因变种与他汀类药物治疗时的高风险性相关,SLCO1B1基因521C可明显降低转运阿托伐他汀的能力,减弱降脂疗效,同时还显著增加SIM风险,药代动力学分析显示他汀类药物在血液中的浓度对于一个有521C等位基因的人来说大约是两倍,对于有两份拷贝的人几乎是三倍。此外,一项对9个临床试验的荟萃分析显示[7]:11 246个他汀的使用者,拥有521C等位基因发生SIM的概率是正常2.09倍,该研究还显示521C等位基因携带者在使用辛伐他汀时较其他他汀类药物风险更大。另一方面,这个基因中的某些基因多态性也有有益的影响,一项研究显示[8],SLCO1B1基因388G(rs2306283)SNP可能从他汀治疗获益,这项研究对SLCO1B1基因中的不同SNP进行试验,包括521C,证明携带388G SNP的患者接受阿托伐他汀药物治疗,可以提高高密度脂蛋白(HDL)浓度,在此基础上,另一项研究证明携带388G SNP的患者,在他汀类药物治疗期间,其SIM发生率更低。
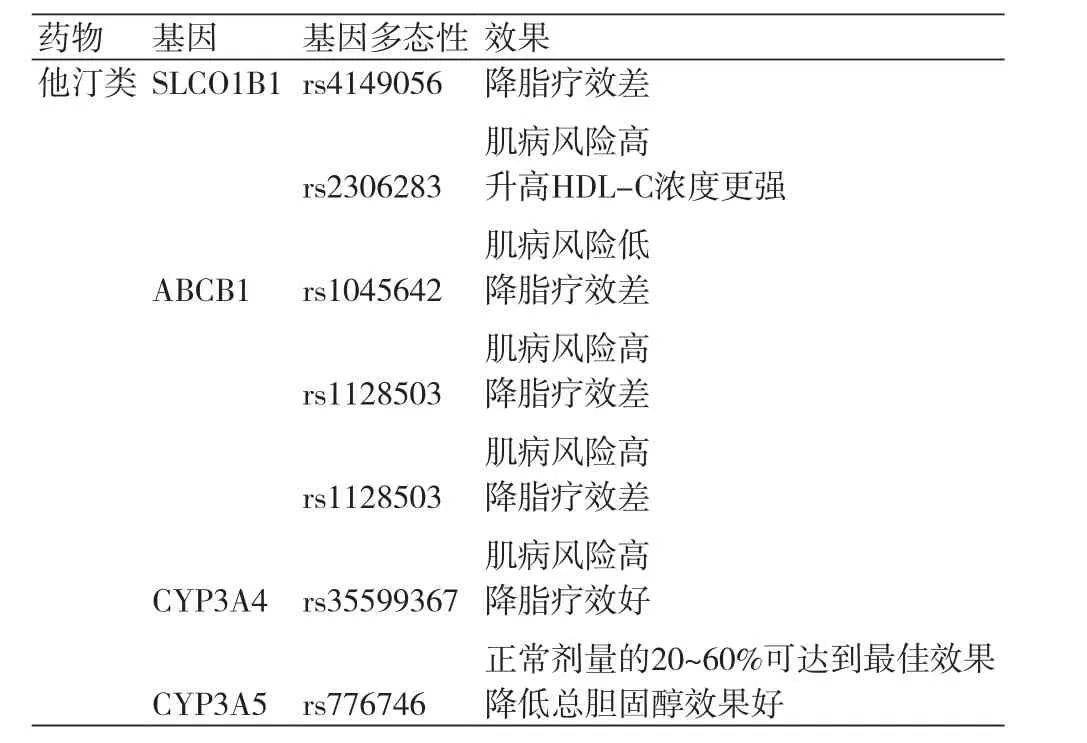
表1 影响他汀类药物反应的基因多态性
另一个重要的基因A T B结合盒B亚家族成员(ABCB1),编码多耐药蛋白质(MDR1),这种蛋白质帮助多种药物及基质跨过细胞膜,它是在肠道、肾脏和肝脏的细胞中表达,在这个基因中有三种基因多态性证明影响他汀的药代动力学,1236T(rs1128503),2677T(rs2032582)和3435T(rs1045642),这三种SNP被证明显著影响他汀类药物的代谢。3435T SNP携带者在辛伐他汀治疗期间[9],其降脂疗效减弱,肌痛风险增加,然而没有证据表明,在服用阿托伐他汀期间,3435T与肌痛风险相关[10]。尽管有上述发现,ABCB1并未建议用于常规预测肌毒性。
细胞色素P450 3A同工酶(CYP3A)是一组单加氧酶,其在胆固醇,类固醇和其他脂类的合成中及药物的代谢扮演重要角色。CYP3A4扮演最重要的角色,代谢所有药物的45%~60%,辛伐他汀,阿托伐他汀,洛伐他汀和西伐他汀主要是由CYP3A4酶进行代谢,而氟伐他汀主要是通过CYP2C9进行代谢,研究显示CYP3A4 22携带者与非携带者相比只需要常规他汀剂量的20%~60%,就可达到最佳降脂效果。CYP3A5也被证明在他汀代谢中发挥了作用,证实CYP3A5携带者较非携带者降低总胆固醇效果更佳。这些研究发现,可以更好的帮助临床大夫选择合适的他汀类药物及剂量。
2 氯吡格雷
氯吡格雷作为急性冠脉综合征经皮冠状动脉介入术(PCI)术后患者的常用药,其本身是一种前体药物,需要经过肝脏细胞色素P450系列酶代谢才能发挥抗血小板作用。CYP2C19是氯吡格雷代谢通路上的关键酶,该酶的活性受CYP2C19基因多态性的影响。由于遗传变异引起的耐药性通常发生在药物的吸收、代谢激活或生物活性阶段。不同的基因与对氯吡格雷治疗的不同反应有联系,CYP2C19 2(rs4244285)和CYP2C19 3(rs4986893)与剩余的血小板聚集率和氯吡格雷抵抗有关[11]。CYP2C1917等位基因导致了药物的快速代谢,这类患者在氯吡格雷治疗期间,由于氯吡格雷快速转化为活性代谢物,其出血风险大大提高。通过对CYP2C19基因单体检测,氯吡格雷反应,剩余血小板聚集和不良出血事件可以更好地预测。CYP2C19基因多态性与主要不良心血管病事件(MACE),包括支架内急性及亚急性血栓相关。Mega等[12]对162例健康受试者进行研究,发现携带CYP2C19等位基因与未携带CYP2C19等位基因人群相比,氯吡格雷活性代谢产物的浓度水平较低,以致血小板抑制率更低,因此携带CYP2C19等位基因人群,其发生MACE及支架内血栓的风险更高。同时对TRION-TIMI38试验中1477例接受氯吡格雷治疗的受试者基因变异和心血管疾病预后之间的关系进行深入研究发现:携带CYP2C19等位基因受试者较未携带者,其脑卒中、急性心肌梗死、心血管死亡风险相对增加53%(12.1% vs. 8%,P=0.01),而支架内血栓的风险增加了3倍(2.6% vs. 0.8%,P=0.02)。Sawada等[13]也发现支架内血栓与CYP2C19*2基因多态性有关,并且认为CYP2C19*2基因多态性是支架内血栓唯一的独立预测因子。Yamamoto等[14]认为残留血小板的高反应性与MACE的高发生率可能与CYP2C19基因多态性有关。氯吡格雷对血小板抑制率与CYP2C19基因多态性关系已成定论,因此对需要接受氯吡格雷治疗的患者,应早期检测基因型,明确氯吡格雷抵抗、低反应或者是高反应、针对每个患者,制定个体化抗血小板方案,有助于减少心血管疾病患者MACE及出血事件的发生及PCI后支架内血栓的形成,改善患者临床结局(表2)。
3 阿司匹林
阿司匹林是另一种常见的抗血小板药物,用于冠心病一级与二级预防,可有效降低心血管事件发生率,但有一部分存在阿司匹林抵抗的患者有着再发生血栓栓塞事件的风险,其作用机制为直接并且不可逆地抑制环氧化酶1和2(COX-1和COX-2),导致COX永久失活,血小板生成血栓素A2(TXA2)受到抑制,从而抑制血小板聚集,发挥抗血小板的作用。前列腺素内过氧化物合酶1、2(PTGS1、PTGS2)基因分别编码的COX-1和COX-2,据报道,-842 G(rs10306114)和50T(rs3842787)与阿司匹林抵抗有关,在一项对431例中国患者的研究中[15],-1676G(rs1330344)被认为与阿司匹林抵抗有关,携带-1676G等位基因的患者其阿司匹林抵抗约为正常的1.77倍,在另一组接受阿司匹林治疗的缺血性中风患者中CC纯合子,显示出更高的血管事件风险,风险比为1.958。PTGS2与动脉粥样硬化、中风和其他血管事件的发病机制有关,-765G(rs20417)与动脉粥样硬化、心肌梗死、缺血性中风有关,然而也有研究发现-765G携带者在阿司匹林治疗期间与心血管事件发生率不相关。基因多态性对心血管疾病的发展重要,但他们对阿司匹林的反应的影响似乎是最小且不一致的。GPⅡb/Ⅲa 是血小板表面的受体蛋白,它与vWF和纤维蛋白原均可引发血小板的聚集,是血小板激活的最后环节。其中,GPⅢa 是一种多型蛋白,其最常见的等位基因亚型是PLA1 和PLA2[16]。PLA2 位点的外显子2位置的T突变为C,从而导致GPⅢa 蛋白的第33 个位点从脯氨酸变成了亮氨酸。体外研究表明,PLA2 基因突变可增加血小板表面的GPⅡb/Ⅲa 对纤维蛋白原的反应,从而增加血小板聚集。这是导致阿司匹林抵抗的主要基因。
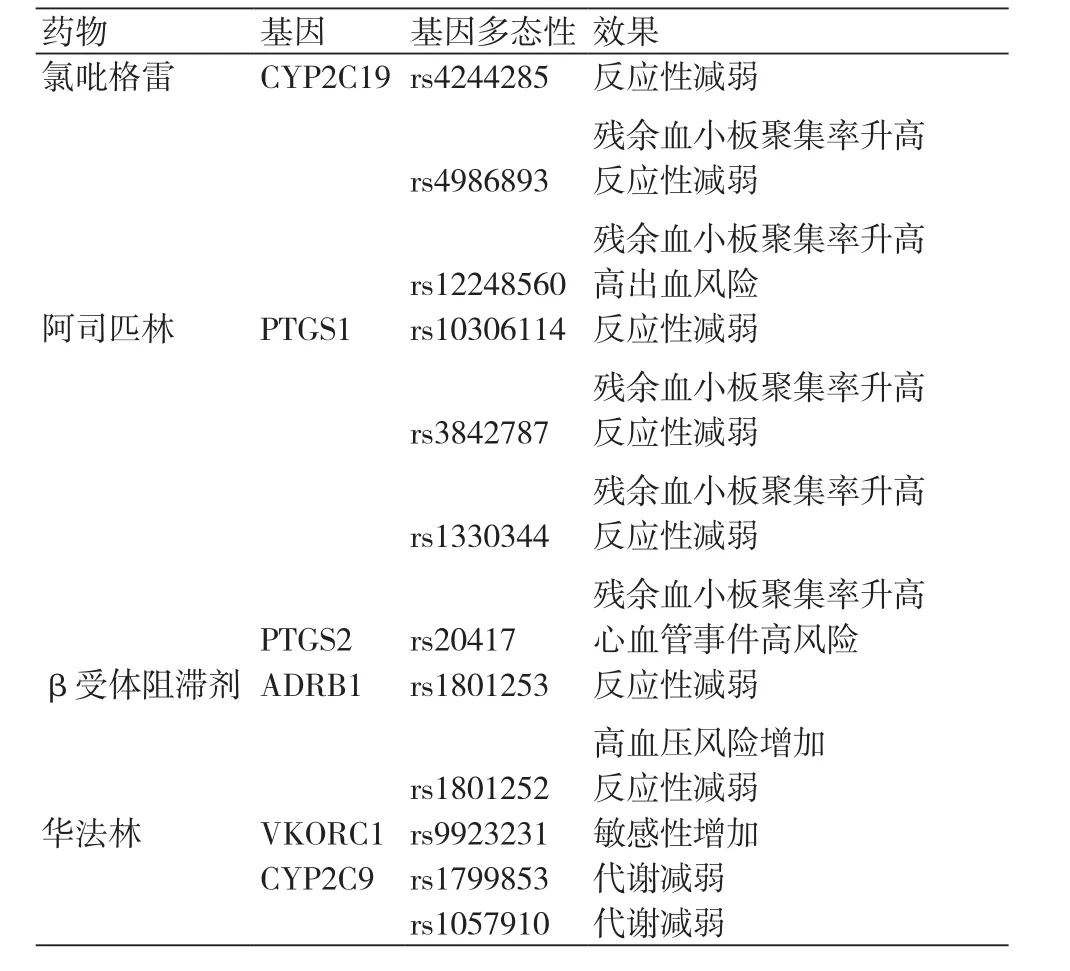
表2 主要基因多态性影响氯吡格雷、β受体阻滞剂、阿司匹林和华法林药物反应
4 β受体阻滞剂
β受体阻滞剂已被证实减少心衰患者病死率,同时改善心脏功能,ADRB1编码β-1肾上腺素受体蛋白,与β受体阻滞剂反应性密切相关,1165G(rs1801253)和145G(rs1801252)显示了最值得注意的结果,一个关于86 000多例的荟萃分析显示[17],1165G与高血压增加风险有关,许多研究也报告了1165G和145G与β受体阻滞剂的反应减弱密切相关,一个研究小组发现,1165G和145G都是β受体阻滞剂反应性减弱很好的预测因子,没有1165G等位基因的患者在白天的舒张压显著降低,多数情况下,非1165G等位基因携带者应用β受体阻滞剂在多种心血管疾病的治疗包括心房纤维性颤动,室性心律失常和心脏衰竭显示了良好的临床结果。例如,BEST试验显示[18]在1040例没有1165G等位基因心脏衰竭患者中,对比安慰剂应用布新洛尔可减少有38%的死亡率,对于1165G的携带者,应用布新洛尔与服用安慰剂的人相比没有减少死亡率。然而也有一些研究证实1165G和145G在应用β受体治疗期间和心血管事件不相关。尽管支持ADRB1基因的遗传变异在β受体阻滞剂应用中起潜在作用的数据非常吸引人,但需更多研究来证实。
5 华法林
华法林普遍用于心血管疾病的治疗,可防止血栓形成与发展,适用于预防和治疗血栓栓塞性疾病,但有其局限性,治疗窗口窄(2<INR<3),个体化差异明显,药物起效和失效慢,需要频繁调整药物剂量,并反复进行凝血酶原时间(PT)和INR测定,2007年、2009年FDA连续两次修改标签,强调基因信息对华法林适宜剂量的影响。根据药物遗传学算法(CYP2C9 & VKORC1基因型)确定的华法林剂量更接近患者的所需剂量,CYP2C9基因在华法林新陈代谢方面起着重要作用,CYP2C9 2(rs1799853)和CYP2C9 3(rs1057910)被证明是主要等位基因与华法林的新陈代谢降低,出血的风险更大有关[19]。华法林在体内由CYP2C9代谢为主要活性异构体S-华法林,CYP2C9*2和*3单核苷酸突变能减弱CYP2C9的活性,使其显著降低华法林的代谢能力,因此抗凝达标所需的华法林剂量也相应减少。但这两种突变的频率在亚洲人群中出现较小,CYP2C9基因多态性仅能部分解释个体间所需华法林剂量的差异。VKORC1是体内维生素K依赖性凝血因子生成的限速酶, 华法林可竞争性抑制此酶从而达到抗凝效果。近期有不少研究显示VKORC1基因多态性可明显影响华法林的使用剂量。然而确实存在其他的等位基因,包括*5,*6,*8,和*11,特别是在非洲人群,可以预测应用更低的华法林剂量即可达到治疗效果,VKORC13673G>A(rs9923231)基因与华法林敏感性增强有关[20],携带VKORC1 3673G>A和CYP2C9*2和*3患者已经被证明需要更低的剂量就可以达到治疗效果同时避免出血风险,尽管如此,药物基因学的使用仍然存在在华法林治疗中引起争议,主要原因是运用基因型多态性引导剂量没有改善抗凝管理。目前有研究发现根据CYP2C9和VKORC1基因多态性、体重、年龄等因素的多变量模型能优化和估算华法林的剂量, 近期也有大规模的临床试验数据支持上述结论。如果针对患者的新的个体化用药方案能用于实际临床工作,对于需要口服华法林抗凝的患者,在应用华法林前检测其相关基因型,可帮助医生更好的调整华法林剂量,从而使患者获益更多,改善临床预后。
药物基因组学的主要目的是通过根据基因数据找到药物靶点转化为针对患者的个体化治疗,从而改善临床结果,本文关注的是不同基因多态性如何改变他汀类药物、氯吡格雷,阿司匹林、β受体阻滞剂,华法林用于心血管疾病的治疗反应。药物基因组学帮助确定了预后生物标志物并设计更好的靶向治疗,还有更多的药物使用受益于药物基因组学方法,甚至更多的受益将会从被研究的大量基因中获得。
