急性肺挫伤早期肺泡灌洗液表面活性蛋白与TNF-α、IL-32的变化趋势及相关性
2018-11-07李东锦王伟熊新明方丹青
李东锦 王伟 熊新明 方丹青
广州医科大学附属第二医院胸外科(广州 510260)
胸部钝器伤及其并发症约占所有钝器伤致死人数的25%,而这些患者中约30%~75%伴有肺挫伤[1]。严重肺挫伤时,肺组织水肿,进而导致炎症反应使肺功能严重受损,如不及时进行有效的治疗可能会发展成为急性呼吸窘迫综合症,后果更为严重。因此在急性肺挫伤早期进行准确的诊断和治疗尤为重要。在既往的实验中[2]肺表面活性物质(PS)在急性肺挫伤后的替代治疗中,其保护肺功能及抑制炎症反应的作用得到了肯定。现今肺表面活性物质蛋白(SP)及其表达的研究越来越深入,但尚未见对SP-A、B、C、D及其参与调控的炎症因子IL-32及TNF-α在急性肺挫伤早期的整体变化趋势及其相关性做出整体概述的报道,本文通过建立兔肺挫伤模型,研究急性肺挫伤早期SP-A、B、C、D与TNF-α、IL-32的变化趋势及相关性,从而为进一步研究急性肺挫伤时SP蛋白在炎症调控中的作用机制提供理论依据。
1 材料与方法
1.1 实验动物36只新西兰白兔,雌性,由广东中医药大学实验动物中心提供(合格证号:粤监证字2008A006),体质量2.0~ 2.5 kg。
1.2 分组与处理36只新西兰白兔随机数字分组法分为急性胸外伤肺挫伤组(n=30)及正常无损伤对照组(n=6)。其中肺挫伤组参照方丹青[2]的方法建立急性肺挫伤模型,根据挫伤时间分为6组,每组5只。分别于1、2、3、4、8、12 h经兔颈静脉取血,离心机离心处理后取上清液存放至-70℃冰箱内待测TNF-α及IL-32含量。然后立即处死实验兔,解剖胸腔,完整取出右肺,沿右主支气管注入4℃生理盐水,每次20 mL,共3次,收集BALF置于-70℃冰箱中保存待测SP-A、B、C、D、TNF-α及IL-32含量。在右肺挫伤明显处取一小块挫伤组织,以甲醛及戊二醛固定后置于4℃冰箱内保存,分别送电镜检查。
1.3 TNF-α、IL-32检测采用双抗夹心ELISA法(通用型抗TNF-α、IL-32的ELISA检测试剂盒由美国Sigema公司提供)分别测定血清及BALF中的TNF-α、IL-32含量,分别测定肺挫伤后血清及BALF中不同时段各组中TNF-α、IL-32浓度,以OD值为纵坐标,以标准品浓度作为横坐标,绘制标准曲线,根据样品的OD值可在标准曲线上查找各时相点样品浓度。
1.4 SP-A、B、C、D检测将收集的BALF样本在5 000 r/min速离心2 min后弃上清液,沉淀加入凝胶加样缓冲液后,置于美国Biorad公司垂直蛋白电泳仪跑带,以英国UVP公司凝胶图像分析系统照相及处理数据。
1.5 肺组织病理学检测将取得的肺组织标本经醋酸铀、硝酸铅双重染色后,置于投射电镜下观察肺泡组织的病理变化。
1.6 统计学方法用SPSS 16.0进行数据分析,计量资料以±s表示,多组比较采用单因素方差分析,两均数比较采用q检验,相关性分析采用两变量相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 电镜下急性肺挫伤后病理学检查电镜下急性肺挫伤后1 h挫伤部位肺泡细胞已有损害,肺泡及毛细血管充血水肿,肺组织内可见少许红细胞(图1);挫伤后4 h肺泡腔充血水肿加重,可见有白细胞及红细胞浸润至肺泡腔(图2);8 h后挫伤肺泡间质出血,肺泡细胞损伤进一步加重,可见细胞核缩小,细胞器溶解(图3);12 h后挫伤肺泡壁结构破坏严重,肺泡腔内出血严重,可见大量红细胞浸润,组织结构严重受损(图4)。
2.2 急性肺挫伤后血清及BALF中TNF-α和IL-32含量的变化急性肺挫伤后1 h后血清及BALF中TNF-α浓度开始升高,在3 h达到峰值,在4 h时出现明显下降后,4~12 h相对稳定在较高的表达水平直至试验结束,各时相与对照组比较(P<0.05),均有统计学差异。IL-32的表达同样在肺挫伤1 h后明显上升,在2 h后即可达到本实验中的高峰水平,3 h含量小幅度下降后,4~12 h均维持在较高水平直到试验结束,各时相与对照组比较(P<0.05),均有统计学差异。见表1,图5、6。
2.3 急性肺挫伤后BALF中SP-A、B、C、D与血清及BALF中TNF-α、IL-32水平相关性分析BALF
中SP-A与TNF-α含量水平呈负相关(r=-0.122,P=0.03),SP-B、C、D与TNF-α含量水平均无显著相关性;BALF中SP-A、D与IL-32含量水平呈负相关(r=-0.192,P=0.01;r=-0.077,P=0.01),SPB、C与IL-32含量水平均无显著相关性;血清中TNF-α与IL-32呈正相关(r=1.163,P=0.01)。
2.4 急性肺挫伤后BALF中SP-A、B、C、D含量的变化SP-A、B、C、D含量在1~4 h中呈快速下降趋势,在4~12 h相对稳定在较低的水平,各时相点与对照组相比(P<0.05),整体SP-A较SP-C、B、D下降明显(P<0.05)。其中SP-A在挫伤后1 h下降幅度最大,在8 h下降幅度达到最低点,SP-B、C、D肺挫伤后整体呈持续缓慢下降,在4 h下降幅度达到最低,4~12 h维持在较低水平(表1)。各时相点之间比较,均有统计学差异。
3 讨论
PS与呼吸系统的各类疾病的发展均有密切联系,其中最重要的急性肺损伤导致的呼吸窘迫综合征中地位尤为突出。PS可以通过调节炎症细胞产生的细胞因子,以减轻局部炎症反应和全身毒性的作用,同时降低肺表面张力,稳定肺泡结构的稳定,维持通气/血流比例及肺功能,是一种很有前途的肺损伤的生物标志物[3]。
表1 肺挫伤后BALF中SP-A、B、C、D(ng/mL)、TNF-α(pg/mL)及IL-32(pg/mL)含量变化Tab.1 Content of SP-A,B,C,D and content of TNF-α,IL-32 in BALF after acute pulmonary contusion ±s

表1 肺挫伤后BALF中SP-A、B、C、D(ng/mL)、TNF-α(pg/mL)及IL-32(pg/mL)含量变化Tab.1 Content of SP-A,B,C,D and content of TNF-α,IL-32 in BALF after acute pulmonary contusion ±s
注:与对照组比较,*P<0.05
指标 组别时间SP-A SP-B SP-C SP-D TNF-α IL-32对照组肺挫伤组对照组肺挫伤组对照组肺挫伤组对照组肺挫伤组对照组肺挫伤组对照组肺挫伤组1 h 74.60±2.53 32.51±3.86*14.83±1.24 5.29±0.58*10.89±1.37 5.03±1.02*39.25±1.98 28.64±1.44*84.31±13.77 97.31±21.07*67.34±16.11 107.34±21.45*2 h 74.60±2.53 14.12±2.48*14.83±1.24 3.03±0.78*10.89±1.37 1.98±0.84*39.25±1.98 13.02±1.01*84.31±13.77 247.62±61.21*67.34±16.11 346.28±67.12*3 h 74.60±2.53 7.96±1.39*14.83±1.24 1.58±0.54*10.89±1.37 1.43±0.21*39.25±1.98 6.46±0.45*84.31±13.77 291.74±59.63*67.34±16.11 316.22±77.21*4 h 74.60±2.53 8.15±1.11*14.83±1.24 0.77±0.11*10.89±1.37 0.97±0.23*39.25±1.98 1.36±0.19*84.31±13.77 114.99±31.05*67.34±16.11 243.11±31.59*8 h 74.60±2.53 6.47±0.97*14.83±1.24 0.71±0.21*10.89±1.37 0.88±0.17*39.25±1.98 1.77±0.27*84.31±13.77 126.33±24.47*67.34±16.11 224.77±46.57*12 h 74.60±2.53 10.21±1.75*14.83±1.24 0.97±0.19*10.89±1.37 1.04±0.19*39.25±1.98 1.59±0.21*84.31±13.77 151.26±37.21*67.34±16.11 267.55±44.79*

图1 电镜下肺挫伤后1 h肺泡变化,醋酸铀、硝酸铅双重染色(× 6 000)Fig.1 Alveolar changes at 1 h after lung contusion under electron microscopy,dual staining of uranium acetate and lead nitrate(× 6 000)
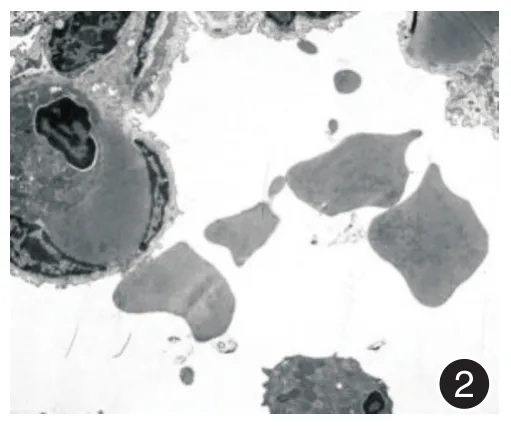
图2 电镜下肺挫伤后4 h肺泡变化,醋酸铀、硝酸铅双重染色(× 4 000)Fig.2 Alveolar changes at 4 h after lung contusion under electron microscopy,dual staining of uranium acetate and lead nitrate(× 4 000)

图3 电镜下肺挫伤后8 h肺泡变化,醋酸铀、硝酸铅双重染色(× 6 000)Fig.3 Alveolar changes at 8 h after lung contusion under electron microscopy,dual staining of uranium acetate and lead nitrate(× 6 000)

图4 电镜下肺挫伤后12 h肺泡变化,醋酸铀、硝酸铅双重染色(× 4 000)Fig.4 Alveolar changes at 12 h after lung contusion under electron microscopy,dual staining of uranium acetate and lead nitrate(× 4 000)

图5 肺挫伤后血清中TNF-α含量Fig.5 Content of TNF-α in serum after acute pulmonary contusion
TNF不仅具有强大的抗肿瘤作用,也在调节炎症反应、组织损伤与修复、诱导细胞凋亡等过程中有着重要作用[4]。有研究[5]表明,IL-32在炎症反应中可参与并诱导多种细胞因子如TNF-α、IL-6等产生,在早期炎症反应中具有重要的地位。

图6 肺挫伤后血清IL-32含量Fig.6 Content of IL-32 in serum after acute pulmonary contusion
实验通过建立早期兔肺挫伤模型,测定肺挫伤后1、2、3、4、8、12 h BALF中SP-A、B、C、D与血清及BALF中炎症因子TNF-α、IL-32的变化趋势及相关性。实验中1~4 h时:血清及BALF中TNF-α在2~3 h时快速上升至峰值,其原因为毛细血管和肺内皮的损伤,导致大量中性粒细胞附着在并迁移到间质和肺泡空间产生TNF-α等,而TNF-α又可激活选择素、细胞黏附分子及血管粘附因子等炎性信号分子,使其在局部和全身水平上启动、传导和扩大炎症反应的进程,并再次以正反馈的形式诱导中性粒细胞脱颗粒,形成免疫炎症的瀑布反应[6-7]。而IL-32在肺挫伤后2 h即可达到本次实验峰值,可能因为IL-32为是一种前炎症细胞因子[8],在炎症最初期即可大量产生,并诱导后续各种相关细胞因子的产生和释放,在实验中比TNF-α水平更早达到峰值。肺挫伤后1~4 h时BALF中所有SP蛋白含量均呈下降趋势,其中以SP-A、D下降最为显著。可能原因分为两种:一种为肺挫伤时,挫伤组织PS的合成速率降低,在剩余的未受伤的肺泡Ⅱ型上皮细胞中,PS合成的速率得到保护,甚至可以上升,但总的PS的生产减少了,这可能是与总体功能性的肺泡II型上皮细胞的数量减少有关[9];另一种为大量炎症TNF-α的释放,可在肺挫伤各个时段诱导肺泡II型上皮细胞凋亡,并且有研究表明,在肺挫伤早期随着炎症因子的逐渐增多,致使炎症因子与抗炎因子平衡失调,高浓度的炎症因子对SP-A mRNA有明显的抑制作用[10]。此时在电镜下显示1 h时肺挫伤部位充血,肺泡内可见红细胞,此时肺组织炎症反应较轻,4 h时肺泡腔充血水肿加重,可见大量白细胞浸润。
另一方面,实验4~12 h时:SP在4 h后整体下降趋势减缓,趋向于一个稳定的低水平表达状态,此时血清及BALF中TNF-α、IL-32在3~ 4 h开始下降,4~12 h降至并稳定在较高水平。造成这一现象的原因可能为:肺表面活性物质蛋白(SP)在肺损伤的修复作用中占有重要地位,可抑制NF-κB因子的激活,同时激活JAK/STAT等通路,共同抑制炎症反应的加重[11],从而使TNF-α无法持续升高。而IL-32对肺部炎症反应发生发展有重要促进作用[12],SP对各种肺部炎症反应均有抑制和保护作用,可以认为SP对IL-32有一定抑制作用,这也与实验中SPI与L-32含量水平呈负相关结论相符。而其中SP的代谢至少需要3~11 h[13],这也解释了实验结果BALF中SP含量在4 h下降幅度明显减缓,TNF-α、IL-32从早期高表达状态进去一个相对较高的稳定趋势。但4h SP含量仍然呈表达低水平,TNF-α、IL-32也维持在较高的水平,表示炎症反应仍占主导作用,与电镜下肺实质细胞继续损伤相符合。
本文研究在急性肺挫伤早期BALF中SP-A、B、C、D与炎症因子TNF-α、IL-32的动态变化关系及相关性,结果显示肺挫伤开始后1h,SP-A、B、C、D均开始下降并在4 h后维持在较低水平至实验结束,TNF-α、IL-32早期升高后下降至相对稳定的高水平表达状态,与肺组织病理变化关系密切。本实验中急性肺挫伤早期BALF中SP-A与TNF-α浓度水平联系密切且呈负相关性,SP-A、D与IL-32含量水平呈负相关,血清中TNF-α与IL-32呈正相关,由此可推断SP蛋白在肺挫伤早期可对炎症因子TNF-α、IL-32的表达产生负调控作用。但肺挫伤后炎症的形成与对抗的机制为复杂多样化的,SP蛋白对IL-32、TNF-α的抑制机制有待进一步研究。
