鲍曼不动杆菌RND主动外排泵的表达与耐药性的关系
2018-11-02李剑平吴秀珍胡雪飞陈开森
陈 娇,刘 康,李剑平,吴秀珍,胡雪飞,陈开森,陈 贺
(1 江西卫生职业学院,江西 南昌 330052; 2 南昌大学第一附属医院,江西 南昌 330006; 3 南昌大学第二附属医院,江西 南昌 330006)
鲍曼不动杆菌(Acinetobacterbaumannii,AB)是医院感染的常见病原菌之一,广泛分布在医院环境中,可引起严重的肺炎、尿路感染、血流感染等多种医院感染,特别易引起免疫力低下重症患者的感染[1-3]。AB对多种抗菌药物表现出耐药,使其成为最具有挑战性的病原菌之一,Xie等[4]报道,在过去的16年(2006—2016年)经合组织国家AB的耐药性在快速增长;AB由于多重耐药,限制了抗感染治疗的选择,使疾病更为严重[5]。因此,AB感染已成为日益显著的公共健康问题[6]和全球医院感染的主要的威胁[7]。AB的耐药机制非常复杂,可由多种耐药机制介导,如外膜蛋白表达改变,造成抗菌药物通透障碍;拓扑异构酶和DNA旋转酶的改变;多种药物的外排泵过度表达;PBPs改变;β-内酰胺酶的产生等[8]。主动外排泵机制是AB出现耐药的主要机制之一,其可以将进入细菌内的药物排出,导致细菌内药物浓度降低,使抗菌药物不足以发挥抗菌作用而出现耐药。与AB耐药有关的外排系统主要有ATP结合盒式蛋白家族(ATP-binding cassette superfamily,ABC)、耐药结节分化家族(resistance-nodulation family,RND)、小多耐药家族(small multidrug resistance family,SMR)、多药与毒性化合物外排家族(multidrug and toxic compound extrusion family,MATE)和主要易化因子超家族(major facilitator superfamily,MFS),其中RND主动外排系统在革兰阴性菌中普遍存在,并且有大量的研究报道[9],AB的多重耐药与RND基因过度表达密切相关。本文将探讨AB中RND主动外排系统的分布情况,比较不同耐药表型的AB间外排泵基因的表达情况,从而阐述其与细菌耐药性的关系。
1 材料与方法
1.1 菌株来源 59株AB来自于南昌大学第一附属医院检验科临床送检的各种标本。ATCC 25922、ATCC 27853菌株由江西省临床检验中心吴茂红主任技师赠予,ATCC 19606菌株购自Microbiologics公司。

1.3 鲍曼不动杆菌DNA的制备 按照Omega公司细菌DNA提取试剂盒的操作步骤提取菌株DNA。
1.4 PCR扩增 PCR引物由上海Sangon合成。具体引物序列及引物长度见表1。

表1 普通PCR的基因引物序列及产物大小
1.5 DNA序列验证 所获基因的DNA序列均由上海Sangon测序后经NCBI GenBank Blast验证。
1.6 外排泵基因相对表达量的测定
1.6.1 试验菌株 从59株AB中挑取8株同时携带三种RND外排泵基因且耐药性具有一定差别的菌株作为试验菌株,对其进行外排泵基因的相对表达量的测定,8株AB试验菌株对抗菌药物的耐药结果见表2。
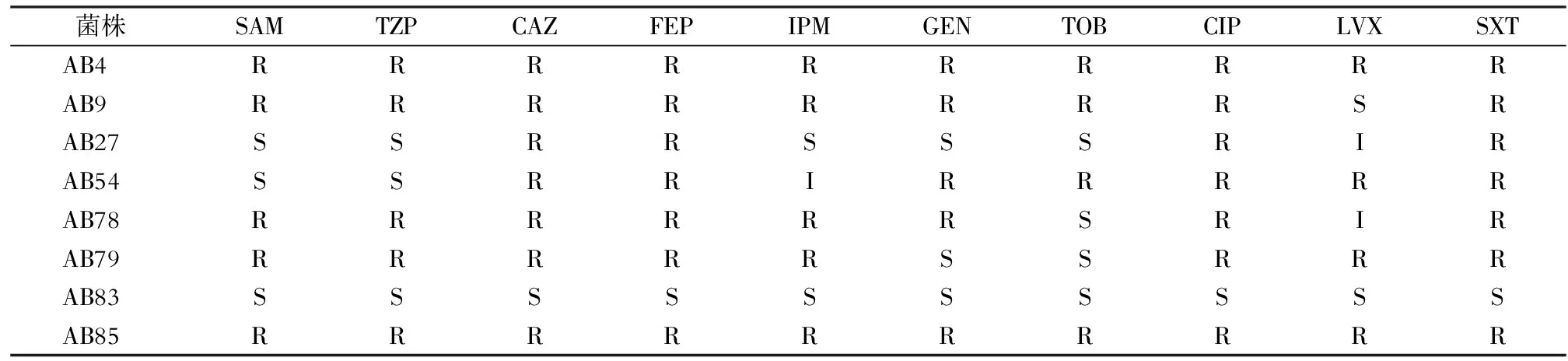
表2 8株AB试验菌株对临床常见抗菌药物的敏感结果
R:耐药;I:中介;S:敏感
1.6.2 总RNA提取 按照Omega公司细菌RNA提取试剂盒的操作步骤提取菌株RNA,使用核酸蛋白分析仪检测RNA的浓度,并取RNA进行电泳。
1.6.3 逆转录 (1)逆转录前需要去除残留DNA;(2)冰上配制反转录反应液:采用Transgen公司的cDNA合成试剂盒合成cDNA。
1.6.4 荧光定量PCR(RT-PCR)扩增外排泵系统相关基因 荧光定量PCR反应体系为20 μL,包括上、下游引物(引物序列见表3)各0.4 μL, cDNA模板2 μL, Mix 10 μL,Passive Reference 0.4 μL,用RNase-free H2O补足体积。扩增条件为三步法,第一步95℃ 30 s,1个循环;第二步95℃ 5 s,60℃ 30 s,40个循环。根据2-△△Ct的方法对数据进行处理,△Ct=Ct目的基因- Ct内参基因,△△Ct=△Ct耐药菌株-△Ct标准菌株。
表3荧光定量PCR的基因引物序列及产物大小
Table3 Gene primer sequences and product size of real-time PCR

基因引物序列(5’-3’)产物长度(bp)16SrRNA-FCAGCTCGTGTCGTGAGATGT15016SrRNA-RCGTAAGGGCCATGATGACTT qadeB-F ACAAGACCGCGCTAACTTAGGT67qadeB-R TGCCATTGCCATAAGTTCATCT qadeR-F CGCTCTAGTGCATCGCTATC313qadeR-R GCATTACGCATAGGTGCAGA qadeS-FTCGCAAAGCGTTTTATTGTG175qadeS-RGCATTTTTGACGGAAACCTC qadeJ-FGGTCATTAATATCTTTGGC222qadeJ-RGGTACGAATACCGCTGTCA qadeG-FTTCATCTAGCCAAGCAGAAG469qadeG-RGTGTAGTGCCACTGGTTACT
1.7 统计学处理 本实验中采用两独立样本t检验的方法进行统计分析(GraphPad Prism 5软件),当P≤0.5认为具有统计学意义。
2 结果
2.1 AB临床分布及耐药性 临床分离的59株AB主要来自于新生儿重症监护病房(NICU,15株,25.4%),其次来自于综合重症监护病房(ICU,11株,18.6%)、神经外科(10株,16.9%),有27.1%的AB来自于其他ICU(烧伤外科ICU及急诊ICU各5株,呼吸内科ICU 3株,心胸外科ICU 2株,神经内科ICU 1株)。74.6%(44株)的AB来自于痰,其次来自于血(5株,8.5%)。54.2%(32株)的AB对SAM、IPM、GEN、CIP、LVX均耐药,AB对常用抗菌药物的耐药情况见表4。
表459株AB对常用抗菌药物的耐药情况
Table4 Antimicrobial resistance of 59 strains of AB to commonly used antimicrobial agents
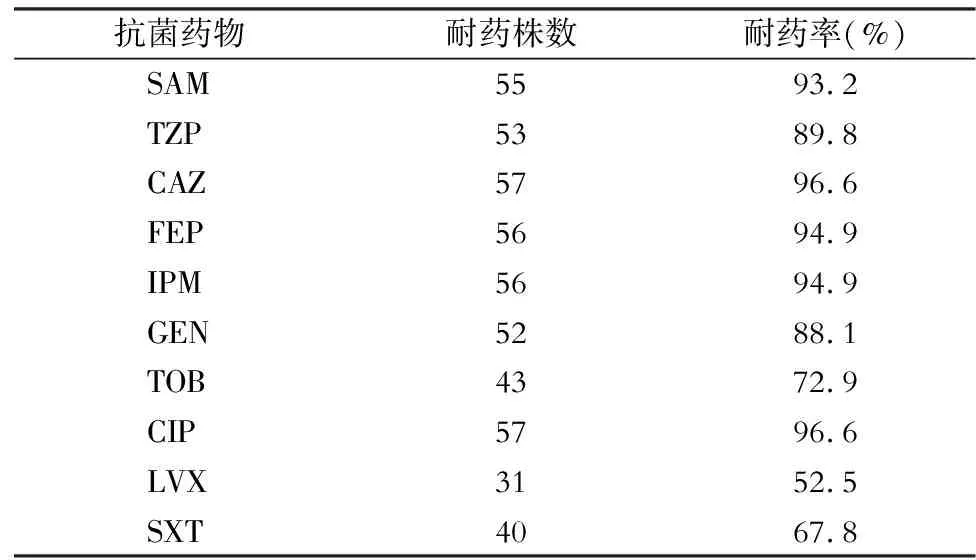
抗菌药物耐药株数耐药率(%)SAM55 93.2TZP53 89.8CAZ57 96.6FEP56 94.9IPM56 94.9GEN52 88.1TOB43 72.9CIP57 96.6LVX31 52.5SXT40 67.8
2.2 AB主动外排泵基因及整合子的检测结果 59株AB经外排泵及整合子基因PCR扩增检测,48株(81.4%)携带adeR,54株(91.5%)携带adeS,55株(93.2%)携带adeB,59株(100%)携带adeJ,36株(61.0%)携带adeG。AB菌株外排泵基因PCR扩增电泳结果见图1。
2.3adeR及adeS基因测序结果 对adeABC外排泵的调控基因adeR和adeS的碱基序列进行比对分析,AB试验菌株与标准菌株19606的基因序列一致性达100%,未出现基因突变或插入序列。AB试验菌株adeR、adeS基因PCR产物部分测序结果见图2-3。

注:1泳道为Marker;2—6泳道分别为AB菌株adeR、adeS、adeB、adeJ、adeG基因阳性标本
图1AB菌株外排泵基因PCR扩增产物电泳图
Figure1 Electrophoresis map of PCR amplified product of efflux pump genes of AB strains
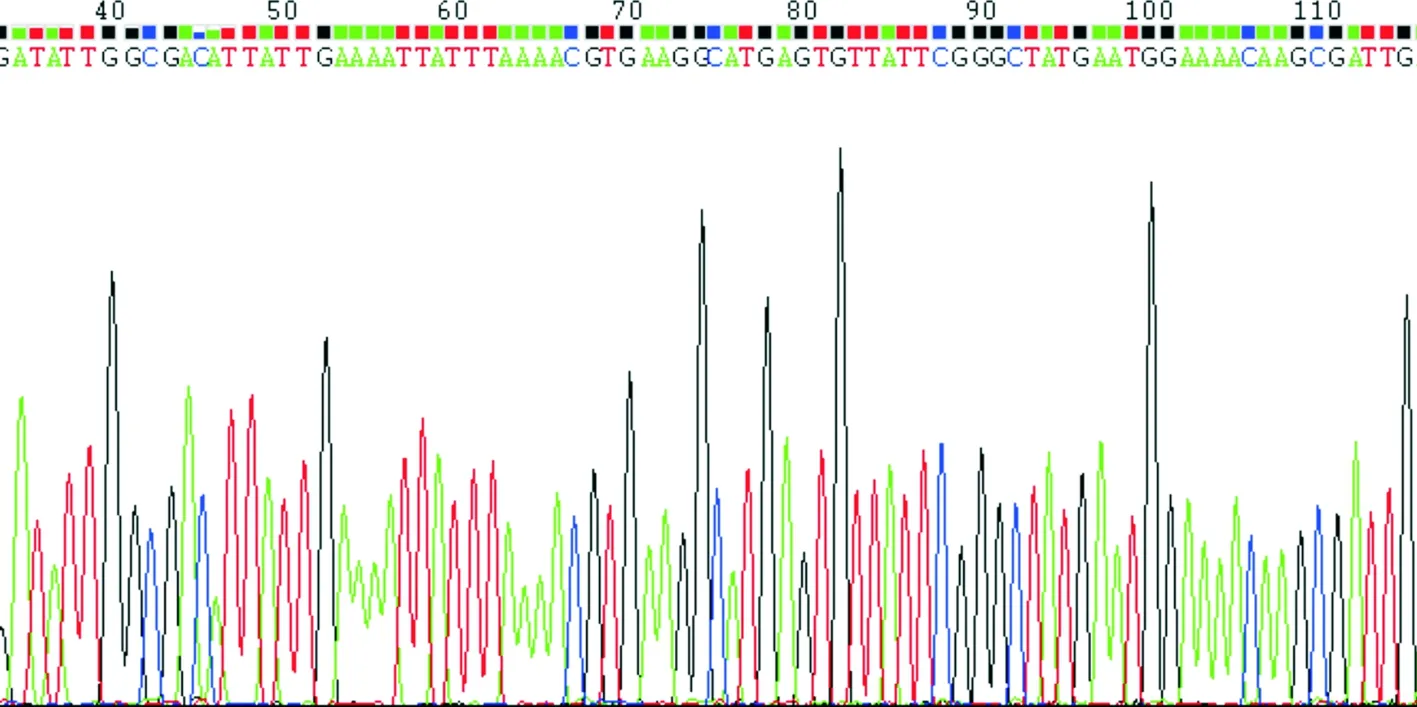
图2 AB试验菌株adeR基因PCR产物部分测序结果

图3 AB试验菌株adeS基因PCR产物部分测序结果
2.4 主动外排系统相关基因的表达水平 采用荧光定量PCR对AB试验菌株及标准菌株19606进行主动外排系统相关基因表达水平的检测,结果见表5。
2.5 主动外排泵基因的表达与细菌耐药性的关系 按细菌对抗菌药物的耐药性将AB分为耐药组及非耐药组,采用两独立样本t检验的方法进行统计分析,GEN、IPM、SAM耐药组与非耐药组adeB、adeJ基因的表达量相比,差异具有统计学意义(P<0.05)。见图4。
表5AB试验菌株主动外排泵基因的相对表达量
Table5 Relative expression of efflux pump genes in tested AB strains

菌株adeSadeRadeBadeJadeG196061.00 1.00 1.00 1.00 1.00 AB42.344.2210.737.241.25AB92.672.1914.91 8.71 1.34 AB272.171.912.242.281.56AB542.142.253.783.351.67AB783.232.677.67 5.34 1.57 AB792.211.893.233.452.01AB831.071.671.571.541.12AB853.544.579.565.682.35

注:R为耐药组,S为敏感组
3 讨论
在不动杆菌属中,AB是引起医院感染最重要的病原菌之一[10],也是引起与机械通气相关肺炎的最常见细菌之一[11],一旦扩散,极易造成暴发流行。本研究中71.2%的AB菌株来源于ICU,74.6%的AB菌株来源于痰标本。由于抗菌药物的不合理使用及医院感染管理控制措施的缺失或执行不到位,使得细菌的耐药性呈不断上升趋势,多重耐药AB(multidrug-resistantAcinetobacterbaumannii,MDR-AB)已成为医院感染的主要病原菌[7],并在全球播散。本文探讨的主动外排系统机制是AB主要耐药机制之一,科学家们通过利用外排泵抑制剂,如羰基氰氯苯腙等作用于MDR-AB,从而改变AB的耐药表型来证明主动外排系统在MDR-AB中的作用,本文则通过AB不同的耐药表型与外排泵基因的不同表达,探索AB耐药性与主动外排系统之间的复杂关系。
RND家族是不动杆菌属细菌最主要也是最早发现的外排泵系统,由于其外排底物的广泛性,外排泵的过度表达可使更多的抗菌药物被排出菌体外,从而引起多重耐药。RDN外排泵一般由膜融合蛋白(MFP)、RND转运蛋白、外膜蛋白(OMF)三部分组成,其中MFP使细菌内外膜结合紧密,使结构稳定;RND转运蛋白具有识别药物并将其主动转出细胞膜的功能;OMF位于细胞外膜,具有孔道蛋白的作用,使药物排出菌体[9]。此三种蛋白通常由操纵子编码,其中RND转运蛋白的特征决定了底物的广泛性,常作为流行病学的检测指标。在AB中已发现与多重耐药相关的RND外排系统主要有adeABC、 adeIJK、adeFGH、adeDE、adeXYZ,其中对AdeDE、AdeXYZ研究较少,其表达及调控机制还未见报道。目前少有AB外排泵基因流行情况的报道,本文通过检测RND转运蛋白adeB、adeJ、adeG外排泵基因,分析adeABC、 adeIJK、adeFGH外排泵在AB中的存在情况,研究发现55株(93.2%)AB携带adeB基因,59株(100%)AB携带adeJ,36株(61.0%)AB携带adeG,可见RND外排系统在AB中普遍存在。López等[12]报道,RND主动外排系统在病原菌毒力因子的调节、排除细胞内代谢产物、调节细胞动态平衡和细胞间信号转导等方面均有一定的作用,此或许是RND在细菌中普遍存在的原因。
为更好地揭示AB耐药性与RND外排泵基因表达之间的关系,本研究从试验菌株中挑选了耐药表型不同的AB,检测其不同外排泵基因的表达。从荧光定量PCR的结果分析来看,AB耐药机制非常复杂,主动外排系统仅起到了部分作用,对一种抗菌药物耐药可与多种外排泵基因有关,但一种主动外排系统同时可以导致AB对多种抗菌药物出现MIC值升高或耐药。在本研究中经过统计学分析发现,GEN、IPM、SAM耐药组与非耐药组ABadeB、adeJ基因的表达量相比,差异具有统计学意义(P<0.05),且耐药组均表现为多重耐药,其他抗菌药物耐药组及非耐药组RND外排泵基因的表达未发现有统计学意义。Chang等[13]报道,adeABC外排泵的过度表达与氨基糖苷类、四环素类、氟喹诺酮类、替加环素等抗菌药物的耐药性有关,而AB对氨基糖苷类耐药与adeABC或abeM(MATE)有关,对氟喹诺酮类耐药与adeABC、adeIJK、adeFGH、abeS(SMR)、abeM(MATE)有关,对β-内酰胺类抗生素耐药与adeABC、adeIJK有关[14]。
RND外排泵中adeABC是由位于adeB基因上游的adeR与adeS基因分别编码的反应调节蛋白adeR和感应激酶adeS这两种蛋白组成调控系统控制的[15]。研究[16]表明,adeRS的变异与adeABC的过度表达和耐药性有关。本研究中adeABC外排泵的调控基因adeR和adeS的碱基序列与标准菌株19606的基因序列一致性达100%,未出现基因突变或插入序列。可见本研究中的AB菌株adeABC外排泵的表达升高并不是由其调控基因adeR、adeS的基因突变或插入序列引起,可能存在其他机制。
总之,AB的耐药机制非常复杂,其中RND外排系统在MDR-AB中普遍存在,RND外排系统中adeB和adeJ基因的表达水平升高与细菌对GEN、IPM、SAM的耐药性有关,adeABC外排泵的调控系统adeR、adeS基因未见突变或插入序列,其表达升高可能存在其他机制。
