利用味精废水培养枯草芽孢杆菌产γ-聚谷氨酸及初步表征
2018-11-01张彦丽
张彦丽
山东行政学院,山东 济南 250014
味精废水是生产味精时由谷氨酸发酵液提取谷氨酸后产生的废液,以及生产过程中的洗涤废水。它是一种高浓度有机废水,具有酸性强、高COD、高 BOD、高硫酸根、高菌体含量和低温等特点,处理难度很大,处理成本较高。味精废水的治理已经成为制约味精生产企业发展的重大难题(于信令,1995;喻轶等,2017)。味精废水中含有大量的 L-谷氨酸、还原糖与氨氮,如果任其排放不仅会造成严重的环境污染,而且浪费了宝贵资源。
γ-聚谷氨酸(γ-polyglutamic acid;γ-PGA)是一种通过微生物合成的均聚氨基酸化合物,具有生物可降解性、生物相容性、可食用、对人体和环境无毒害等优点。因此,γ-聚谷氨酸被广泛应用于药物工业、食品工业、化妆品工业、生物材料及污水处理中,是一种应用前景广泛的高分子材料(Shih et al.,2001;王卫国等,2016;彭伟等,2017)。γ-PGA的生产方法包括:化学合成法、酶转化法、提取法和微生物发酵法(孙先林等,2012)。自1942年Bovarnick(1942)发现芽孢杆菌能够在培养基中积累γ-PGA以来,对于利用微生物法合成γ-PGA的研究就十分活跃。γ-PGA生产菌株主要是芽孢杆菌属(张宸,2018),包括枯草芽孢杆菌(B.subtilis)(Goto et al.,1992;Kubotah et al.,1993;Ogawa et al.,1997;Yoshihito et al.,1996)、炭疽芽孢杆菌(B. anthracis)、地衣芽孢杆菌(B. licheniformis)(Cromwick et al.,1995)和解淀粉芽孢杆菌(B. anmloliquefaciens)(邵丽等,2007)。与化学合成法、酶转化法和提取法相比,微生物发酵法生产γ-PGA具有培养条件温和、生产过程容易控制、γ-PGA分子量适宜、提取率高、环境友好等优点,已经成为国内外学者和专家关注和研究的热点,是当前具有工业化前景的γ-PGA生产方法,但由于微生物的γ-PGA合成代谢途径较为复杂,培养周期较长,以标准培养基通过微生物法合成 γ-聚谷氨酸成本较高,制约了其大规模生产和工业化应用。
本研究从降低γ-聚谷氨酸生产成本和实现味精废水综合利用的角度出发,以味精废水为发酵培养基,培养枯草芽孢杆菌合成γ-聚谷氨酸,考察味精废水浓度、发酵培养初始 pH、枯草芽孢杆菌接种量和发酵培养时间对菌体生长和 γ-PGA产量的影响;以提高γ-PGA产量为目标,采用响应面法中的Box-Behnken模型设计实验,拟合二次回归模型,优化培养条件;测定粗产品中γ-PGA的含量,通过紫外光谱、红外光谱、核磁共振对发酵合成的γ-PGA粗品进行分析表征。
1 材料与方法
1.1 实验材料
味精废水取自山东省某味精生产企业,为高浓度的谷氨酸发酵废液,废水水质指标参照《水与废水分析监测方法》(第4版)测定,结果如表1所示。实验试剂有常用的水质分析化学试剂、生化试剂和茚三酮、谷氨酸标准品、甲醇、氯仿(三氯甲烷)等。

表1 味精废水水质特征Table1 Characteristics of the monosodium glutamate wastewater
1.2 菌种活化及种子培养
本实验所用菌种为枯草芽孢杆菌(Bacillus subtilis-168),山东大学环境学院微生物实验室冷冻保藏(-70 ℃),由山东大学环境科学与工程学院李力教授惠赠。冷冻的枯草芽孢杆菌从-70 ℃依次转移至-20 ℃、4 ℃进行活化,平板划线后置于37 ℃培养箱中培养24 h。平板培养基为LB固体培养基。
种子培养基为LB液体培养基。从平板上取1~2环枯草牙孢杆菌接入种子培养基中,250 mL三角瓶的装液量为30 mL,在37 ℃、180 r·min-1条件下培养12 h。所有培养基均经湿热高压灭菌后使用,灭菌条件:121 ℃,0.1 MPa,20 min。
1.3 以味精废水为培养基摇瓶发酵培养
将微生物种子液按 3%~16%(V/V)的接种量接入1~10倍稀释的味精废水发酵培养基中,300 mL三角瓶中味精废水的装液量为50 mL,在37 ℃、180 r·min-1的条件下培养一定时间。
1.4 生物量的测定
发酵菌悬液的生物量可用其在特定波长处的吸光度(OD)来表示。将发酵液稀释后用紫外-可见分光光度计(PGENERAL TU1810,China)于660 nm读取菌悬液的OD660nm。
取 20 mL发酵液于已预先称重的干燥离心管中,10000 r·min-1离心 10 min,上清液用于γ-PGA的分离提纯,菌体用超纯水洗涤3次,于80 ℃烘箱中烘至恒重,总质量减去空管质量即为菌体净干重(Shi et al.,2006)。
1.5 γ-PGA的分离提取
将发酵液进行高速离心(10000 r·min-1,10 min)除菌,取2 mL上清液于预先称重离心管(10 mL)中,加入8 mL无水乙醇沉淀出产物,将含产物的离心管反复烘干至恒质量,减去离心管的质量即得到粗产品干质量(g·L-1)。
1.6 γ-PGA含量的测定
在一定的pH条件下氨基酸与茚三酮共热可生成蓝紫色化合物,其颜色的深浅与氨基酸含量有关,可用于比色定量,因此可采用茚三酮比色法来测定谷氨酸的含量(Wang et al.,2005)。
1.7 γ-PGA的紫外光谱、红外光谱和核磁共振表征
用紫外-可见分光光度计(PGENERAL TU1810,China)在190~600 nm范围内扫描经去离子水溶解的γ-PGA粗产品溶液。
由乙醇沉淀法提取得到的微生物絮凝剂γ-PGA经干燥处理后,进行傅立叶红外光谱和核磁共振分析。将2 mg微生物絮凝剂样品与200 mg纯KBr研细混匀,置于模具中,压成透明薄片(样品和KBr都要进行干燥处理,且研磨粒度须小于2 µm,以避免散射光的影响)。用红外光谱仪(Nicolet Avatar 370,US)在室温下对样品进行红外光谱测定,并设定分辨率为2 cm-1,扫描范围为4000~400 cm-1。采用核磁共振波谱仪(Bruker Av-300,Switzerland)分析γ-PGA的结构,以D2O为溶剂溶解样品,在测定温度为300 K、脉冲宽度为13.8 μs、延迟时间为2 s和扫描次数为8的条件下采集试样氢谱。
2 结果与讨论
2.1 发酵培养单因素实验
微生物在培养基中的生长情况与培养基组成、发酵培养条件密切相关。目前有关在标准培养基中培养枯草芽孢杆菌生产 γ-PGA的培养条件研究较为成熟,一般控制温度为 37 ℃,摇瓶转速为 180 r·min-1时有利于枯草芽孢杆菌的生长和 γ-PGA 产量的提高。以味精废水代替标准培养基培养枯草芽孢杆菌 168,采用单因素控制实验重点研究味精废水浓度、培养初始 pH、接种量和培养时间对枯草芽孢杆菌生长和γ-PGA产量(以粗产品干重表示)的影响。在研究其中一个因素对枯草芽孢杆菌的生长和γ-PGA产量的影响时,其他3个因素的条件参考正交预实验结果确定。
2.1.1 味精废水浓度对枯草芽孢杆菌生长及γ-PGA产量的影响
实验中固定味精废水初始 pH为 6.0,接种量10 mL,在 37 ℃、180 r·min-1条件下发酵培养 48 h,将味精废水稀释至一定倍数,通过单因素控制实验考察稀释倍数(1-不稀释、2、4、6、8、10)对枯草芽孢杆菌生长情况(以生物量和上清液特征吸光度表示)和γ-PGA产量的影响,实验结果如图1(a)所示。
味精废水的浓度对枯草芽孢杆菌的生长和γ-PGA的产量均有较大影响。在低浓度的味精废水中,营养物质浓度不足是影响枯草芽孢杆菌生长和γ-PGA产量的主要因素;但是味精废水的浓度过高(原水经不稀释)时,较高的SO42-浓度会抑制微生物的生长(Wang et al.,2004),不利于γ-PGA的生物合成。在废水处理的厌氧消化系统中,当 SO42-浓度为4000 mg·L-1时,会对厌氧系统产生严重的抑制作用(Wang et al.,1995)。本实验中,味精废水的SO42-浓度为15.26 g·L-1(表1),实验结果表明,在好氧发酵的情况下,如果不经稀释,SO42-对枯草芽孢杆菌生长和 γ-PGA产量产生较大抑制作用。当味精废水稀释2倍时,发酵液的生物量达到最高值,但是γ-PGA的产量却未达到最高值,而是在4倍稀释的味精废水中(SO42-浓度低于4000 mg·L-1)γ-PGA具有最高产量,显示了γ-PGA的合成与枯草芽孢杆菌的生长不同步,在较高的生物量情况下并未对应最高的 γ-PGA产量,说明过高的SO42-浓度对γ-PGA合成过程抑制作用较强。
2.1.2 味精废水初始pH对枯草芽孢杆菌生长及γ-PGA产量的影响
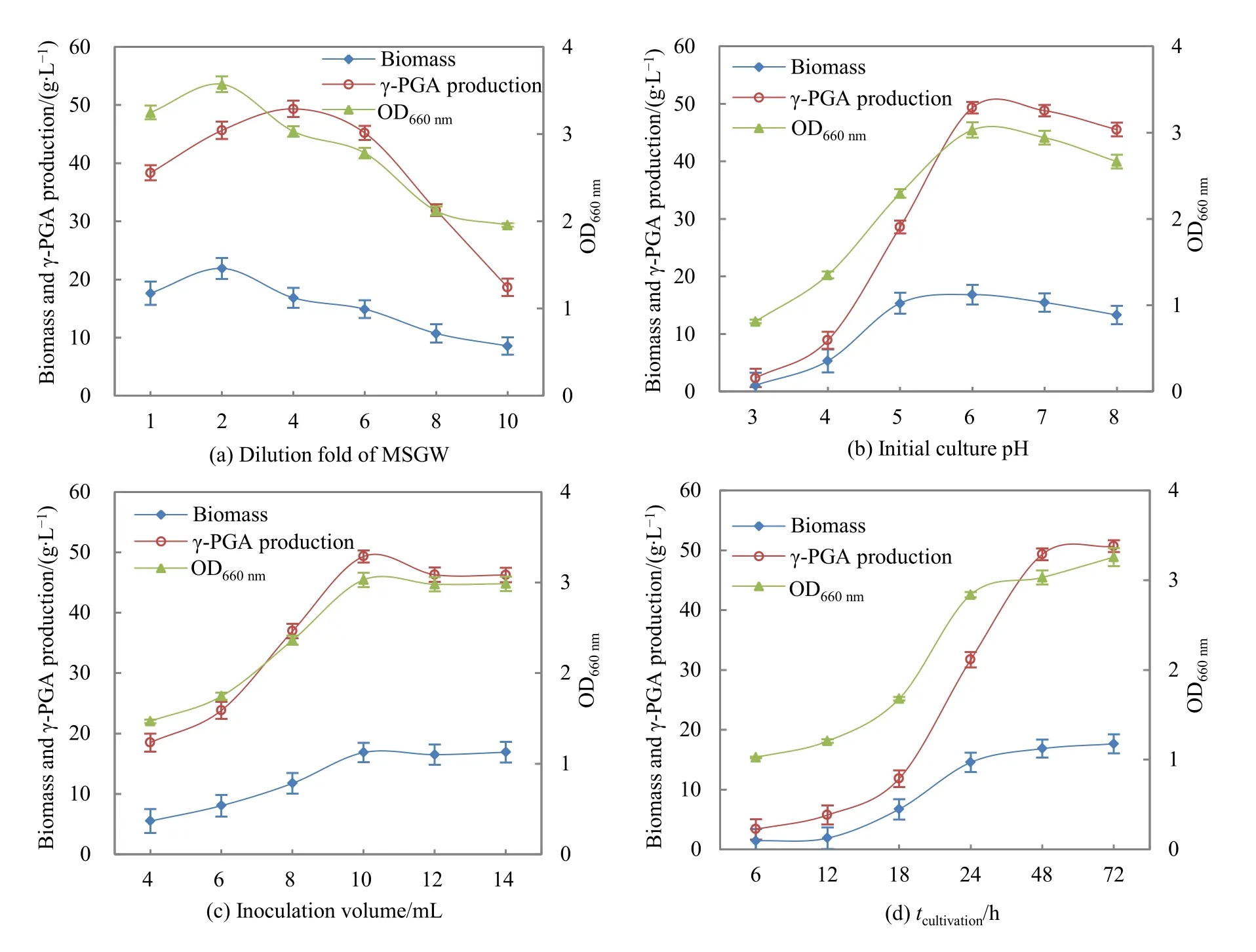
图1 (a)味精废水浓度、(b)培养基初始pH、(c)接种量、(d)培养时间对发酵液生物量Biomass、上清液特征吸光度OD660 nm和γ-PGA产量的影响Fig. 1 Effects of (a) initial MSGW concentration, (b) initial culture pH, (c) inoculation concentration, (d) cultivation time on biomass, OD 660 nm,and γ-PGA production
调节味精废水(4倍稀释)初始的pH值分别为3.0~8.0,接种10 mL枯草芽孢杆菌,在37 ℃、180 r·min-1条件下发酵培养48 h,以考察pH值对枯草芽孢杆菌生长和γ-PGA产量的影响,实验结果如图1(b)所示。培养基初始pH对微生物的生长和γ-PGA的生物合成具有很大的影响,过低和过高的初始pH均不利于枯草芽孢杆菌的生长和γ-PGA的积累。此外,在枯草芽孢杆菌的发酵培养过程中,pH是逐渐升高的,以初始pH=6.0为例,在开始培养6、24和48 h后,发酵液的pH分别为6.3、7.2和7.9。所以,相对较低的初始pH(pH=6)有利于枯草芽孢杆菌的生长和γ-PGA的合成。
2.1.3 接种量对枯草芽孢杆菌生长及γ-PGA产量的影响
考虑到采用高浓度的味精废水作为培养基,本着工艺简单、高效利用味精废水的原则,实验设计中枯草芽孢杆菌接种量取较高水平 4~14 mL,即7%~21%(V/V)。其他培养条件为:味精废水 4倍稀释,培养初始pH=6,在37 ℃、180 r·min-1条件下发酵培养48 h,实验结果如图1(c)所示。由图可知,当枯草芽孢杆菌接种量为4~10 mL时,发酵液生物量和上清液特征吸光度OD660nm均随接种量的增加而增大,当接种量大于10 mL时趋于稳定。而γ-PGA产量随着接种量的增加先增大(接种量4~10 mL)而后出现下降趋势(10~14 mL),并在接种量为 10 mL 时达到最大值(49.33±1.21) g·L-1。
在低接种量的情况下,味精废水培养基中营养丰富,导致枯草芽孢杆菌菌体迅猛生长,影响到γ-PGA的合成、积累。而当接种量过高时,又会导致培养基中的营养相对不足,枯草芽孢杆菌菌体生长消耗较多营养,发酵培养后期菌体处于饥饿状态,从而也影响到γ-PGA的合成与积累。所以,就4倍稀释味精废水而言,适度的接种量(10 mL)有利于菌体生长和γ-PGA的积累。
2.1.4 培养时间对枯草芽孢杆菌生长及γ-PGA产量的影响
微生物的生长和γ-PGA的产量还受到培养时间的影响,调节4倍稀释味精废水的初始pH为6.0,接种量为10 mL,在37 ℃、180 r·min-1条件下发酵培养72 h,绘制枯草芽孢杆菌的发酵进程曲线(图1(d)),以确定最佳发酵培养时间。
由图1(d)可知,培养时间-γ-PGA的产量曲线可分为以下3个阶段:第1阶段为0~18 h,γ-PGA的产量随时间的延长而缓慢增加,这是由于发酵培养初期微生物需要一段时间适应、菌体增殖。第2阶段为 18~48 h,此时发酵液中已生长增殖了一定量的菌体,γ-PGA的产量随时间的延长而大幅增加,为快速增长阶段。第3阶段为48~72 h,此时,γ-PGA产量随时间的延长不再明显增长,曲线趋于平缓。而发酵液生物量和上清液特征吸光度OD660nm的时间曲线的变化趋势与γ-PGA产量的时间曲线相似,只是快速增长阶段有所提前(12~24 h)。显然,当以提高γ-PGA产量为目标时,48 h是利用味精废水培养枯草芽孢杆菌产γ-PGA的适当培养时间。
2.2 响应面法优化培养条件
响应面法(Response Surface Methodology,RSM)是解决多变量问题的一种统计方法(谢丽丹等,2017)。本实验采用 Box-Behnken响应面设计对培养条件进行优化。根据Box-Behnken设计原理(Box et al.,1960),用 Design-Expert 8.0.6软件设计试验,对结果进行分析,建立二次回归方程,并预测、验证枯草芽孢杆菌168菌株产γ-PGA的最佳培养条件。
2.2.1 Box-Behnken 实验设计及结果
根据单因素实验结果,以最大产量区进行Box-Behnken设计,以味精废水稀释倍数、培养基初始pH和接种量3个因素为自变量,γ-PGA产率为响应值,三因素三水平的响应面设计和实验结果如表2、表3所示。
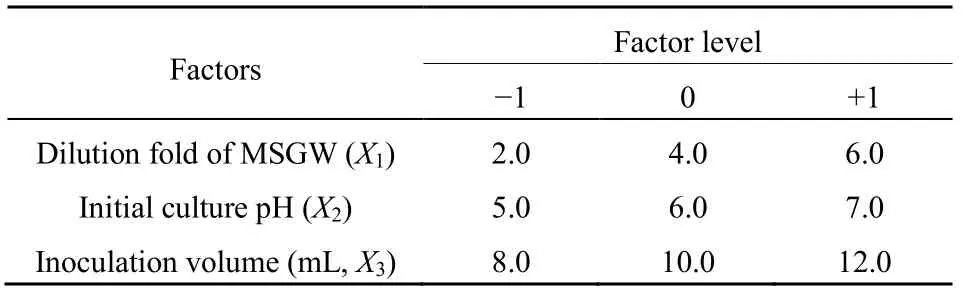
表2 Box-Behnken设计中的因子与水平Table 2 Factors and level in BBD

表3 Box-Behnken试验设计与结果Table 3 Experimental design and results of BBD
2.2.2 二次回归模型拟合及方差分析
用Design-Expert 8.0.6软件对15个实验点的响应值进行回归分析和方差分析,结果如表 4、表 5所示。分别以A、B、C表示味精废水稀释倍数、培养基初始 pH和接种量。拟合得到 γ-PGA产量 P(g·L-1)的回归方程为:P=49.45+0.14X1-0.47X2+3.37X3+2.14X1X2-0.41X1X3-0.86X2X3-4.29X12-3.95X22-2.28X32。

表4 回归模型及系数估计Table 4 Regression model and the coefficient estimates
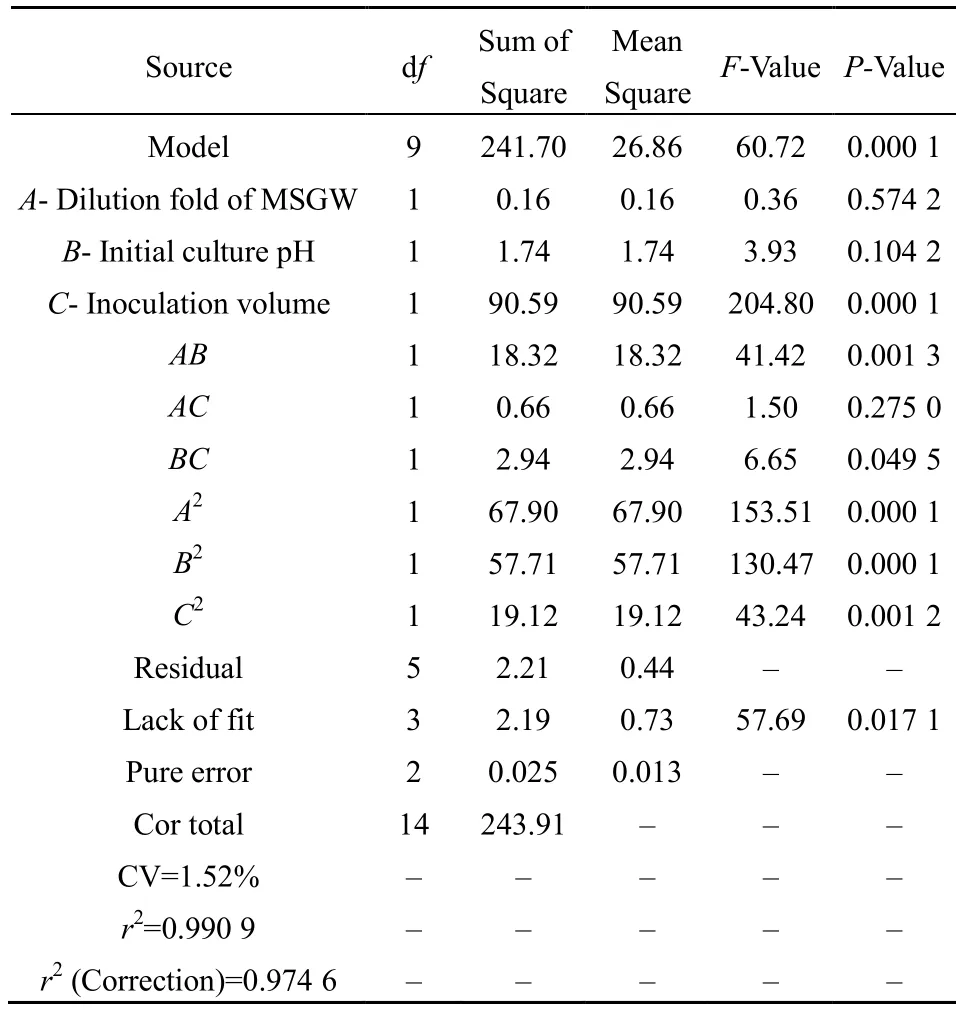
表5 回归模型的方差分析Table 5 Regression model analysis of variance
从回归方程和部分重复因子实验的回归分析及方差分析结果(表 4、表 5)可以看出,回归模型显著性检验的P值为0.0001,说明所得回归方程的可信度较高,具有很好的代表性。此外由模型的可信度分析(表5)得到复相关系数r2=0.9909,校正后r2=0.9746,说明模型可以解释99.09%实验所得的γ-PGA产量的变化,同时也说明该模型方程适用于本实验利用味精废水培养枯草芽孢杆菌生产γ-PGA产量的理论预测。另外,响应值的变异系数CV较小(为1.52),进一步说明了该回归模型的可信度较高。表5中,C、AB、BC、A2、B2和C2的P值小于 0.05,说明 C、AB、BC、A2、B2和 C2对响应值都有极显著的影响。
2.2.3 响应面分析直观图
根据表3所示实验结果和回归方程,用Design-Expert 8.0.6软件绘出味精废水稀释倍数、培养初始pH和接种量3个因素中任意两个因素对γ-PGA产量的响应面分析图和等高线图,结果分别见图 2、图 3、图 4。每个响应面分别代表两个独立变量之间的相互作用。由响应面和相应的等高线图可以看出,两两因素之间的相互作用都比较明显。
2.2.4 γ-PGA产量预测及培养条件优化
为了进一步确定γ-PGA最大产量的稳定点,对2.2.2中得到的回归方程求一阶偏导并使其等于零,可求得回归方程的极值点为:味精废水稀释倍数A=3.88,培养初始pH B=5.84,接种量C=10.55 mL;代入回归方程解得预测的 γ-PGA产量为 54.78 g·L-1。以响应面实验得到的最佳培养条件进行发酵实验,实验重复3次,最后测得γ-PGA产量平均值为(53.51±0.92) g·L-1。实验值与预测值相差较小,说明该模型能较好地预测实际发酵情况。通过优化,使得γ-PGA产量较单因素实验产量(49.33±1.21)g·L-1提高了约 8.5%。
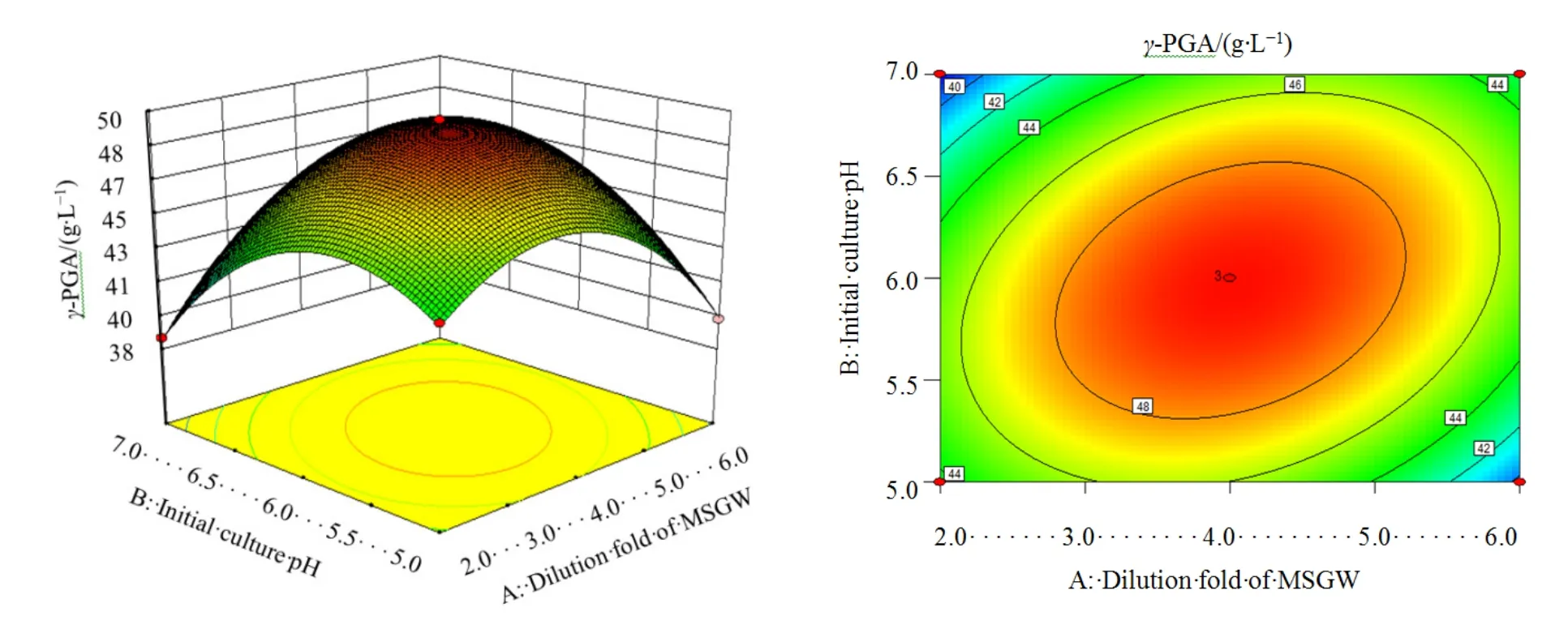
图2 味精废水稀释倍数(A)与培养初始pH(B)对γ-PGA产量的响应面分析图与等高线图Fig. 2 Response surface plot and contour plot for the effects of Dilution fold of MSGW (A) and Initial culture pH (B) on γ-PGA production

图3 味精废水稀释倍数(A)与接种量(C)对γ-PGA产量的响应面分析图与等高线图Fig. 3 Response surface plot and contour plot for the effects of Dilution fold of MSGW (A) and Inoculation volume (C) on γ-PGA production

图4 培养初始pH(B)与接种量(C)对γ-PGA产量的响应面分析图与等高线图Fig. 4 Response surface plot and contour plot for the effects of Initial culture pH (B) and Inoculation volume (C) on γ-PGA production
根据文献报道,多株菌种曾被用于γ-PGA的生产,Ogawa et al.(1997)在40 ℃条件下培养地衣芽孢杆菌(B. licheniformis ATCC9945a)生产γ-PGA,其产量达到 35 g·L-1。Kubota et al.(2008)在 37 ℃条件下培养枯草芽孢杆菌菌株B. subtilis F201生产γ-PGA,产量达到 50 g·L-1。Shi et al.(2006)对枯草芽孢杆菌菌株B. subtilis ZJU-7生产γ-PGA的培养基条件进行了优化,优化后的培养基为:蔗糖59.80 g·L-1,蛋白胨 53.54 g·L-1,L-谷氨酸 81.05 g·L-1,NaCl 10 g·L-1,此时,γ-PGA 产量为 58 g·L-1(Shi et al.,2006)。本实验采用味精废水作为枯草芽孢杆菌168的培养基,在3.88倍稀释的味精废水中,控制初始pH为5.84,以较高的菌种投加量(每50 mL味精废水投加10.55 mL种子液),可以达到较高的γ-PGA产率,且不需另加碳源和氮源,具有降低生物法合成γ-PGA成本的潜力。所以,以味精废水培养枯草芽孢杆菌168生产γ-PGA是可行的,具有较大的开发潜力。
2.3 γ-PGA的含量及表征
2.3.1 γ-PGA含量的测定
采用茚三酮比色法测定γ-PGA粗产品的纯度,结果如表6所示,以光密度D570为自变量、谷氨酸的质量(y)为因变量求得标准曲线为:
y=2007.5 D570-53.048,r2=0.9992
由表 6求得待测样品的平均光密度为 0.650,根据标准曲线计算出样品水解液中谷氨酸的质量为1251.83 µg,而测定的样品水解液中样品(γ-PGA粗产品)的质量为1600 µg,所以γ-PGA粗产品中γ-PGA的含量为78.24%。

表6 各组溶液中谷氨酸含量及其在570 nm处的光密度Table 6 Glutamic acid content in the solutions and its optical density at 570 nm
2.3.2 γ-PGA紫外光谱扫描
γ-PGA粗产品溶液的紫外扫描光谱如图 5所示:曲线为平滑曲线,且只出现一个峰,最大吸收波长位于215 nm处,与γ-PGA 的特征紫外吸收波长非常接近(216 nm)(Cromwick et al.,2015)。由于蛋白质在280 nm有特征吸收峰,核酸在260 nm有特征吸收峰,而样品在260~280 nm处没有吸收峰,说明γ-PGA的聚合键与蛋白质的肽键结构有明显区别。从谷氨酸氨基和羧基的特点说明γ-PGA是由γ-酰胺键聚合而成。

图5 γ-PGA的紫外扫描图谱Fig. 5 Ultra Violet scanning spectrum of γ-PGA
2.3.3 γ-PGA红外光谱(FTIR)分析
聚谷氨酸中含有酰胺基、羧基和羰基等多种有机官能团,具有很多特征吸收峰,采用红外光谱法可以对γ-PGA的结构进行初步的鉴定。由图6可知,γ-PGA的红外图谱中存在4个酰胺吸收带:3386.63 cm-1处存在一个宽大强吸收峰,该吸收峰为N—H对称伸缩振动带(于晓丹,2011)(酰胺吸收带I),由于分子间的缔合作用使得该峰宽度比较大;1643.90 cm-1处出现的吸收峰为 C=O的伸缩振动(酰胺吸收带II);1534.32 cm-1处出现的吸收峰是由N—H弯曲振动和C—N平面摇摆振动缔合(酰胺吸收带III)而成的;1125.93 cm-1处的吸收峰为C—N伸缩振动(酰胺吸收带IV)产生的,由这4个吸收峰结合证明该物质中存在酰胺基。
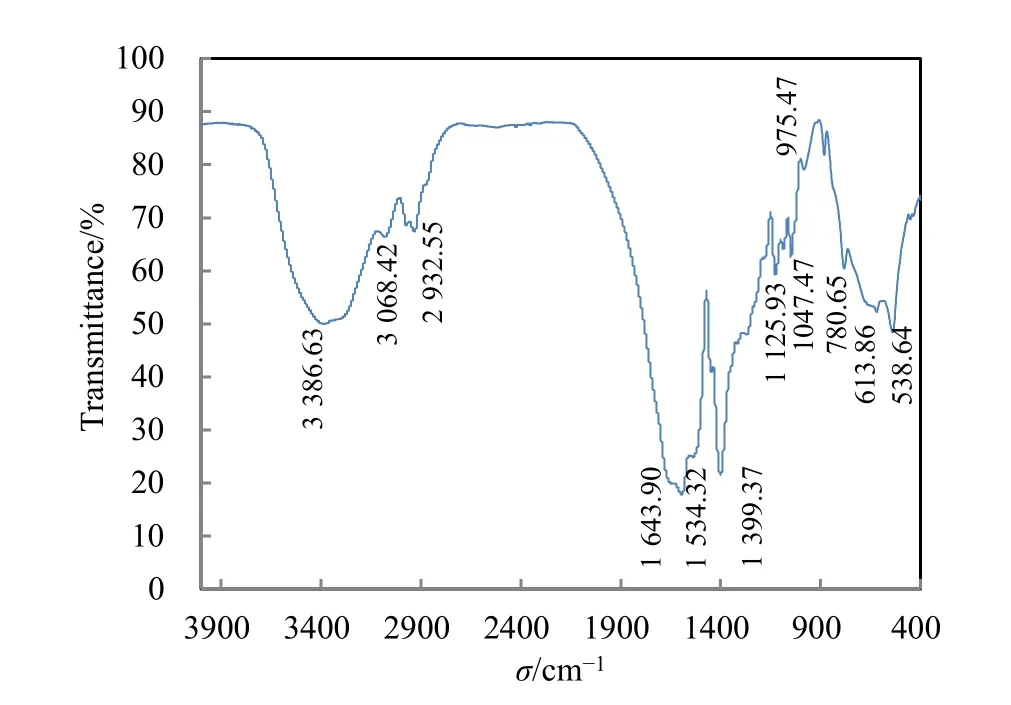
图6 γ-PGA的红外光谱图Fig. 6 Infrared spectra of γ-PGA
在 3100~2900 cm-1之间存在吸收峰 3068.42 cm-1和2932.55 cm-1,说明该化合物中存在饱和的C—H的对称伸缩振动和不对称伸缩振动,即存在—CH2—基团。1399.37 cm-1处的吸收峰是由—OH弯曲振动产生的,而1047.47 cm-1处的吸收峰则是由 C—O伸缩振动产生的,由这两者结合上述1643.90 cm-1处的C=O伸缩振动产生的吸收峰,可以推测聚合物中含有—COOH基团。而在低频区1000~500 cm-1处的吸收峰则是由(CH2)n(n>4)面外扭曲振动和平面摇摆振动产生的,由于N—H非平面弯曲振动使其吸收峰增宽(于晓丹,2011)。通过上述的图谱分析,可以发现聚合物中含有酰胺基、羧基和亚甲基,可以初步确定样品中存在γ-PGA结构。
2.3.4 γ-PGA核磁共振(NMR)分析

图7 γ-PGA的1H NMR图谱Fig. 7 1H NMR spectra of γ-PGA
图7所示为γ-PGA样品的1HNMR图谱。样品在化学位移0~10之间存在6个不同类型的质子。根据质子的化学位移范围可以推测 δ=7.989处为—NH特征峰,由于—NH、—OH等基团的质子氢较为活泼,在溶剂(D2O)中交换很快,并受测定条件(如温度、浓度及溶剂等)的影响,化学位移值并不是一个固定的值,即使待测样品用D2O溶液浸润后立即测定,由于质子交换作用,—NH的质子峰面积仍较小,且因氮原子与邻近碳原子上的质子的去耦合作用而呈现单吸收峰;—OH质子的吸收峰消失;而δ=4.052处HDO的峰面积则较高。化学位移δ=3.569处的质子可推测为—CH结构,而化学位移 δ=2.263处 2个质子的单峰可推测为—CH2结构,—CH质子与—CH2发生质子耦合而分裂成双峰 δ=1.990和δ=1.885。此外根据质子的化学位移范围还可推测化学位移 δ=1.069处为—CONH结构(于晓丹,2011)。经过分析,1H NMR图谱中各峰归宿如表7所示。结合红外分析结果,可以确定样品中γ-PGA的结构为(于晓丹,2011;万红贵等,2004):
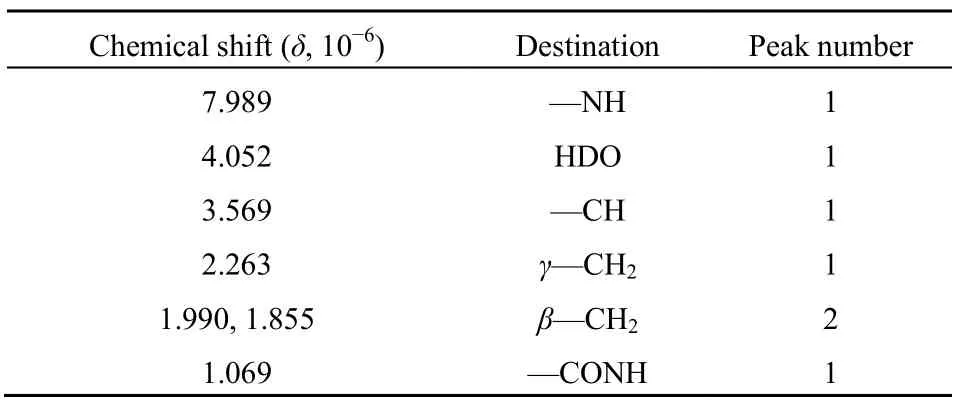
表7 γ-PGA样品的1H NMR图谱各峰归宿Table7 Peak results of γ-PGA 1H NMR spectra

3 结论
(1)利用味精废水培养枯草芽孢杆菌 168产γ-PGA时,味精废水浓度、初始pH、接种量和培养时间对枯草芽孢杆菌168的生长和γ-PGA产量具有重要的影响。BBD响应面正交实验优化后的培养条件为:味精废水稀释倍数 3.88,培养初始pH 5.84,50 mL味精废水接种量 10.55 mL,在37 ℃、180 r·min-1条件下培养 48 h,γ-PGA 的产量达到(53.51±0.92) g·L-1。利用味精废水作为枯草芽孢杆菌 168的培养基,可以达到较高的 γ-PGA产率,且不需另加碳源和氮源,具有降低微生物发酵法合成γ-PGA的潜力。
(2)采用茚三酮比色法测定γ-PGA粗产品纯度为78.24%。紫外扫描光谱显示γ-PGA的聚合键与蛋白质的肽键结构有明显区别,γ-PGA是由γ-酰胺键聚合而成。傅立叶红外光谱和核磁共振分析显示样品中含有酰胺基、羧基、羰基—CH、—CH2等基团,可确定为γ-PGA的结构。
