AKT/FOXO1信号通路在心力衰竭小鼠骨骼肌萎缩中的作用
2018-11-01张聪聪陈博雅程乃萱
张聪聪 陈博雅 程乃萱 杜 杰
心力衰竭(heart failure, HF)是多种心血管疾病(高血压、心肌梗死、先天性心脏病、瓣膜病等)导致的心脏病理性重构的结果。HF患者会感到疲劳、乏力、嗜睡和身体活动能力下降, 及包括呼吸肌在内的多种骨骼肌功能异常的表现。身体80%的蛋白质由骨骼肌储存,骨骼肌萎缩会导致全身性的营养不良,骨骼肌萎缩的程度能够作为HF导致死亡的重要预测指标[1-2]。因此,HF时骨骼肌蛋白分解代谢的研究具有重要意义。本研究采用主动脉弓横向结扎(transverse aortic constriction, TAC)8周,复制小鼠HF动物模型[3]。采用实时定量-聚合酶链式反应(realtime-PCR) 和Western blot 技术,检测HF小鼠胫骨前肌内Atrogin-1 和MuRF1的mRNA及蛋白表达变化,并采用Western blot 技术,检测其上游转录因子FOXO1以及激酶AKT的磷酸化水平和总蛋白水平进行测定,比较磷酸化蛋白表达与总蛋白的比率。通过观察骨骼肌组织中上述指标的变化,从而探讨HF时骨骼肌萎缩的可能分子机制,并为有效的多靶点干预提供理论依据。
材料与方法
1. 实验动物 SPF级C57BL/6J小鼠20只,雄性,10周龄,体质量20~23g,由首都医科大学附属北京安贞医院实验动物房提供。购自北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2014-0004,使用许可证号: SCXK(京)2015-0023。小鼠随机分为两组: 对照组(10只) 和HF模型组(10只)。
2. 主要试剂 反转录试剂盒(Promega,美国),realtime-PCR试剂盒(TaKaRa,日本),Atrogin-1,MuRF1一抗(Abcam,美国),FOXO1,p-FOXO1,AKT, p-AKT一抗(Cell Signaling Technology,美国),GAPDH一抗(中杉金桥,中国),DyLight 800标记山羊抗兔IgG二抗(LI-COR,美国)。
3. TAC诱导心力衰竭模型制备 HF组小鼠使用1%戊巴比妥麻醉(70mg/kg体质量),从颈部剪开皮肤,游离甲状腺,剪开胸骨,游离胸腺及主动脉弓周围结缔组织,充分暴露主动脉弓。使用5~0棉线结扎主动脉弓,以27号针为垫针结扎。结扎后撤出27号针头,缝合胸骨和皮肤。对照组小鼠仅麻醉后剪开颈部皮肤剪开胸骨并暴露主动脉弓后进行缝合。所有小鼠均普通饮食饲养,自由进食、进水。分别于术前,术后1周,2周,4周,8周进行小鼠称重。术后1周,通过小动物超声(VIVO,美国)检测主动脉弓流速,以流速≥2 500mm/s为模型成功标准。术后8周,测量心功能之后收取小鼠心脏组织,用10%中性甲醛固定后用于病理分析。同时无创游离小鼠双侧胫骨前肌,并进行称重,一侧用10%中性甲醛固定后用于病理分析,另一侧用液氮冻存用于mRNA和蛋白的提取。
4. 小鼠心功能测定 于TAC术后8周,通过小动物超声进行小鼠心功能测定,主要检测指标如下:室间隔厚度(interventricular septum,IVS)、左心室后壁厚度(left ventricular posterior wall thickness,LVPW)、左心室舒张末期内径(left ventricular end-diastolic dimension, LVEDD)、左心室收缩末期内径(left ventricular end-systolic dimension, LVEDS)、左心室舒张末期容积(left ventricular end-diastolic volume, LVESV)、左心室收缩末期容积(left ventricular end-systolic volume, LVEDV)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室缩短分数(left ventricular fractional shortening,LVFS)。
5. 心脏组织、骨骼肌组织病理切片的制备方法同前[4]。取出已固定的心脏组织和胫骨前肌,常规石蜡包埋,4μm切片。HE染色:切片经二甲苯和梯度乙醇脱蜡至水,苏木素染色3min,自来水冲洗;盐酸乙醇分化30s;自来水返蓝5min;置伊红染色液2min;常规脱水,透明,封片。WGA染色:切片经二甲苯和梯度乙醇脱蜡至水,柠檬酸缓冲液(pH=6.0)抗原修复90s,1 x PBS缓冲液洗3遍,羊血清封闭液室温封闭30min,WGA工作液(10ug/mL, Sigma,美国)37℃,孵育60min,1 x PBS缓冲液洗3遍,DAPI封片。使用电子荧光显微镜(Nikon,日本)进行病理图像采集,使用NIS Br 3.0软件进行图像分析。
6. realtime-PCR检测小鼠胫骨前肌组织中Atrogin-1和MuRF1的mRNA水平 取相同质量50 mg 的胫骨前肌放入匀浆器内,加入1 mL Trizol(Invitrogen,美国)提取RNA,用Nanodrop 2 000测定RNA 的浓度和OD260 /280 比值。各样本均按5μg RNA 相对应的体积(n μL) 根据反转录试剂盒说明书进行逆转录,转录体系为20 μL 体系,将混合好的液体放置在PCR仪中,反应条件为42℃, 60min;95℃, 5min。将反转好的cDNA按照realtime-PCR 说明书进行半定量PCR,使用Bio-RAD CFX Connect进行反应,反应条件为95℃, 2min;95℃,15s;60℃, 30min(40个循环);60℃, 5s,每个循环增加0.5℃~95℃。以GAPDH作为内参。基因的表达水平以得到的相应的Ct 值用2 (Ct GAPDH-Ct 目标基因)法进行计算。引物序列分别为: Atrogin-1∶5’- CGGGCTTCCTTGAGTGTCTT-3’(上游),5’- GGCTCTCCTAAGGTCCCAGA-3’(下游);MuRF-1∶5’- AAACTTGTGGA GACCGCCAT-3’(上游),5’- TCTTGATGAGCTGCTTGGCA-3’(下游);GAPDH:5’- CATGGCCTTCCGTGTTCCTA-3’(上游),5’-GCGGCACGTCAGATCCA-3’(下游)。
7. Western blot 测定小鼠胫骨前肌组织中相关蛋白的表达 取50mg胫骨前肌用300μL T-PER组织裂解液(含1x 0.5M EDTA, 1x蛋白酶抑制剂,1x磷酸酶抑制剂)(Thermo,美国)进行裂解,12 000r/min,离心15min,后吸取上清。使用BCA蛋白浓度测定试剂盒测定样品总蛋白浓度。将100μg蛋白与5x蛋白上样缓冲液进行混合后,100℃变性5 min。进行聚丙烯酰胺凝胶电泳,然后蛋白电转移至硝酸纤维素膜,用5%脱脂奶粉溶液封闭2h,再依次孵育稀释后的一抗Atrogin-1(兔多抗,1∶1 000),MuRF1(兔多抗,1∶1 000),FOXO1(兔多抗,1∶1 000),p-FOXO1(兔多抗,1∶1 000),AKT(兔多抗,1∶1 000), p-AKT(兔多抗,1∶1 000),GAPDH (鼠单抗,1∶1 000),4℃孵育过夜。洗涤。敷二抗(1∶1 000稀释),室温孵育1小时,稍洗。使用Odyssey 仪器进行荧光扫描,并分析条带灰度。
8.统计学方法 应用GraphPad Prism 5 统计软件对实验数据进行统计学分析。计量数据以均数±标准差表示,采用独立样本的t检验。以P<0.05为差异有统计学意义。
结 果
1.HF 模型的结果 (1)体质量变化:TAC 术前和术后2周,4周时实验组和对照组小鼠的平均体质量差异无统计学意义,TAC 6周时实验组小鼠体质量明显低于对照组小鼠(P<0.05),TAC 8周时实验组小鼠体质量明显低于对照组(P<0.01),且体质量下降已超过预计值的10%,出现营养不良改变。结果见图1。
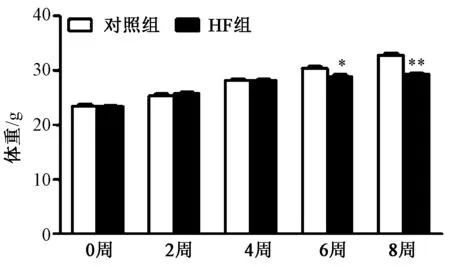
图1 小鼠体质量变化 注:与对照组相比,*P<0.05,**P<0.01
(2)心功能变化:TAC术后8周时使用小动物超声检测两组心功能各项指标,其中HF组的EF值和FS值较对照组显著下降(P<0.01,表1)。
(3)心脏组织形态学改变:心脏组织HE染色可见HF组小鼠心脏室壁厚度较对照组增加,心室内径增加。WGA染色观察心肌细胞的面积发现HF组心肌细胞的面积大于对照组(P<0. 01,图2)。
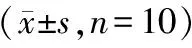
表1 两组小鼠心功能比较
注:LVM:左心室质量

图2 小鼠心肌病理检测 A:HE染色(放大倍数40X,标尺500μm);A心动衰竭组:心脏左心室室壁厚度的测量数据,与对照组相比,*P<0.05;B:WGA染色(放大倍数400X,标尺50μm),B心动衰竭组:根据WGA染色心肌细胞的横截面面积,与对照组相比,** P<0.01
(4)骨骼肌组织形态学观察:HF组胫骨前肌重量和胫骨长度比显著低于对照组。HE染色可见HF组肌纤维横截面积较对照组减小,经过WGA染色统计分析肌纤维面积可见HF组肌纤维横截面面积显著小于对照组,每高倍镜视野下肌纤维数量计数显著高于对照组。提示HF组骨骼肌发生萎缩。见图3~4。
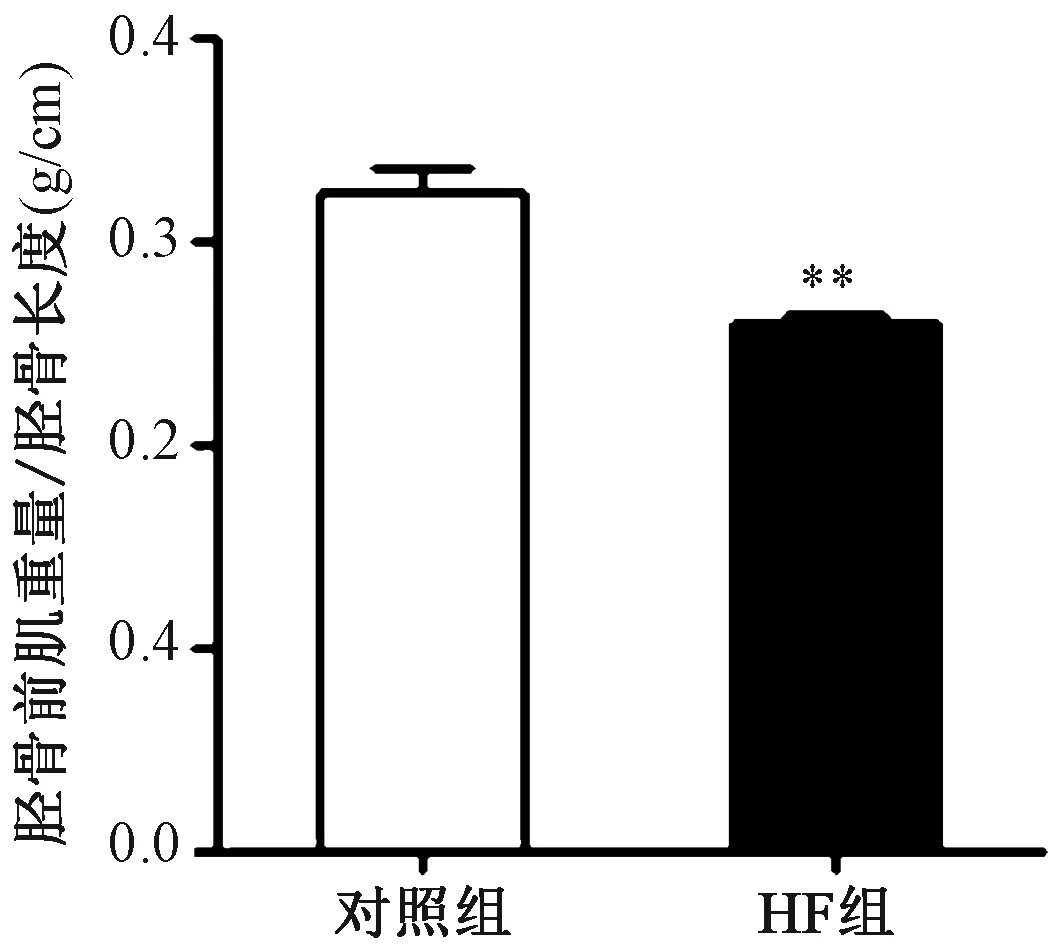
图3 小鼠胫骨前肌和胫骨长度比值, 与对照组相比,**P<0.01
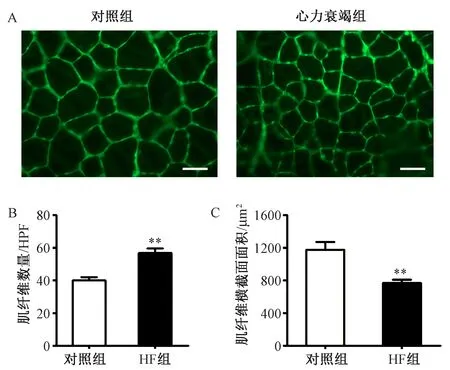
图4 小鼠胫骨前肌肌纤维病理分析 A:WGA染色(放大倍数X400,标尺50μm);B:每高倍视野(HPF)中肌纤维数量的统计;C:肌纤维面积的统计结果注:与对照组相比,**P<0.01
2.胫骨前肌中Atrogin-1和MuRF1 的mRNA 和蛋白表达变化 胫骨前肌realtime-PCR的结果显示,HF组胫骨前肌中Atrogin-1的mRNA水平较对照组增加约3.8倍 (P<0.01); HF组胫骨前肌中MuRF1的mRNA水平较对照组增加7.2倍 (P<0.01,图5)。Western Blot的结果显示,Atrogin-1 的蛋白相对表达量HF组较对照组明显增加,两组比较差异有统计学意义(P<0.01); MuRF1 的蛋白表达HF组较对照组增加(P<0.05,图6)。

图5 两组小鼠胫骨前肌中Atrogin-1和MuRF-1的mRNA表达水平 注:与对照组相比,**P<0.01
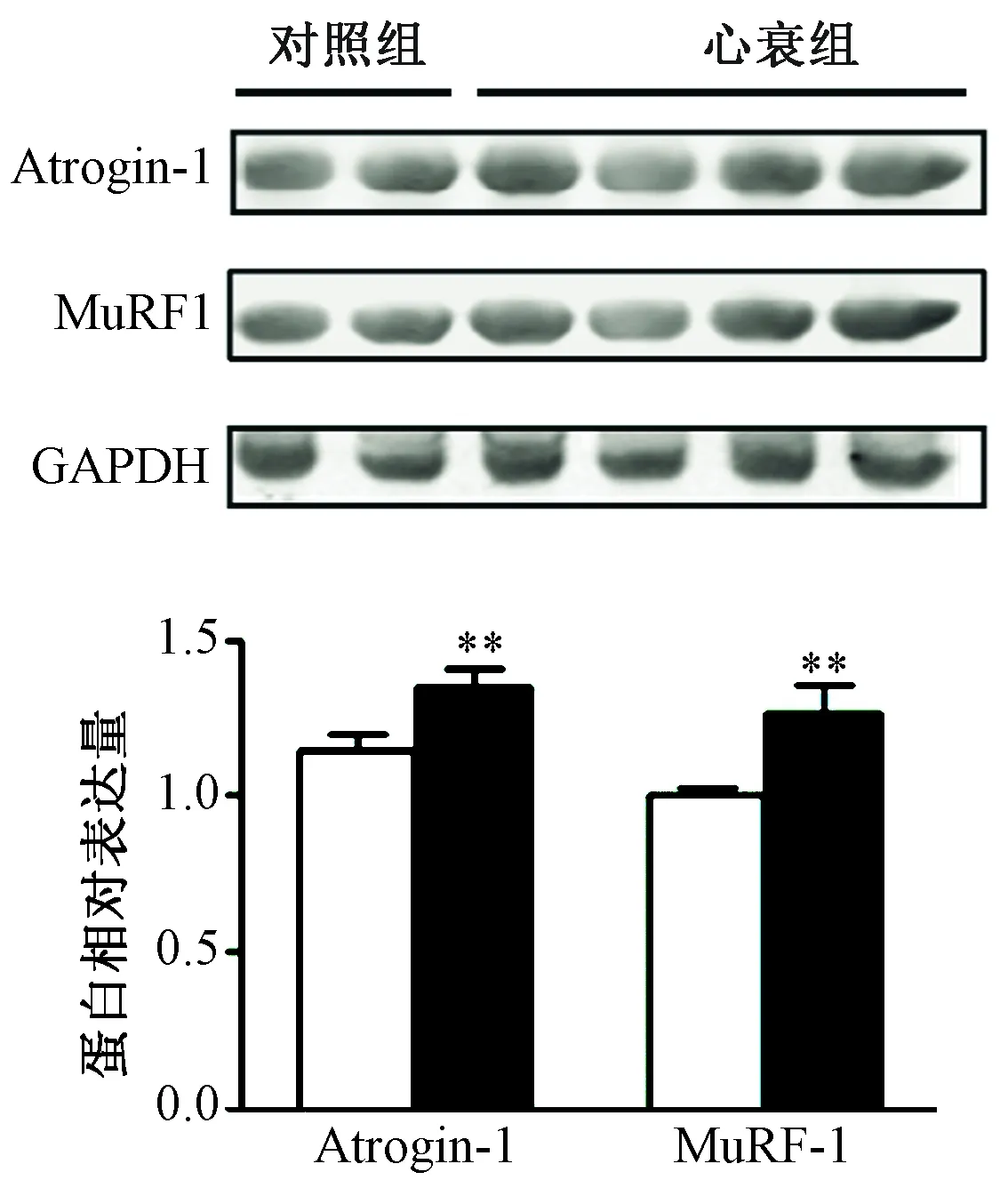
图6 两组小鼠胫骨前肌中Atrogin-1和MuRF-1的蛋白表达水平 注:与对照组相比,**P<0.01
3.胫骨前肌中AKT/FOXO1信号通路的活化变化 Western blot 分析结果显示,AKT和FOXO1总蛋白的表达量在HF组和对照组差异无统计学意义。磷酸化AKT和磷酸化FOXO1的水平在HF组显著增加,两组比较差异有统计学意义(P<0.05)。p-AKT/AKT和p-FOXO1/ FOXO1的比值在HF组显著增加,两组比较差异有统计学意义(P<0.05,图7)。
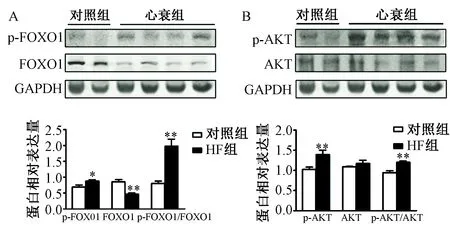
图7 A:两组小鼠胫骨前肌中p-FOXO1和FOXO1的蛋白表达水平;B:两组小鼠胫骨前肌中p-AKT和AKT的蛋白表达水平,注:与对照组相比,*P<0.05; 与对照组相比,**P<0.01
讨 论
根据中国心力衰竭注册登记记录统计,中国35~74岁人群慢性心力衰竭患病率为0.9%,并呈上升趋势,其中住院心力衰竭患者的病死率约为5.3%[5]。心力衰竭患者骨骼肌萎缩的程度直接影响疾病的预后情况[2]。心力衰竭引起骨骼肌病变的主要表现为:①重量减轻;②结构改变, 如肌纤维面积变小、I型纤维向Ⅱ型纤维转变、线粒体减少;③能量代谢的改变,蛋白水解、糖酵解增加;④细胞因子及氧化标记物表达增加等[6]。心力衰竭患者发生骨骼肌萎缩是一种多因素、多种分子生物学机制共同参与的复杂过程[7],其最终归结为骨骼肌蛋白合成和降解之间的不平衡,蛋白降解途径增加程度大于蛋白合成,导致骨骼肌萎缩。我们在本研究中使用TAC 8周建立小鼠HF模型,发现小鼠的骨骼肌重量减轻,肌纤维面积减小,提示小鼠HF导致骨骼肌萎缩的模型成功,可以为研究小鼠骨骼肌萎缩的分子机制提供基础。
国内外的研究显示,骨骼肌萎缩过程中的蛋白质的降解途径主要包括溶酶体途径、泛素-蛋白酶体途径和Ca2+依赖性途径等[8],其中泛素-蛋白酶体途径最为重要。在肌肉中特异性表达的E3 泛素连接酶主要为MAFbx (muscle atrophy F-box,又称为Atrogin-1)和MuRF-1 (muscle RING finger 1),这两个分子属于成肌分化抗原(myogenic differentiation antigen, MyoD)降解过程中的核蛋白[9]。在发生HF的心脏组织中Atrogin-1和MuRF-1可出现高表达[10-11]。Li 等的实验证明,肿瘤坏死因子 (tumor necrosis factor,TNF)-α可通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) p38亚基来调节Atrogin-1的表达[12]。细胞因子胰岛素样生长因子(insulin-like growth factor,IGF)-1的表达可以抑制Atrogin-1和MuRF-1的表达从而抑制骨骼肌萎缩的发生[13]。先前有研究显示在慢性阻塞性肺疾病导致的骨骼肌萎缩过程中骨骼肌中的Atrogin-1和MuRF-1的表达就显著增加[14]。我们在本研究中发现HF小鼠的骨骼肌中两种泛素连接酶Atrogin-1和MuRF-1的表达显著增加,这两个分子可能引起骨骼肌中蛋白质的泛素化增加, 促进其被泛素蛋白酶体系统降解,发生骨骼肌萎缩。
转录因子FOXOs 家族是一类拥有翼状螺旋结构的蛋白,主要包括FOXO-1 和FOXO-3 等。FOXOs 蛋白通过其C末端的转录激活结构域与靶基因的转录启动子区域结合促进靶基因的表达[15]。当FOXOs被上游的信号分子如AKT等磷酸化后使其由细胞核转运至细胞质,进而被泛素蛋白酶体系统降解,表达降低,导致其转录活性下调,从而抑制其对靶基因的转录调控作用。研究显示FOXOs可以通过调控自噬相关基因的转录引起骨骼肌细胞的自噬,同时可以促进肌细胞中MyoD的表达影响肌纤维的分化[16-17]。最近的研究也显示FOXO1可以直接结合至与骨骼肌萎缩密切相关的Atrogin-1 和MuRF1的转录启动子区域,从而调节Atrogin-1 和MuRF1的表达[18]。研究显示骨骼肌特异性敲除FOXO1基因将抑制废用性骨骼肌萎缩或去神经性骨骼肌萎缩的发生[19-20]。我们在本研究中发现HF组骨骼肌组织中FOXO1的磷酸化水平增加,同时FOXO1总蛋白水平下降,提示在心力衰竭导致骨骼肌萎缩的过程中存在负向调控分子导致FOXO1的转录调控能力下降从而抑制骨骼肌萎缩的发生。
AKT是一种丝/苏氨酸蛋白激酶,在磷脂酰肌醇依赖的蛋白激酶(phosphoinositide 3-kinase, PI3K)的协同作用下,磷脂酰肌醇2磷酸(PIP2)和磷脂酰肌醇3磷酸(PIP3)与胞浆内AKT 结合,AKT转位 到质膜,并促进Ser473 和Thr308 位点磷酸化。Ser473或/和Thr308 位点的磷酸化是AKT 激活的必要条件,活化状态下的AKT 使转录因子FOXO1 磷酸化后从细胞核中移出,并在细胞浆中被泛素蛋白酶体所降解,从而抑制其转录调节活性[21]。Atrogin-1 和MuRF1 受FOXOs 转录因子家族的转录调节,而AKT 可使FOXOs基因转录调节功能失活。本研究中发现HF小鼠的骨骼肌中AKT和FOXO1的磷酸化显著高于对照组,提示骨骼肌中存在激活AKT下调FOXO1的转录活性,从而抑制Atrogin-1 和MuRF1表达抑制骨骼肌萎缩的负性调控因子。另一方面,磷酸化的AKT可激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)和真核翻译起始因子4E结合蛋白1(e IF4E-binding protein 1,4E-BP1)、核糖体S6激酶1(ribosome protein subunit 6 kinase 1, S6K1)信号通路,并阻碍抑制蛋白质合成因子糖原合成酶激酶3β (glycogen synthase kinase-3β, GSK-3β)活性,促进蛋白合成[22-23],启动负向调控机制。
综上所述,心力衰竭的骨骼肌中蛋白降解相关基因Atrogin-1 和MuRF1的表达显著上调促进骨骼肌萎缩的形成。同时骨骼肌中AKT/FOXO1信号通路活化,启动负向调控机制,可能发挥抑制骨骼肌萎缩的作用,成为机体的一个代偿机制。但是具体何种分子激活AKT/FOXO1信号通路尚需进一步的探索。本研究的发现为治疗心力衰竭骨骼肌萎缩提供一个新思路,即干预AKT/FOXO1 信号通路上的某些靶点使其进一步激活,从而达到抑制骨骼肌萎缩的目的。
