吡格列酮降低动脉粥样硬化炎症和斑块破裂的PET/CT活体成像研究
2018-10-31张明多闫云峰庄须翠张玉慧王争明李德鹏李丽琴宋现涛吕树铮
张明多 闫云峰 庄须翠 张玉慧 王争明 李德鹏 李丽琴 宋现涛 吕树铮
赵全明
研究表明,炎症贯穿动脉粥样硬化斑块发生发展的全过程[2]。噻唑烷二酮类(thiazolidinediones, TZDs)药物可能通过抗炎发挥降低血栓事件率的作用[3]。TZDs是过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma, PPARγ)激活剂,不仅可以调节血糖浓度,而且它还能抑制动脉粥样硬化斑块的形成。核素分子成像是一种功能和代谢成像方式,能够检测出病变组织炎症,目前已用于动脉粥样硬化领域的研究。氟代脱氧葡萄糖(18F-FDG)PET/ CT在获得功能代谢显像数据的同时又可获得形态学的资料,使得PET/CT应用于斑块炎性程度及抗炎药物治疗效果评估成为可能。本实验以改良的康斯坦丁兔为动脉粥样硬化和易损斑块动物模型,吡格列酮对模型进行干预,以PET/CT作为监测工具, 探讨吡格列酮是否具有降低斑块破裂率,改善斑块易损性的作用及可能机制。
材料与方法
1.动物模型 20只雄性新西兰大耳白兔(北京市海淀区兴旺动物养殖场,许可证号:SCXK(京)2006-0006),动物体质量约(3.0±0.5)kg。抽签法随机分为两组:对照组(n=10)和药物组(吡格列酮,n=10)。两组给予高脂饲料喂养2周后, 用改良的Phinikaridou方法[6]行主动脉内膜球囊拉伤术制作动脉粥样硬化斑块模型。此后对照组动物给予间断高脂饲料喂养16周,药物组动物在高脂饲料的基础上服用吡格列酮(10 mg·kg-1·d-1)直至实验结束。实验动物的处置严格遵守首都医科大学动物伦理委员会相关条例规定。
2.破裂诱发实验 两组动物于球囊拉伤术后第16周 (蛇毒0.15mg/kg腹膜下注射30min后,经兔耳缘静脉注射组胺0.02 mg/kg) 间隔24h,进行2次药物诱发斑块破裂实验。
318F-FDG PET/CT显像及影像融合 共进行二次PET/CT扫描:第一次于喂养第8周球囊拉伤术后造模完成时(实验中期扫描);第二次于第18周药物诱发试验前(实验晚期扫描)。实验动物于显像前夜禁食、水。显像当日根据体重予以静脉麻醉(3%的戊巴比妥钠,剂量为1~1.5mL/kg)。再分别经静脉予以18F-FDG,剂量为1mCi/kg。给药后180分钟后将兔仰卧位固定于兔台上进行普通CT定位平扫,后PET三维图像采像10min。完成后以欧乃派克10mL(按照1∶1稀释) 0.4mL/s进行CT血管造影扫描(160mA,120kV)。将PET图像和CT图像在PET/CT后处理工作站中利用软件进行图像融合,并测量各层面显影动脉的不同节段的FDG标准化摄取值(standard uptake value,SUV)。具体方法是参照主动脉上左肾动脉起始部,分别向上下方标记,每3.75mm为一层面,向上至主动脉弓,向下至髂动脉分叉,根据主动脉直径,划定包含全部主动脉横断面的圆形感兴趣区域,由工作站软件根据注射18F-FDG剂量,代谢时间和动物体质量自动生成所选区域的平均标准化摄取值(SUVmean)和最大标准化摄取值(SUVmax)。进行SUV后期统计时,每相邻两个层面SUVmean的平均值代表每一动脉段标本的SUVmean,每两个层面SUVmax的较大者代表每一动脉段标本的SUV max。
4.离体标本病理染色及组织学测量 PET/CT活体显像完成后,注射过量的戊巴比妥钠处死试验动物。参照主动脉上左肾动脉起始部为标志,由上到下方向每7.5mm为一节段分为若干标本,以备病理送检。进行离体标本的大体病理观察和记录后,将每一长度为7.5mm的兔主动脉标本垂直于动脉横截面方向分为两个各为均分为3.75mm的节段留取标本,对所有动脉段进行石蜡包埋切片以及 HE 染色 巨噬细胞 RAM-11 染色以及新生血管 CD-31免疫组化染色。
5.病理学分析 使用NIS-Elements AR Analysis病理图像分析系统采集图像,利用该软件分别测量每一载玻片上动脉段中内斑块面积及血栓形成情况。其中斑块面积=内弹力膜构成的环形面积-管腔面积。血栓形成情况的计算:以1.5cm将所有实验动物主动脉进行分段,分别计算药物组和对照组中血栓形成的动脉段数量,未形成血栓的动脉段数量。图像采用NIS-Elements AR Analysis软件测量斑块内阳性细胞积分光密度值及内膜面积积分值,并计算巨噬细胞密度值(巨噬细胞密度值=阳性细胞积分光密度值/内膜面积积分值)。然后计算每只动物巨噬细胞密度的平均值。计算整个血管壁10×10倍视野内新生血管数量,然后计算每只动物新生血管数量的总和。
6.血脂及炎症因子检测 于第8 周、18 周抽取血液样本,用生化试剂盒检测血糖、血脂、hs-CRP,用ELISA试剂盒检测血清MMP-9。
7.统计学分析 统计学分析使用SPSS 16.0软件包。Levene’s 检验验证方差齐性,计量资料以均数±标准差表示,两组均数比较采用t检验。计数资料采用数量或百分比表示,采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1.实验动物死亡情况 参与实验的20只动物中,共有13只动物在最终的安乐死前死亡,其中药物组死亡6只,对照组死亡7只。在实验的20只动物中,3只动物在球囊拉伤腹主动脉手术过程中死亡。高脂饲料喂养过程中,5只死于高胆固醇血症、肝中毒,2只死于严重营养不良并发感染。药物诱发过程中,2只死于肺水肿。1只死于急性血栓闭塞。共8只实验动物(药物组4只,对照组4只)进行了病理分析,7只实验动物(药物组4只,对照组3只)于第二次PET/CT显像后处死,病理结果证实,实验药物组4只动物有血栓形成;对照组3只动物有血栓形成。

表1 实验动物生化检测结果
注:MMP-9:基质金属蛋白酶-9;与基线相比,*P<0.05;与对照组相比,†P<0.05
2.实验动物血清学分析结果 检测结果见表1。基线数据显示药物组及对照组两组间和组内空腹血糖、胰岛素、TC、TG、hs-CRP及MMP-9检测结果差异无统计学意义。高脂喂养18周后,对比基线水平,药物组及对照组血清TC均有显著提高。药物组及对照组血清MMP-9水平也均有显著提高。药物组MMP-9显著低于对照组MMP-9水平。药物组高敏CRP也显著低于对照组hs-CRP水平。治疗后两组间TC水平差异无统计学意义。两组间体质量、血清胰岛素及血糖均差异无统计学意义。这些结果提示高脂喂养能促进兔动脉粥样硬化进展,吡格列酮干预能降低血清MMP-9浓度。
3.18F-FDG PET/CT体外活体显像及影像融合 中期扫描如图1所示,药物组CTA可见动脉管壁光滑,管腔未见充盈缺损,PET图像未见明显放射性浓聚,PET/CT融合图像显示更加直观明确(图1A)。对照组CTA可见动脉管壁略不规则,管腔可见少量充盈缺损,但水平位CTA上未见明显充盈缺损;冠状位及水平位PET图像及PET/CT融合图像上可见少量放射性摄取,提示早期动脉粥样硬化斑块形成(图1B箭头处所示)。晚期扫描如图3所示,药物组与中期扫描比较类似,血管均较正常(图2A)。对照组主动脉管壁走形不规则,管腔有不同程度的狭窄,造影上可见造影剂有明显的偏心性充盈缺损,提示有血栓形成;PET图像中可见局灶性放射性摄取,融合后的PET/CT图像可直观明确地显示主动脉区有充盈缺损和放射性摄取(图2B箭头处所示)。
4.实验动物18F-FDG摄取的比较和评估 与中期扫描相比,药物组内晚期扫描SUVmean值明显降低[(0.62±0.21)vs.(0.55±0.19),P=0.008]。与此相反,对照组内晚期扫描SUVmean值明显升高[(0.61±0.15)vs.(0.91±0.20),P<0.000]。另外,两组间基线扫描SUVmean值差异无统计学意义[(0.62±0.21)vs.(0.61±0.15),P=0.523]。SUVmax值的情况和SUVmean值类似。药物治疗组SUV mean呈现下降趋势,而对照组SUV mean呈现上升趋势,两者间差异有统计学意义[(药物组降低0.07±0.27;对照组升高0.31±0.28),P<0.001](图3A)。同样,药物治疗组与对照组SUV max改变得出了相似的结果(图3B)。

图1 实验动物中期扫描表现 A:药物组;B:对照组

图2 实验动物晚期扫描表现 A:药物组;B:对照组

图3 药物组及对照组实验晚期SUV改变值对比 ΔSUV,晚期扫描减去中期扫描SUV值;A:ΔSUVmean,B:ΔSUVmax;* P<0.05
5.动脉粥样硬化斑块组织病理学和免疫组织化学结果:实验兔主动脉产生了AHA分型的各类动脉粥样硬化斑块。其中药物组4只,对照组3只实验动物有血栓形成。药物组的75个主动脉段中11个有血栓形成,对照组的51个主动脉段中20个有血栓形成,两组兔的动脉斑块血栓形成率,差异有统计学意义(15 %vs. 39 %,P=0.002),药物组明显低于对照组。与对照组相比,药物组斑块面积小[(18.00±2.30)vs.(29.00±9.30),P<0.001]、巨噬细胞密度低[(8.80±3.94)vs.(30.13±4.19),P<0.001]、新生血管计数少[(16.50±3.09)vs.(31.00±6.11),P<0.05],均提示吡格列酮能降低斑块的炎性细胞聚集,降低斑块新生血管数量,增加斑块的稳定性(图4~6)。

图4 两组间斑块面积对比图A:兔主动脉HE染色显示药物组及对照组斑块面积;B:两组间对比显示:* P<0.05,对照组具有较大的斑块面积。差异具有统计学意义(×100)
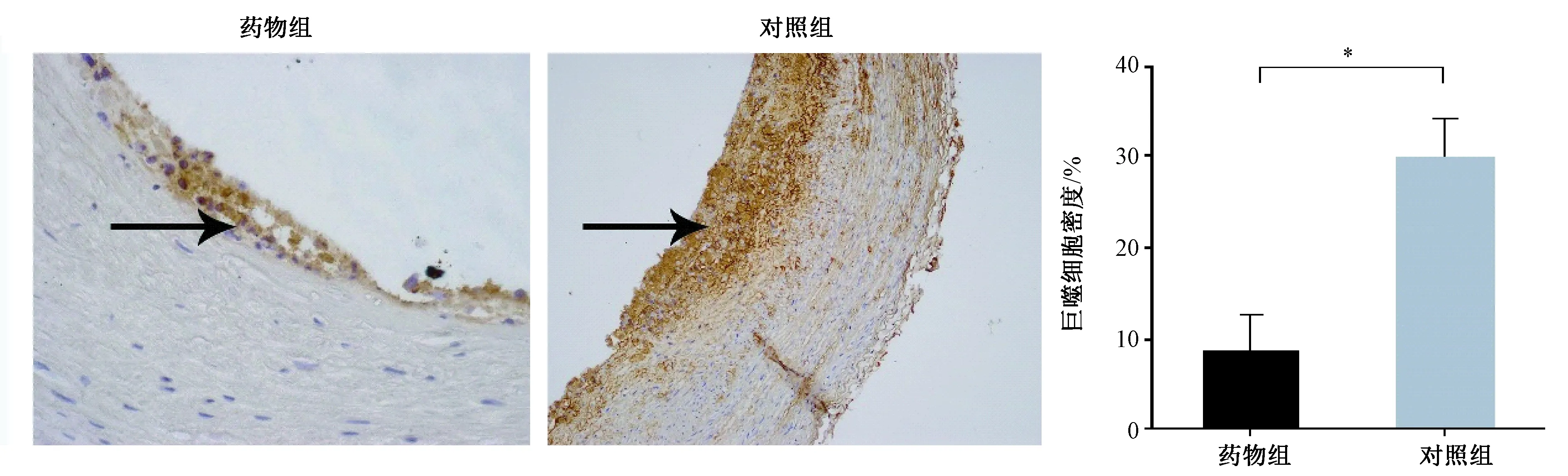
图5 两组间巨噬细胞密度对比图A:兔主动脉RAM-11免疫组化染色显示药物组及对照组斑块巨噬细胞密度:免疫组化染色后,巨噬细胞在内皮细胞下大量聚集,位置表浅,被着色为黄棕色或褐色圆形细胞,对照组褐色深染,具有较多巨噬细胞;B:两组间对比显示:*P<0.05,对照组具有较大的斑块巨噬细胞密度。差异具有统计学意义(×100)

图6 两组间新生血管计数对比图A:兔主动脉CD31免疫组化染色显示药物组及对照组斑块新生血管;B:两组间对比显示:对照组具有较多的斑块新生血管形成。* P<0.05,差异具有统计学意义(×400)
讨 论
根据本次实验的兔主动脉标本进行病理学分析显示:本实验中兔主动脉产生了AHA分类的各型斑块。本实验在制造动脉粥样硬化易损斑块以及血栓形成模型上结果比较满意,为PET/CT监测吡格列酮对动脉粥样硬化易损斑块的作用及其机制的研究提供了适宜的研究对象。
众多研究表明,以18FDG为示踪分子的PET/CT显像技术可用于定性和定量的检测动脉粥样硬化斑块炎症和评估抗动脉硬化药物对动脉粥样硬化的治疗作用。多项动物实验显示动脉18F-FDG局部聚集度和相应部位的组织病理学切片测量的巨噬细胞密度之间有很强的相关性。Rudd等[7]进行的首次前瞻性临床研究结果表明,症状性颈动脉粥样硬化斑块患者局部18F-FDG摄取较对侧无症状颈动脉显著升高。此外,切除的离体颈动脉斑块的放射自显影证实FDG在斑块巨噬细胞丰富的部位聚集。
在我们的研究中,我们利用PET/CT分别于实验中期和实验晚期测定兔主动脉斑块SUV值以对斑块局部炎症状态及发展进行评估以观察不同实验阶段两组内部兔动脉粥样硬化斑块的发展变化以及同一实验阶段内两组间兔斑块发展的差异。我们发现,中期扫描显示对照组早期动脉粥样硬化斑块形成。晚期扫描显示对照组提示有血栓形成;PET图像中可见放射性摄取。组内前后匹配对比:与中期扫描相比,药物组内晚期扫描SUV值明显降低。与此相反,对照组内晚期扫描SUV值明显升高,两组间基线扫描SUV值差异无统计学意义。药物治疗组SUV mean呈现下降趋势,而对照组SUV mean呈现上升趋势,统计学差异具有显著统计学意义。这些发现进一步明确FDG摄取增加反映了炎症程度,同时也表明,PET/CT显像在检测动脉粥样硬化斑块炎症中的价值,这与先前的研究结果是一致的[8-10]。
除了定性及定量的评价斑块炎症, PET / CT成像还可以评估抗动脉硬化药物的作用。Tahara等[11]首次发现,低剂量的辛伐他汀能够降低斑块FDG摄取即降低了患者胸主动脉连续扫描SUV摄取值。在随后的研究[12]中,其他他汀类药物(例如阿托伐他汀)也表现出类似的降低FDG摄取的效应。Vucic等[21]研究了吡格列酮对新西兰兔的抗炎作用,研究结果显示:FDG摄取在吡格列酮组保持稳定,与此相反,对照组FDG摄取显著提高。在我们的研究中,研究结果与之前的研究结果也较为一致[13]。
我们在此研究中发现:吡格列酮可以显著降低动脉粥样硬化兔斑块破裂的发生率。斑块炎症程度的降低,FDG摄取值的下降,巨噬细胞密度的降低,新生血管计数的降低和血清炎症标记物的下降等可能是斑块破裂率下降的部分机制。我们的研究证实了吡格列酮在降低斑块炎症中的价值,这与Vucic等[13]研究结果一致。此外,我们进一步探讨了研究了斑块炎症程度的降低是否在机制上部分程度介导了吡格列酮治疗所引起的斑块破裂率的降低。Patel等[14]采用依折麦布在兔模型上也得到了类似的结果,他们通过依折麦布降低斑块负荷,结晶化和炎症水平观察到了斑块破裂和血栓形成的降低。
先前的研究表明,吡格列酮治疗降低炎症标记物的表达,如血浆中的CRP和动脉壁的MMP-9,导致LDL受体基因敲除小鼠模型动脉粥样硬化病变体积减小和炎症水平的降低[15-17]。在人类中,TZDs类药物也已经显示出对动脉粥样硬化病变的保护作用和对心血管事件的降低作用[18]。TZDs类药物减少2型糖尿病患者循环炎症介质水平,包括CRP,白细胞介素6(IL-6),CD40L,纤维蛋白原,MMP-9和单核细胞趋化蛋白1(MCP-1)[19]。我们的研究中也已在观察到类似的结果,药物组高敏CRP、MMP-9显著低于对照组。这表明吡格列酮稳定斑块的作用中降低促炎症标志物是一个重要方面。实验中发现两组之间的血糖水平没有显着差异。因此,吡格列酮对动脉粥样硬化兔的抗炎作用机制独立于其降血糖作用,这些结果与Mizoguchi 等[20]研究一致。
PPARγ也通过诸多免疫调节细胞如高度表达的巨噬细胞发挥抗炎作用。有证据显示吡格列酮可通过核因子kappa-B(NF-κB)介导通路降低如炎性细胞渗出等炎性反应[20]。在我们的研究中,吡格列酮组RAM-11染色巨噬细胞密度显著低于对照组。这也与先前的研究相一致。有研究表明,人类主动脉新生血管与主动脉斑块破裂独立相关[21]。实验性高胆固醇血症猪模型冠状动脉新生滋养血管能被他汀类药物所抑制[22]。在人类患者进行强化血脂治疗也可以显著减少外膜新生血管。先前的研究已经证实了吡格列酮对新血管形成的潜在作用。在本研究中我们的结果同样显示药物组CD31标记的新生血管计数较对照组显著降低。
综上所述,吡格列酮可以通过降低斑块炎性程度以减少斑块破裂率。PET/CT可有效进行成像监测及评价动脉粥样硬化斑块的炎症程度和评估抗动脉硬化药物的作用。
