响应面法优化紫球藻原生质体的制备
2018-10-22蒲洋丁涓彭炜航孙静王艳华
蒲洋,丁涓,彭炜航,孙静,王艳华
(1.鲁东大学 农学院,山东 烟台 264025;2.鲁东大学 生命科学学院,山东 烟台 264025; 3.山东博华高效生态农业科技有限公司,山东 滨州 256500)
自从紫球藻(Porphyridiumcruentum)这一原始单细胞红藻被从海水中分离培养之后,很多研究聚焦于开发利用其合成的大量高价值生物活性物质[1~4]。紫球藻中的藻胆蛋白、多不饱和脂肪酸和多糖等生物活性物质在医药、化妆品、材料等高端产业中有广阔的应用前景及潜在价值,但是高密度培养与采收技术限制了紫球藻价值的进一步开发利用[2]。借助基因工程和细胞工程技术改良藻种,或许是去除这个制约的有效手段。2013年公开了与紫球藻亲缘关系非常近的淡色紫球藻(Porphyridiumpurpureum)的全基因组序列,测得基因组大小为19.7 Mbp,共有8 355个预测基因,2016年报道了利用AFM对紫球藻光合系统的藻胆体-类囊体膜的超分子结构进行了卓有成效的研究,这一系列的理论研究有助于推进紫球藻生理及遗传育种研究[5,6]。
缺乏细胞壁和多糖外壳的原生质体是植物生理学、细胞学研究与遗传育种的良好材料,更是通过细胞融合和基因操作手段培育新品种的重要工具[7]。国内外学者对紫球藻原生质体酶解制备进行了相关研究,用纤维素酶和果胶酶组成的混合水解酶液,经单因素试验通过28 ℃水解4 h得到56.4%的原生质体制备率,并探讨了机械剪切力,以及细胞壁多糖组成对原生质体制备率的影响[8~10];但是对多个因素如何共同影响紫球藻原生质体制备的相关研究未见报道。应用Box-Behnken设计的响应面法(RSM),能够研究多个参数的组合效应[11,12]。本文针对紫球藻细胞壁的结构和成分,在EDTA和DTT混合溶液对藻细胞进行预处理的基础上,用含纤维素酶和果胶酶的混合酶液制备原生质体。考察酶液浓度、两种酶的比例和pH 3个参数,进一步优化紫球藻原生质体制备条件,提高紫球藻原生质体的制备率,用于满足后续基因工程和遗传育种研究的需要。
1 材料与方法
1.1 材料与试剂
紫球藻(Porphyridiumcruentum)藻种由中科院海岸带研究所提供,经烟台大学海洋学院分离纯化和筛选的纯种,F/2海水培养基培养。预处理剂:50 mmol·L-1EDTA、25 mmol·L-1DTT,渗透压稳定剂:0.2 mol·L-1KCl溶液,酶:纤维素酶(Cellulose R-10,Yakult Honsha)、果胶酶(Macerozyme R-10,Yakult Honsha),缓冲液:0.1 mol·L-1不同pH的磷酸钾缓冲液,除两种酶以外其他试剂均为分析纯,国药集团化学试剂有限公司;实验用水为去离子水。
1.2 仪器与设备
ZD-88台式恒温震荡培养摇床,金坛市城西天竟实验仪器厂;BXM-30立式高压蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;5430R高速冷冻离心机, Eppendorf公司;CX21光学显微镜,奥林巴斯;超净工作台,上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 混合酶液的配制与保存
将纤维素酶、果胶酶按照不同的量在0.2 mol·L-1KCl溶液中配制成不同浓度的混合酶解液,震荡使其混合均匀,并用一次性注射器过滤,放在冰箱中冷藏备用。
1.3.2 细胞收集和预处理
取对数期紫球藻藻液5 mL于离心管中,离心除去上清,用无菌水充分洗涤,重复2次。将藻细胞重新悬浮于50 mmol·L-1EDTA和25 mmol·L-1DTT的混合溶液中,在30 ℃下,轻微震荡。
1.3.3 分离纯化原生质体
将预处理后的藻细胞离心并去除上清,加入无菌水洗涤2次后,用混合酶液和不同pH(5.5、6.0、6.5、7.0、7.5)的缓冲液悬浮,轻微震荡使细胞壁酶解,每30 min在显微镜下观察酶解情况,酶解6 h后终止反应。离心收集细胞和原生质体,去除上层破碎的细胞壁、杂质及酶液,用高渗溶液洗涤。
1.3.4 原生质体制备率的计算
原生质体的数量等于悬浮于高渗溶液的细胞数量与悬浮于无菌水破裂的剩余细胞数量之差。因此得出原生质体制备率的公式:原生质体制备率=(高渗溶液中的细胞数目-无菌水中的细胞数目)/高渗溶液中的细胞数目×100%[12]。
1.3.5 混合酶浓度、酶比例和pH的选择
将纤维素酶、果胶酶以1∶1的比例按照体积分数分别为1%、1.5%、2%、2.5%、3%的量在0.2 mol·L-1KCl溶液中配制成不同浓度的混合酶解液,震荡使其混合均匀,加入到预处理后的藻细胞中,调节pH为7,酶解6 h终止反应,测定原生质体制备率。
将体积分数2%的纤维素酶和果胶酶按照3∶1、2∶1、1∶1、1∶2、1∶3的比例在0.2 mol·L-1KCl溶液配制成不同浓度的混合酶解液,震荡使其混合均匀,加入到预处理后的藻细胞中,调节pH为7,酶解6 h后终止反应,测定原生质体制备率。
将纤维素酶、果胶酶以1∶1的比例按照2%的体积分数在0.2 mol·L-1KCl溶液中配制成不同浓度的混合酶解液,震荡使其混合均匀,加入到预处理后的藻细胞中,调节pH分别为5.5、6.0、6.5、7.0、7.5,酶解6 h后终止反应,测定原生质体制备率。
1.3.6 响应面试验设计
采用Box-Behnken中心组合设计以X1(酶浓度)、X2(酶比例,纤维素酶:果胶酶)、X3(pH)为自变量,以Y(原生质体制备率%)为响应值的三因素三水平试验,中心组合试验方案中的因素及水平如表1所示。数据用 Design-Expert 8.0进行分析。分别选择各个因素中包含最高制备率的3个水平,即酶比例为2∶1、1∶1和1∶2,酶浓度为1.5%、2%和2.5%,pH为6.5、7.0和7.5,设计了三因素三水平的响应面试验,中心试验重复5次,共进行了17个试验,试验因素水平如表1。
表1响应面实验因素与水平
Table1 Factors and levels used in response surface experiments

变量Variables酶浓度/%Enzyme concentration酶比例Proportion of enzymepHpH-11.5 2∶16.502 1∶17.012.5 1∶27.5
2 结果与分析
2.1 不同酶解时间下的紫球藻
在酶解液中,细胞壁逐渐破碎,暴露出紫球藻的原生质体。如图1(b),明显可见破碎的细胞壁。由于失去了细胞壁,色素外渗,原生质体的颜色较正常的紫球藻细胞较浅。图1(a)和图1(c)分别为紫球藻细胞及其原生质体。
2.2 不同酶浓度、酶比例和pH对原生质体制备率的影响
如图2(a)所示,当混合酶浓度比较低时,随着酶浓度的增加原生质体的制备率也得到增加。酶浓度达到2%时,原生质体的制备率随着混合酶浓度的增加而下降。可能的原因是在特定浓度的藻液条件下,混合酶浓度较低时酶解反应不够充分,不能够将足量的藻细胞制备成原生质体;在较低混合酶浓度范围内原生质体制备率与酶浓度呈正相关。随着酶浓度的增加,一旦超出合适的范围过量的混合酶可能使已经制备出的原生质体发生破裂导致原生质体制备率降低[9]。因此,混合酶浓度在2.0%左右较为合适。

图2 紫球藻在不同酶浓度(a)不同酶的比例(b)和不同pH(c)条件下的原生质体制备率Fig.2 The protoplast formation rate of Porphyridium cruentum with different enzyme concentrations (a)different enzyme ratio (b) and different pH(c)
如图2(b)所示,当纤维素酶与果胶酶体积比降低时,随着果胶酶体积比的增加,原生质体的制备率也得到增加。纤维素酶与果胶酶体积比为1∶2时,原生质体的制备率最高,随着果胶酶体积比的增加而下降。这可能与特定培养条件下,紫球藻细胞壁多糖的复杂组成相关。结果表明本试验选用纤维素酶和果胶酶1∶2左右较为合适。
如图2(c)所示,随着pH值的增加,原生质体的制备率不断增加。pH达到7时,原生质体的制备率最高,随着pH值的进一步增加原生质体的制备率反而下降。这可能是因为pH 7左右是2种酶的最适pH,过高过低都会影响两种酶的活性,因此pH 7左右为宜。
2.3 响应面试验结果分析
利用Design-Expert 8.0软件的Box-Behnken设计,以酶浓度、不同酶的比例、pH值为变量,原生质体制备率(%)为响应值,进行响应面试验,结果如表2所示。对表2试验数据进行多元二次回归拟合,得到二次回归方程:
Y=55.10+5.19X1-0.075 X2+1.76X3-0.85X1X2-3.13X1X3-4.20X2X3-9.09X12-6.66X22-7.49X32
表2三因素独立变量的Box-Behnken试验设计
Table2 Box-Behnken experimental design with three independent variables

Run No.X1 X2 X3Y1(-1)(-1)(0)32.32(-1)(1)(0)31.23(1)(-1)(0)49.24(1)(1)(0)44.75(0)(-1)(-1)33.26(0)(-1)(1)46.27(0)(1)(-1)44.18(0)(1)(1)40.39(-1)(0)(-1)31.410(1)(0)(-1)43.211(1)(0)(1)39.412(-1)(0)(1)40.113(0)(0)(0)54.614(0)(0)(0)52.715(0)(0)(0)58.616(0)(0)(0)53.217(0)(0)(0)56.4
由表3可知,二次回归模型的F值为9.57,P值为0.003 42,表明模型达到了显著水平,失拟项P=0.125 8>0.05,说明失拟项差异不显著,试验无失拟因素存在,能充分反映试验真实情况,回归模型合理;试验模型的决定系数R2=0.933 4,说明原生质体制备率的结果与模型预测结果有较好的一致性,试验模型的校正系数R2Adj=0.847 8,试验结果有84.78%受试验因素的影响。因此,结果可靠,此模型可以对原生质体结果进行分析和预测。
回归方程各项方差分析中F检验可以判断自变量对因变量的影响,由此得到各因素对原生质体制备率影响的主次顺序为X1>X3>X2,即2种酶浓度对原生质体制备率的影响最大,其次是pH值,最后是两种酶的比例。
表3回归模型的方差分析
Table3 Analysis of variance(ANOVA)for the regression equation

方差来源Soruce of variation平方和Sum of squares自由度Degrees of freedem均方Mean squareF值F-valueP值Probe>F模型Significant1 211.889134.6510.900.002 4X1215.281215.2817.430.004 2X20.045 10.045 3.643 0.953 6X324.85124.852.010.199 0X1X22.8912.890.230.643 4X1X339.06139.063.060.118 6X2X370.56170.565.710.048 2X12347.721347.7228.150.001 1X22186.901186.9015.130.006 0X32236.051236.0519.110.003 3残差86.46712.35失拟差62.92320.973.560.125 8净误差23.5645.89总离差1 298.3616R2=0.933 4R2Adj=0.847 8
2.4 三维响应面分析
通过Box-Behnken试验得到的多元二次回归模型所作的响应面图,在其他试验因素固定不变的情况下,考察交互项对得率的影响,响应面分析图可用于评价试验因素对原生质体得率影响的两两交互作用[11,12]。各因素交互作用对响应值的影响如图3所示。
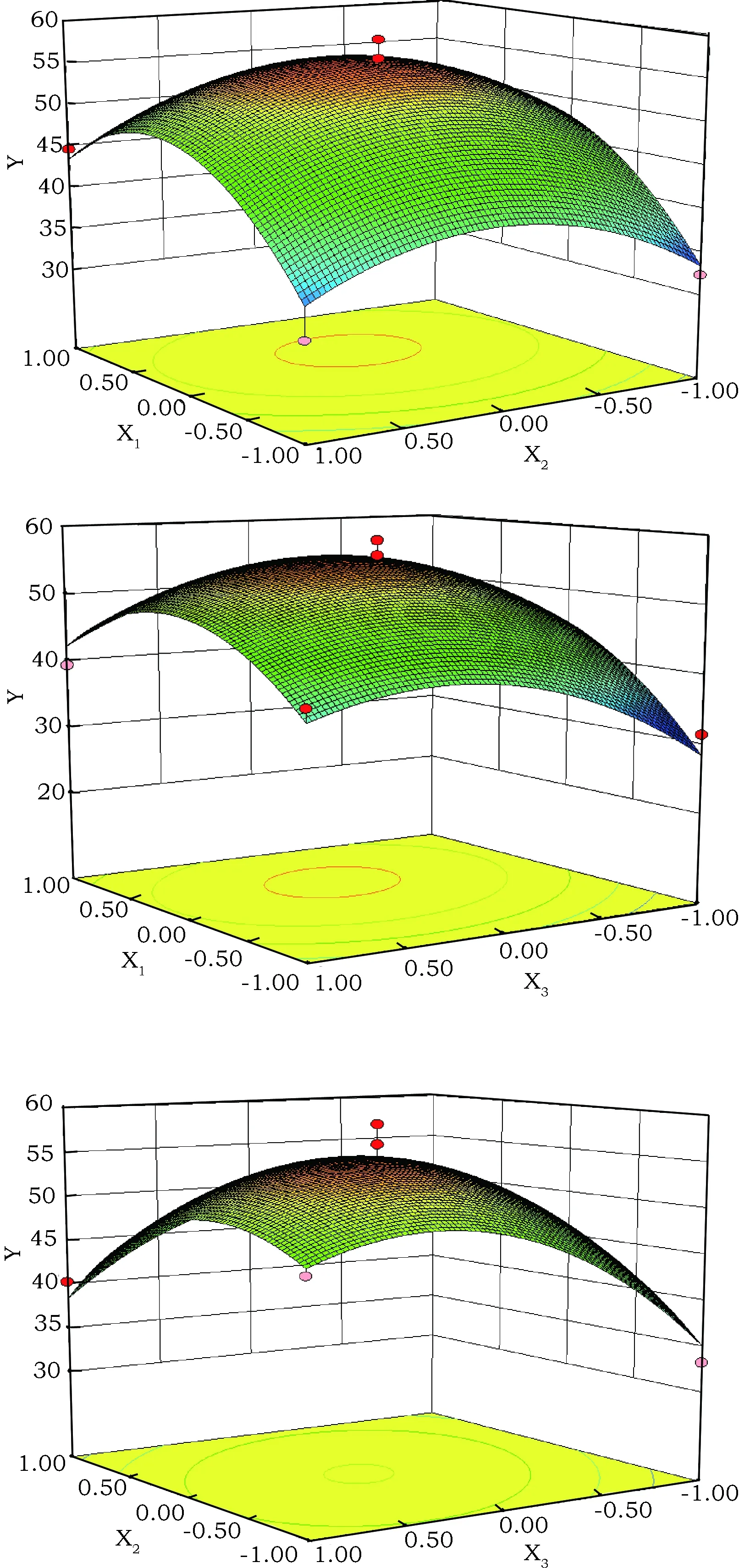
图3 通过表2得到最优Y值的三维响应面图Fig.3 Three dimensional contour plots for the maximum Y. RSM plots were generated using the data shown in Table 2
由响应曲面图3可知,随着酶浓度的增大,原生质体制备率含量也随之增加,但是当酶浓度增加到一定比例后,原生质体制备率不再增加反而下降。由响应曲面的陡峭程度可知,酶浓度影响非常显著,其次是pH,酶比例的变化对原生质体制备率的影响不明显。随着浓度和酶比变化的响应面趋势呈抛物线,出现极大值,并且曲面坡度较陡,说明两者之间存在交互作用,而曲面平缓,等高线稀疏,pH边几乎保持直线,说明pH与酶比例和pH与酶浓度之间交互作用不明显。
根据此二次回归模型,推测紫球藻原生质体的最佳制备条件理论值为:选2.17%酶浓度,纤维素酶与果胶酶比例为2∶3的混合液,渗透压稳定剂为0.2 mol·L-1KCl,在pH 7.2,30 ℃下轻微振荡,酶解6 h后计数所得的理论原生质体制备率为67.3%。将该条件微调为酶浓度2.2%、纤维素酶与果胶酶体积比2∶3,pH为7,进行实验验证,所得制备率为68.5%,相对误差为2%,与预测值相吻合。
3 讨论与结论
藻类原生质体制备的本质就是水解复杂的细胞壁多糖,另外紫球藻在生长过程中还分泌大量紫球藻多糖,在细胞外形成一层成分和结构复杂的黏质膜鞘;并且不同的培养条件对胞外多糖的种类和产量有较大影响,这就增加了其原生质体制备的难度和特殊性[10,13]。因此参考之前的报道用50 mmol·L-1EDTA、20 mmol·L-1DTT混合液进行预处理,变性其外壁层中的蛋白鞘,利用0.2 mol·L-1KCl作为渗透压稳定剂[9];在30 ℃下,通过轻微震荡使藻细胞和酶液混合均匀并充分接触,提供适当的机械剪切力促进原生质体释放[14];用Box-Behnken试验设计能够提供良好的精度和系统建模方法,通过尽可能少的实验确定了理论上靠近中心最优点的混合酶浓度、纤维素酶与果胶酶体积比例和pH值[15]。在这些最佳参数下,获得了最大为68.5%的制备率,为紫球藻生理生化研究,基因工程和遗传育种提供了良好的材料,紫球藻细胞壁及胞外多糖的具体组成及影响原生质体制备的详细机理有待于更加深入研究。
