外源NO及反向调控PEG胁迫下苜蓿萌发种子抗氧化酶及其同工酶动态的研究
2018-10-19辛夏青魏小红韩厅岳凯赵颖
辛夏青,魏小红,韩厅,岳凯,赵颖
(甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
紫花苜蓿(Medicagosativa)是一种多年生优质豆科草本植物,被誉为“牧草之王”,也是我国北方等地种植面积最大的人工牧草,其营养价值高、适口性好,是牛羊等牲畜的重要饲料[1]。在我国苜蓿产区水资源紧缺已成为苜蓿高产的主要限制性因素之一,西北地区种植的很多苜蓿品种抗旱能力普遍不高,在灌溉不足的条件下难获高产[2]。逆境胁迫使植物细胞质中活性氧(ROS)分子包括过氧化氢(H2O2)、超氧阴离子(O2-·)和羟自由基(·OH)等大量累积,使植物受到次级氧化胁迫,最终作用到细胞核的组氨酸激酶受体蛋白(HKT)上,导致膜脂、蛋白质和核酸等氧化损伤,改变细胞代谢,造成对植物的伤害[3-4]。为了降低和消除氧化胁迫,植物细胞内出现了抗氧化防御系统,包括由POD、SOD及CAT等组成的抗氧化酶系统[5]。已有研究表明较低浓度的NO对植物细胞具有保护作用,而较高浓度却表现为毒害效应[6-7]。研究发现0.1 mmol·L-1硝普钠(SNP)能有效缓解盐胁迫下紫花苜蓿的氧化损伤[8];外源NO能提高干旱胁迫下小麦(Triticumaestivum)幼苗叶片中SOD、POD 和CAT活性,降低超氧阴离子(O2-·)和过氧化氢(H2O2)水平,缓解膜脂过氧化,稳定生物膜的结构和功能[9]。同工酶是植物体内最活跃的酶之一,其合成和活性始终受到遗传基因的控制和调节。不良环境可能会引起基因变异使酶组分及其活性发生改变,而导致同工酶酶谱变化,这种改变反映在同工酶的谱带上,出现了不同数量及不同迁移率的谱带[10]。酶活性和同工酶结构从生理和分子2个水平上反映了紫花苜蓿抗氧化酶系统对干旱胁迫的响应机制。
目前关于外源NO及反向调控PEG(聚乙二醇6000)胁迫下苜蓿萌发种子抗氧化酶及其同工酶动态的研究未见报道。因此本试验用NO及其抑制剂c-PTIO[(2-(4-羧苯基)-4,4,5,5-四甲基咪唑啉-1-烃氧基-3-氧化钠盐)]处理PEG胁迫下紫花苜蓿种子,通过对抗氧化酶活性及同工酶组分的研究,探讨NO在干旱逆境中紫花苜蓿的抗旱性,旨在为紫花苜蓿的耐旱生理研究机制提供一定的科学依据。
1 材料与方法
1.1 实验材料与方法
供试材料为紫花苜蓿,品种为“三得利”,购买于甘肃省兰州永丰种子公司。千粒重2.0223 g。本试验于2016年11月至2017年6月在甘肃农业大学生命科学技术学院植物生理实验室进行。
种子萌发处理:本试验设6个处理,T1:CK(蒸馏水);T2:PEG(15% PEG);T3:SNP(0.1 mmol·L-1硝普钠);T4:PEG+SNP(15% PEG+0.1 mmol·L-1SNP);T5:c-PTIO(200 μmol·L-1c-PTIO);T6:PEG+c-PTIO (15% PEG+200 μmol·L-1c-PTIO)。挑选大小一致、饱满的紫花苜蓿种子用0.1%氯化汞溶液消毒5 min,蒸馏水冲洗5~6次。分别用蒸馏水、PEG、SNP、PEG+SNP、c-PTIO、PEG+c-PTIO浸泡苜蓿种子48 h,将种子置于垫有双层滤纸的培养皿(φ=9 cm)中,每皿50粒种子,每个处理重复3次,每个培养皿加处理液4 mL,24 h更换一次处理液。培养在(25±1) ℃,12 h光照/12 h黑暗条件下,分别在处理后的2、4、6、8 d取样,用于抗氧化酶及同工酶活性测定。
1.2 种子萌发中抗氧化酶活性的测定
酶液提取:称取不同处理的样品0.5 g,在冰浴条件下置于预冷过的研钵中,加入50 mmol·L-1pH 7.8的磷酸缓冲液(内含1%聚乙烯吡咯烷酮)5 mL研磨至匀浆,转入10 mL离心管,在4 ℃、10000 r·min-1条件下离心15 min,上清液即为酶液[11]。
过氧化物酶(POD)活性采用愈创木酚氧化法测定[11];超氧化物歧化酶(SOD)活性采用NBT显色法测定[12];过氧化氢酶(CAT)活性采用紫外吸收法测定[12]。
1.3 POD、SOD、CAT同工酶电泳
1.3.1酶液的制备 待种子处理第2、4、6、8天时分别称取紫花苜蓿0.5 g,放入研钵中加入提前预冷的样品提取液[含EDTA(乙二胺四乙酸)、PVP(聚乙烯吡咯烷酮)、pH 7.8磷酸缓冲液]5 mL,充分研磨,将研磨好的混合物进行低温高速离心(15000 r·min-1)15 min,保留上清液即为所需酶液,-20 ℃冰箱贮藏备用。
1.3.2聚丙烯酰胺凝胶电泳 1)样品处理。将酶液与样品处理液(蔗糖5 g+蒸馏水14.5 mL+0.1%溴酚蓝0.5 mL)1∶1混合,摇匀后静置备用。
2)聚丙烯酰胺凝胶电泳。采用垂直不连续聚丙烯酰胺凝胶电泳,略做优化[13-14],用核黄素为聚合引发剂替代过硫酸铵,在光照条件下30 min,凝胶即聚合。POD和CAT同工酶分离胶质量分数为7.5%,SOD同工酶分离胶质量分数为10%,浓缩胶质量分数均为3.75%。POD、SOD、CAT的上样量分别为15、20、35 μL,在4 ℃下进行电泳。浓缩胶时电压为80 V,电流为30 mA, 分离胶时电压为200 V,电流为45 mA,当溴酚蓝指示剂移至前沿时,停止电泳。
3)POD、SOD、CAT同工酶染色。POD同工酶染色:采用改良联苯胺法进行染色[14-15]。染色液:联苯胺溶液(0.8 g联苯胺,6 mL冰醋酸,加热至60 ℃溶解后加入34 mL蒸馏水),4% NH4Cl溶液,5% EDTA-Na2溶液,0.3% H2O2溶液,蒸馏水,按1∶1∶1∶1∶8比例混合。将蒸馏水漂洗过的凝胶放入POD染色液中,震荡5 min待酶带显出后,立即倒去染色液,用蒸馏水冲洗,7%醋酸中保存。
SOD同工酶染色:采用氮蓝四唑(NBT)法[13]。电泳结束后取出胶片,将胶片浸泡于染色液2.45 mmol·L-1NBT中,黑暗下浸泡20 min,再放入0.036 mol·L-1(pH值7.8)磷酸缓冲液(含0.028 mol·L-1TMEDA,28 μmol·L-1核黄素),避光浸泡20 min,蒸馏水漂洗,放入0.05 mol·L-1PBS (pH值7.8含0.1 mmol·L-1EDTA),日光灯下光照10~15 min,直至出现透明谱带,拍照。
CAT同工酶染色:参照胡能书等[13]的方法,用改良的FeCl3染色法。用重蒸水冲洗胶片1~2次,0.05% H2O2溶液浸泡10~15 min 后用重蒸水冲洗几次,再加入染色液(含有1%的氯化铁和1%的铁氰化钾),直到显带为止,照相。
1.4 数据分析
采用Excel 2007软件处理数据和绘图,SPSS 15.0软件进行统计分析,Photoshop软件剪辑电泳图,凝胶成像系统计算迁移率(Rf)。
2 结果与分析
2.1 外源NO及反向调控PEG胁迫下紫花苜蓿种子萌发中POD活性及其同工酶动态的研究
如图1所示,紫花苜蓿在萌发期POD活性呈逐渐上升趋势,第4天时增长明显,第6、8天增长趋于平缓。随PEG胁迫时间的延长,PEG处理POD活性逐渐增高,而PEG+SNP处理较PEG处理POD活性先升高后降低,第6天时PEG+SNP处理较PEG处理POD活性降低了32.72%,差异显著(P<0.05)。单独添加NO清除剂c-PTIO在第4天时作用最明显,c-PTIO比CK处理活性高了40.22%(P<0.05);而PEG胁迫下添加 c-PTIO在第8天时才抑制内源NO作用,PEG+c-PTIO处理较PEG相比POD活性提高了4.6%。图2所示,紫花苜蓿POD同工酶谱带在不同处理和处理时间上存在着明显的差异,其活性大小在表达量上也体现出差异。POD同工酶酶谱中共检测出11条酶带,随处理时间的延长POD酶带增多,第2天时只诱导1条P4酶带表达;第4天时酶带增加为9条。随处理时间延长酶带表达加强,第6、8天酶带颜色逐渐加深,表达量增多,活力明显加强。在第8、14、20泳道为PEG处理,10、16、22为PEG+SNP处理,PEG+SNP比PEG处理条带颜色浅。第6、8天分别有新酶带P10和P11产生。POD同工酶活性变化与其抗氧化酶活性相对应。
2.2 外源NO及反向调控PEG胁迫下紫花苜蓿种子萌发中SOD活性及其同工酶动态的研究
由图3可知,紫花苜蓿在萌发期SOD活性呈现逐渐增长变化趋势,在第4天时SOD活性增长明显,第6、8天时增长趋于平缓。第4天时PEG+SNP处理较15% PEG处理SOD活性升高了10.48%。NO抑制剂c-PTIO在第4天时抑制NO作用最显著, c-PTIO处理较CK相比SOD活性下降了16.71%(P<0.05); PEG胁迫下添加c-PTIO较PEG相比,SOD活性下降了8.34%,但在整个处理中差异不显著。由图4可知,在整个处理过程中紫花苜蓿SOD同工酶谱带呈现3条。迁移率为0.266的S3酶带随处理时间的延长颜色逐渐变浅直到消失。S1,S2酶带无明显变化,但颜色存在深浅差异,说明其酶活性表达量有差异。从电泳图谱可以看出第8天酶带表达量最弱,则表达量与处理时间呈负相关,随着处理时间的延长,表达量越来越少。

图1 外源NO及反向调控对PEG胁迫下紫花苜蓿萌发期POD活性变化的影响Fig.1 Effect of exogenous NO and reverse regulation on changes of POD activity in alfalfa during germination period under PEG stress 相同处理天数不同字母表示差异显著(P<0.05),下同。The different letters in the same treatment time mean significant differences at P<0.05, the same below.
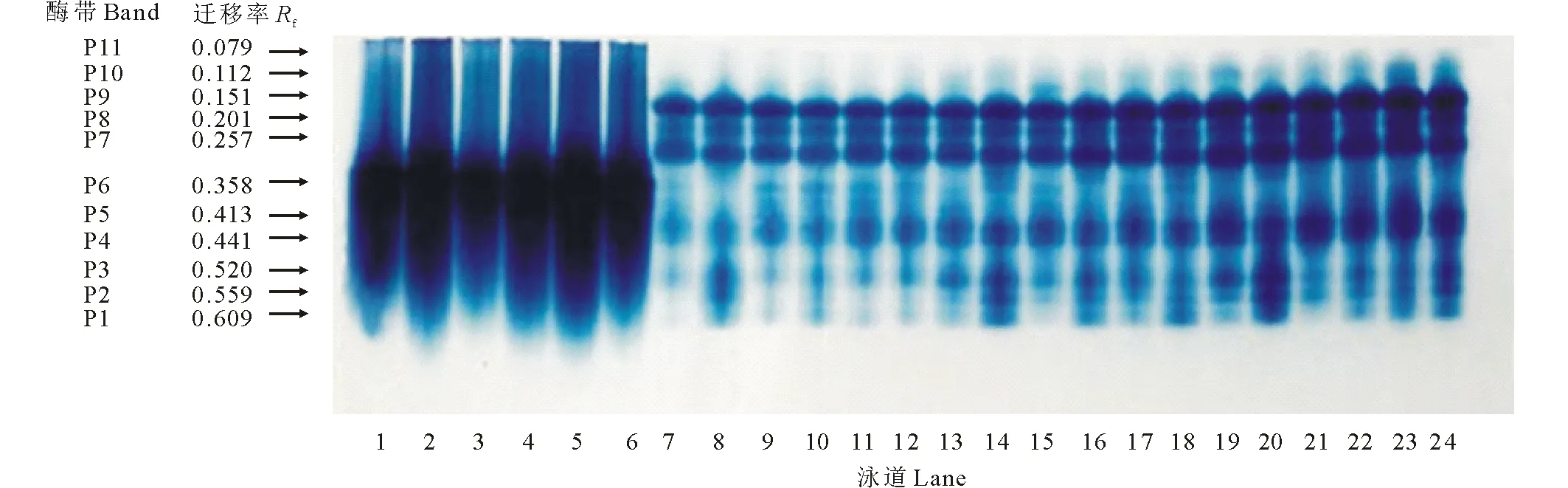
图2 外源NO及反向调控PEG胁迫下紫花苜蓿种子萌发过程中POD同工酶的电泳图谱Fig.2 Effects of exogenous NO and reverse regulation on the POD isoenzyme electrophoresis atlas of alfalfa germinating seeds under PEG stress 泳道1~6:处理2 d;泳道7~12:处理4 d;泳道13~18:处理6 d;泳道19~24:处理8 d。1、7、13、19为CK(蒸馏水)处理;2、8、14、20为15%PEG处理;3、9、15、21为SNP处理;4、10、16、22为PEG+SNP处理;5、11、17、23为c-PTIO处理;6、12、18、24为PEG+c-PTIO处理。按相对迁移率由大到小,酶带排序为P1,P2,P3,P4,P5,P6,P7,P8,P9,P10,P11。Lane 1-6: Treatment 2 d; Lane 7-12: Treatment 4 d; Lane 13-18: Treatment 6 d; Lane 19-24: Treatment 8 d. 1, 7, 13, 19 for CK (distilled water) treatment; 2, 8, 14, 20 for 15% PEG treatment; 3, 9, 15, 21 for SNP treatment; 4, 10, 16, 22 for PEG+SNP treatment; 5, 11, 17, 23 for c-PTIO treatment; 6, 12, 18, 24 for PEG+c-PTIO treatment. According to the relative mobility from big to small, the enzyme bands were ranked as P1, P2, P3, P4, P5, P6, P7, P8, P9, P10, P11.
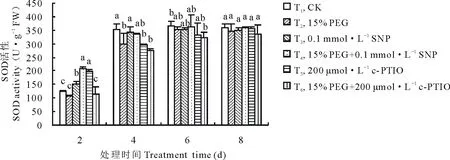
图3 外源NO及反向调控对干旱胁迫下紫花苜蓿萌发期SOD活性变化的影响Fig.3 Effect of exogenous NO and reverse regulation on changes of SOD activity in alfalfa during germination period under PEG stress
2.3 外源NO及反向调控PEG胁迫下紫花苜蓿种子萌发中CAT活性及其同工酶动态的研究
从图5可以看出,紫花苜蓿在萌发期CAT活性随PEG胁迫时间的延长呈现先增高后降低的变化趋势,各处理在第4天时CAT活性迅速上升并分别达到最大值,且各处理间差异最显著。第4天时PEG+SNP处理较PEG处理CAT活性增加了23.60%(P<0.05)。单独添加c-PTIO在第8天时抑制内源NO且较CK相比CAT活性降低了3.29%,但差异不显著。第6天时,PEG+c-PTIO处理与PEG处理相比,CAT活性降低了23.19%(P<0.05)。图6显示,通过CAT同工酶活性染色得到了2条不同的CAT同工酶条带,其相对迁移率分别为0.315和0.374。紫花苜蓿CAT同工酶在处理时间内不诱导新酶带产生,从第2天到第8天始终保持2条酶带,即C1和C2。各处理间酶带表达量基本相同。
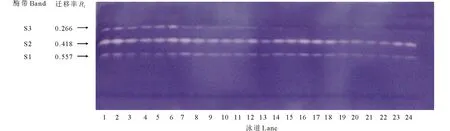
图4 外源NO及反向调控PEG胁迫下紫花苜蓿种子萌发过程中SOD同工酶的电泳图谱Fig.4 Effects of exogenous NO and reverse regulation on the SOD isoenzymeelectrophoresis atlas of alfalfa germinating seeds under PEG stress 泳道1~6:处理2 d;泳道7~12:处理4 d;泳道13~18:处理6 d;泳道19~24:处理8 d。1、7、13、19为CK(蒸馏水)处理;2、8、14、20为15%PEG处理;3、9、15、21为SNP处理;4、10、16、22为PEG+SNP处理;5、11、17、23为c-PTIO处理;6、12、18、24为PEG+c-PTIO处理。按相对迁移率由大到小,酶带排序为S1,S2,S3。Lane 1-6: Treatment 2 d; Lane 7-12: Treatment 4 d; Lane 13-18: Treatment 6 d; Lane 19-24: Treatment 8 d. 1, 7, 13, 19 for CK (distilled water) treatment; 2, 8, 14, 20 for 15% PEG treatment; 3, 9, 15, 21 for SNP treatment; 4, 10, 16, 22 for PEG+SNP treatment; 5, 11, 17, 23 for c-PTIO treatment; 6, 12, 18, 24 for PEG+c-PTIO treatment. According to the relative mobility from big to small, the enzyme bands were ranked as S1, S2, S3.
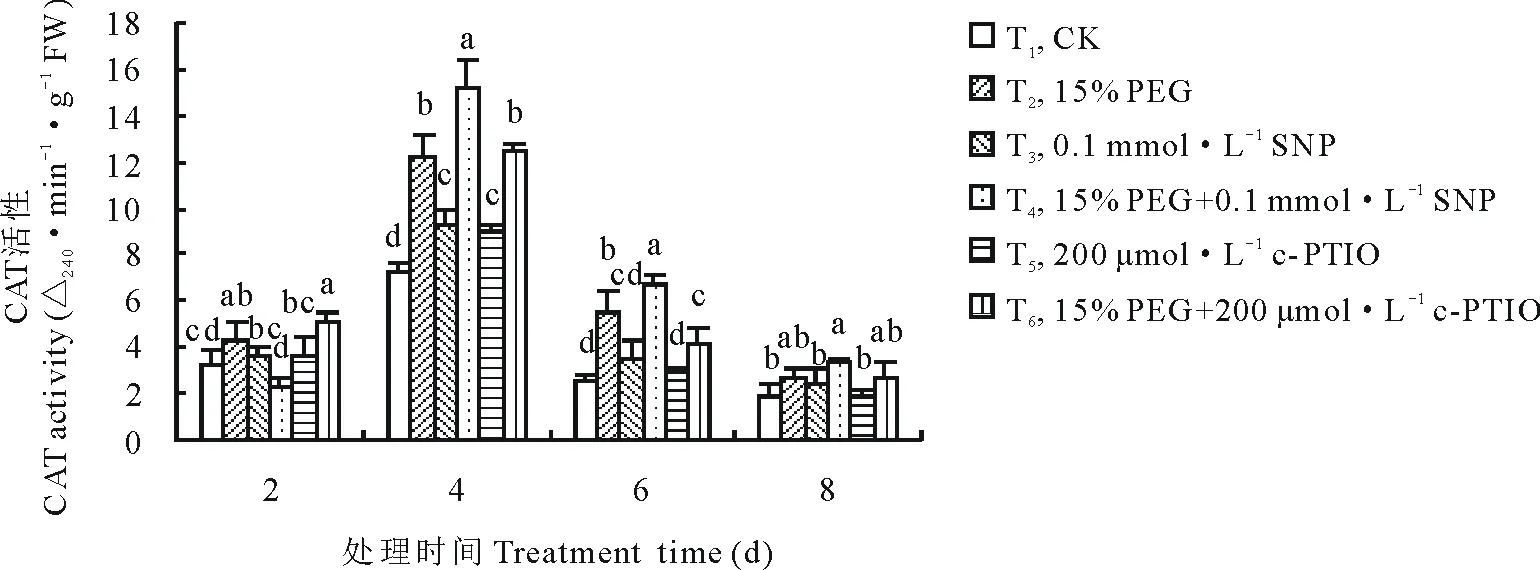
图5 外源NO及反向调控对PEG胁迫下紫花苜蓿萌发期CAT活性变化的影响Fig.5 Effect of exogenous NO and reverse regulation on changes of CAT activity in alfalfa during germination period under PEG stress

图6 外源NO对PEG胁迫下紫花苜蓿萌发过程中CAT同工酶电泳图谱Fig.6 Effects of exogenous NO and reverse regulation on the CAT isoenzyme electrophoresis atlas of alfalfa germinating seeds under PEG stress 泳道1~6:处理2 d;泳道7~12:处理4 d;泳道13~18:处理6 d;泳道19~24:处理8 d。1、7、13、19为CK(蒸馏水)处理;2、8、14、20为15%PEG处理;3、9、15、21为SNP处理;4、10、16、22为PEG+SNP处理;5、11、17、23为c-PTIO处理;6、12、18、24为PEG+c-PTIO处理。按相对迁移率由大到小,酶带排序为C1,C2。Lane 1-6: Treatment 2 d; Lane 7-12: Treatment 4 d; Lane 13-18: Treatment 6 d; Lane 19-24: Treatment 8 d. 1, 7, 13, 19 for CK (distilled water) treatment; 2, 8, 14, 20 for 15% PEG treatment; 3, 9, 15, 21 for SNP treatment; 4, 10, 16, 22 for PEG+SNP treatment; 5, 11, 17, 23 for c-PTIO treatment; 6, 12, 18, 24 for PEG+c-PTIO treatment. According to the relative mobility from big to small, the enzyme bands were ranked as C1, C2.
3 讨论
3.1 外源NO及反向调控对PEG胁迫下紫花苜蓿萌发中种子抗氧化酶活性的影响
种子萌发期是植物生活史中的重要阶段,也是进行植物抗旱性研究的重要时期[16]。NO作为一种信号分子和活性氧清除剂,能调节植物对生物和非生物胁迫的适应及反应[17]。植物的保护酶体系在缓解胁迫方面起着重要作用,它可以清除体内的活性氧,以避免过量活性氧对植物的伤害[18]。一般来讲,干旱胁迫下植物体内POD等酶的活性与植物抗氧化胁迫能力呈正相关。姜义宝等[19]研究发现,NO能明显缓解干旱胁迫造成的氧化损伤,提高了苜蓿叶片叶绿素含量和光合能力,增强了苜蓿的抗旱性。本试验结果表明,外施SNP可提高抗氧化酶POD、SOD、CAT活性和缓解PEG胁迫下紫花苜蓿的氧化损伤。在干旱条件下外源添加0.1 mmol·L-1SNP时,紫花苜蓿的POD活性降低,第6天时最显著;而SOD、CAT活性都表现为增加,在第4天时,SOD和CAT活性增加较显著。NOS(nitric oxide synthase)和NR(nitrate reductase)是植物体内源NO的最主要来源,但仍存在争议[20]。为明确苜蓿根系内源NO的来源和其对苜蓿根系耐旱性的影响,本试验用NO 特异清除剂c-PTIO处理紫花苜蓿种子。结果表明,在PEG胁迫下添加NO特异清除剂较PEG处理相比,可提高POD活性,降低了SOD及CAT活性,说明c-PTIO可抑制紫花苜蓿种子萌发的内源NO。表明依赖于NOS活性或NR活性产生的内源NO也参与干旱胁迫下苜蓿萌发耐旱性的调节。
3.2 外源NO及反向调控对PEG胁迫下紫花苜蓿萌发中种子抗氧化酶同工酶活性的影响
同工酶是具有催化相同的化学反应,但其理化性质、蛋白质分子结构等有明显差异的一组酶。植物随自身生长和外界环境的改变,同工酶谱带会发生相应的变化。逆境胁迫可导致抗氧化同工酶的改变[21],本试验结果表明,PEG胁迫下紫花苜蓿种子萌发期的POD同工酶表达在谱带数及表达量上都发生了明显的变化,具体表现为处理第4天时酶带明显增多至9条,第6、8天仍有新酶带产生,且随着处理时间的延长POD酶带表达量逐渐增多。PEG处理较PEG+SNP处理同工酶表达量多,这说明植物受到胁迫后酶组分及其活性发生改变以适应不良环境,但由于防御措施的加强,最终导致POD酶带数及其表达量相应增加[22]。SOD在控制脂质过氧化和防止膜系统受伤等方面有一定的保护作用,与植物的抗旱性有关[23]。PEG胁迫下不影响SOD同工酶带数但影响其活性,随着处理时间的延长,SOD同工酶S3表达量逐渐减弱,直到第8天时几乎消失,这与莫饶等[24]的研究一致。栗淑媛等[25]的研究发现,CAT等抗氧化酶的同工酶表达与植物的胁迫适应和进化水平有密切的关系。不同的同工酶基因对不同程度逆境胁迫的表达响应不同[26]。与酶活性变化对应,紫花苜蓿CAT同工酶在PEG胁迫下表达量微弱,可能是由于干旱胁迫对紫花苜蓿萌发期CAT同工酶表达严重胁迫,无法通过CAT同工酶表达量增加来抵御,这与鲁振强[27]的研究相一致。
