二甲双胍对肝癌细胞HepG2中人类白细胞抗原-Ⅰ类分子表达的影响
2018-10-16胡腊冯笑陈纪涛刘兆宇翁锦生李晓媚曾子成刘季芳
胡腊 冯笑 陈纪涛 刘兆宇 翁锦生 李晓媚 曾子成 刘季芳
广州医科大学附属第五医院(广州 510700)
人类白细胞抗原(human leucocyte antigen,HLA)几乎在所有有核细胞中表达,主要在细胞间相互识别、抗原提呈及免疫应答中具有重要作用。HLA⁃I除了参与肿瘤细胞的免疫监视及免疫逃避外,对由T细胞介导的肿瘤治疗也有严重影响[1]。有文献报道[2]HLA⁃I在人体多种肿瘤组织中均表达降低,促进癌细胞逃避T细胞介导的免疫监视;此外HLA⁃I表达降低会抑制细胞毒性免疫机制的激活,进而影响以T细胞活化为基础的肿瘤治疗效果[3]。
流行病学研究表明,二甲双胍能够降低2型糖尿病患者患癌症的风险[4]。在非免疫缺陷型的白血病老鼠模型中,二甲双胍能够增加CD8+肿瘤浸润性淋巴细胞(TILs)的数量,并保护细胞免于衰竭和凋亡,进而发挥其免疫介导的抗肿瘤效应[5]。此外,二甲双胍可通过激活AMPK途径而杀死结肠癌[6]、骨髓瘤和乳腺癌的癌细胞。
研究发现,二甲双胍可通过改变乳腺癌细胞的能量代谢,增加乳腺癌细胞表面HLA⁃I的水平,进而降低肿瘤细胞逃避机体免疫监视的能力[7]。那么,二甲双胍是否可通过影响肝癌细胞中HLA⁃I及其亚型的表达进而发挥其免疫介导的抗肝癌效应?目前尚未有相关文献报道,因此本文就这一科学问题展开研究,主要通过观察不同浓度的二甲双胍对肝癌细胞中HLA⁃I类分子(HLA⁃E、HLA⁃A2402和β2⁃M)的影响,初步探讨二甲双胍抗肝癌的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞株人肝癌细胞株HepG2购自中国科学院细胞库,细胞使用RPMI1640培养基(内含10%胎牛血清),在37℃、5%CO2培养箱中常规培养。
1.1.2 试剂二甲双胍购自德国Sigma⁃Aldrich;Human HLA class I PE⁃conjugated Antibody购买自R&D Systems公司;磁珠购自BD公司;Trizol购自Invitrogen公司;反转录试剂盒、RT⁃PCR试剂盒购自Takara;RPMI1640培养基、胰蛋白酶、胎牛血清及PBS购自美国Glibco公司。
1.1.3 主要仪器流式细胞仪(BD FACSCantoⅡTM);实时荧光定量PCR仪(ABI7500);双模块PCR仪(伯乐S100048/48双模);多功能酶标仪(美国BioTEK);倒置荧光显微镜(莱卡DMi8);恒温水浴锅(德国Thermo Scientific);水平层流超净工作台(德国Thermo Scientific Hohen)。
1.2 实验方法
1.2.1 细胞培养将培养基、血清、胰酶、PBS、培养皿等物品放入超净台中并打开紫外灯灭菌30 min;预先打开水浴锅开关并设置温度为37℃,待水浴锅温度升至37℃后将细胞从液氮罐中取出后迅速在水浴锅中不断摇晃至冻存液完全融化,然后将其转移至加有8 mL培养基(RPMI 1640+10%FBS)的培养皿中,并吹打混匀,然后将细胞置于37℃、5%CO2的恒温恒湿箱中培养,定时对细胞进行换液和传代。
1.2.2 药物处理取对数生长期的HepG2细胞,用PBS洗涤细胞两遍,用0.25%的胰酶充分消化细胞后,用含血清的培养基终止消化并吹打混匀后均匀接种于两块六孔板中,放入37℃、5%CO2的恒湿箱中培养过夜,次日上午对照组中加入0 mmol/L二甲双胍的不含胎牛血清的RPMI 1640培养基,实验组中分别加入含0.5、1、2、5、10 mmol/L二甲双胍的无血清的RPMI1640培养基,同时另外两孔中加入25、50 ng/mL的干扰素(interferon,IFNγ)作为阳性对照,将处理后的细胞放入培养箱中培养24 h后根据实验需要做相应处理。
1.2.3 流式样本制备(1)细胞准备:①取预先处理好的对数生长期的六孔板细胞,用PBS洗两次后每孔加入100 μL胰酶进行消化;②待消化充分后加入2 mL培养基终止消化并吹散混匀,将吹散好的细胞转移到15 mL离心管中做好标记并离心(300 g/5 min);③弃去上清,加入一定量PBS洗涤后离心(300 g/5 min),再弃去上清,加入0.5 mL PBS后将细胞轻轻混匀。(2)染色上机:①从上述离心管中各取50 μL的细胞于相应流式管中并标注为处理组,向各流式管中加入对应的荧光素标记抗体HLA⁃ABC抗体(每种5 μL(抗体及细胞比例为1∶10)后混匀),室温避光孵育25 min(孵育过程中再混匀一次);②从上述离心管中各取50 μL的细胞于相应流式管中并标注为对照组,对照组不加染料(抗体);③除了上述两大组(处理组和对照组)样本外,尚有2管用来调补偿的样本:细胞量同上50 μL,向其中一管加入HLA⁃ABC抗体,第2管内只有细胞;④染色完成后加入1 mL的PBS洗涤细胞,离心 300 g/5 min;⑤弃去上清,加入 600 μL PBS重悬、混匀细胞,上机检测。
1.2.4 Real⁃time PCR检测用Trizol法提取细胞总RNA,采用逆转录试剂盒将RNA在逆转录酶的作用下反转录为cDNA。目的基因β2⁃M、HLA⁃E和HLA⁃A2402及内参GAPDH的引物见表1,实时荧光定量PCR在7500 Software v2.3仪器上进行。根据实时荧光定量PCR中Ct值计算出△Ct值,采用相对定量2-△Ct法比较目的基因mRNA的表达差异,PCR中每个样本均重复3次,取其平均值。

表1 所检测目的基因及其引物序列Tab.1 The detected target genes and its primer sequence
1.3 统计学方法所有实验至少重复3次,数据采用SPSS 16.0软件进行分析,数据以表示,两组间比较采用方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 二甲双胍对HepG2细胞内HLA⁃I mRNA表达水平的影响HepG2细胞经不同浓度二甲双胍或IFNγ(阳性对照)刺激24 h后,RT⁃PCR 检测 β2⁃M、HLA⁃E、HLA⁃A2402表达水平,与对照组(0 mmol/L)相比,0.5、2、5、10 mmol/L二甲双胍处理均能提高肝癌细胞HepG2中β2⁃M、HLA⁃E、HLA⁃A2402 mRNA表达水平,且5和10 mmol/L二甲双胍处理后,β2⁃M mRNA表达水平分别提高了2和2.6倍(图1);HLA⁃E mRNA表达水平分别提高了1.8和2倍(图2);HLA⁃A2420 mRNA表达水平分别提高了1.6和1.9倍(图3),且上述变化差异均有显著性(P<0.01),表明二甲双胍处理能提高肝癌细胞HepG2中HLA⁃I mRNA的水平。
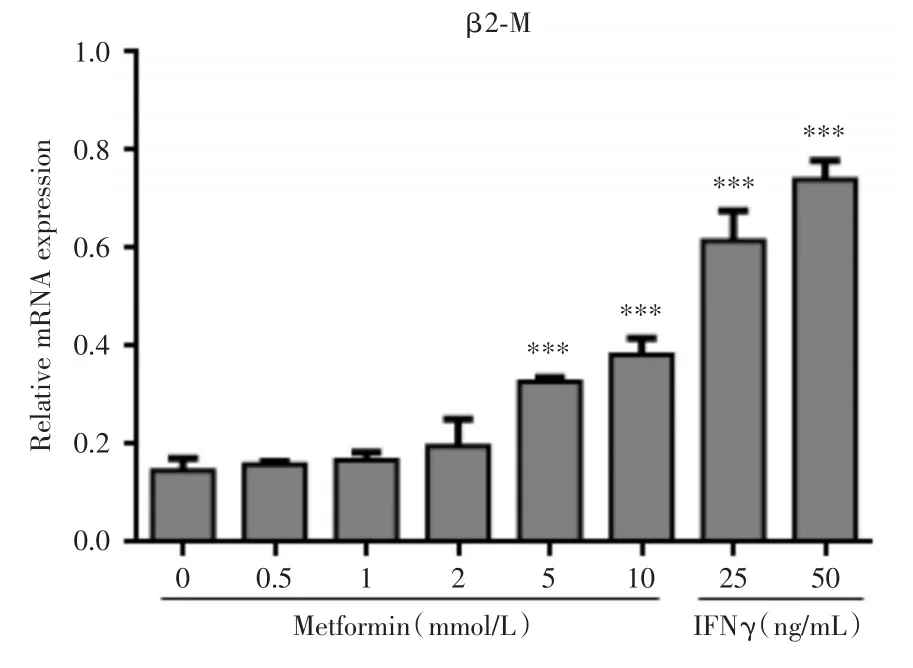
图1 RT⁃PCR检测二甲双胍及干扰素处理后HepG2中β2⁃M的表达情况Fig.1 Expression of β2⁃M mRNA in HepG2cell line treated by metformin and interferon
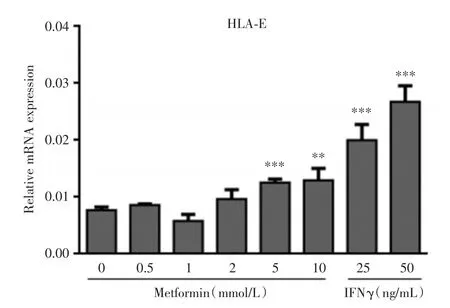
图2 二甲双胍及干扰素处理后HLA⁃E表达水平的变化Fig.2 Changes of HLA⁃I mRNA levels in HepG2cells treated with metformin and interferon
2.2 二甲双胍对HepG2细胞膜表面HLA⁃I蛋白表达的影响经不同浓度二甲双胍或干扰素处理HepG2细胞24 h后,按照规范的实验方法制作样本进行流式上机检测。结果显示,与对照组(0 mmol/L)相比,实验组不同浓度二甲双胍(0.5~10 mmol/L)并不影响细胞膜表面HLA⁃I的情况(P>0.05,图4)。
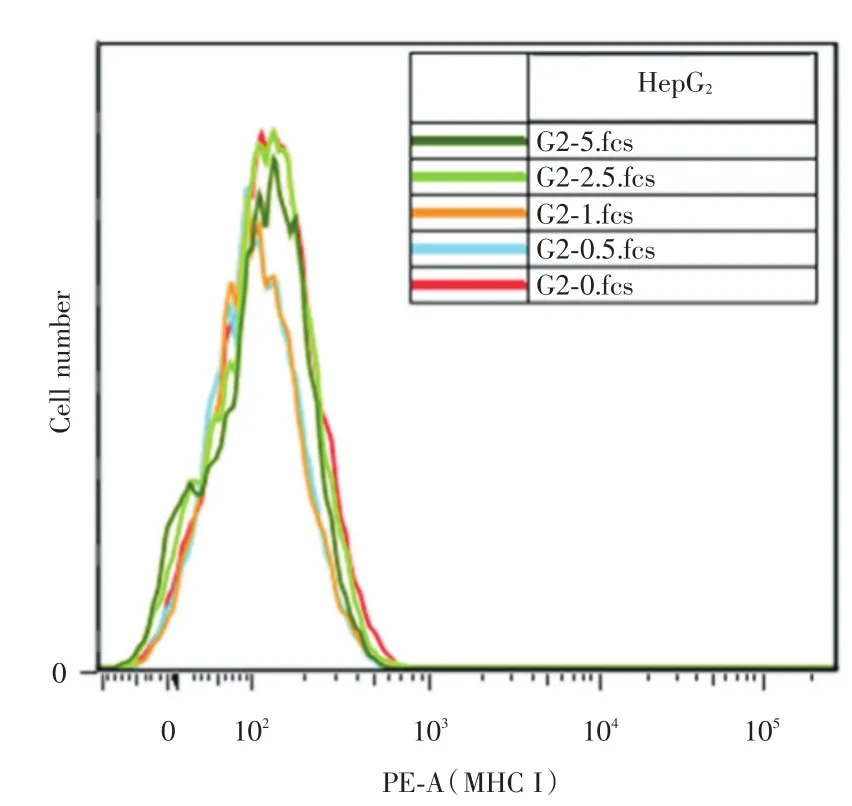
图4 二甲双胍处理后HepG2细胞表面HLA⁃I水平变化Fig.4 The effect of metformin on HLA⁃I on the surface of HepG2cells
3 讨论
2005年1份流行病学报告显示,服用二甲双胍的糖尿病患者肿瘤发病率明显低于服用其他降糖药物的患者[8]。近年来大量研究发现,二甲双胍对患有肝癌、大肠癌、胰腺癌、胃癌及食管癌的糖尿病患者具有保护作用[9]。2013年来二甲双胍与肿瘤的临床试验也相继展开。文献报道[10],二甲双胍有望能够改善乳腺癌的继发性内分泌耐药;二甲双胍能够通过LKB1⁃AMPK⁃mTOR通路抑制肿瘤的生长[11]。本课题组前期研究发现,二甲双胍可显著降低肝癌细胞线粒体的活性[12],且二甲双胍能够通过激活AMPK诱导肝癌细胞衰老[13],二甲双胍与 5⁃FU 联合应用对人结肠癌细胞具有协同抑制作用[14]。此外有研究发现[5]二甲双胍能够通过增加CD8+肿瘤浸润性淋巴细胞(TILs)的数量,保护细胞免于衰竭和凋亡,进而发挥其免疫介导的抗肿瘤效应。这些研究都表明二甲双胍具有抗肿瘤的作用,其可能成为一种新的治疗肿瘤的手段,但目前对二甲双胍抗肿瘤的具体机制尚不完全明确。
有研究表明,在人体黑色素瘤中,HLA⁃I水平越低,其体内实验中细胞的致瘤性更强,体外实验中细胞的增殖率、转移能力及侵袭力更高[15]。HLA⁃I的下调会减弱肺癌免疫治疗的临床效果[16],此外HLA⁃I的下降和缺失会与肿瘤的侵袭及转移有关,且HLA⁃I的水平越低,疾病的预后越差。但与正常细胞相比,癌细胞表面HLA⁃I水平明显降低,严重影响癌症患者免疫治疗的效果,这也成为癌细胞逃避免疫细胞攻击和清除的重要诱因。而在黑色素瘤中通过转染HLA⁃A2使HLA⁃I水平升高,可以逆转由 HLA⁃I降低引起的高致瘤性[15]。可见通过逆转肿瘤细胞表面HLA⁃I表达水平,对寻找肿瘤治疗的新靶点及新方法具有重要意义。
本研究首次着眼于探索二甲双胍对HLA⁃I所介导的免疫机制对肝癌的影响,研究中发现,5和10 mmol/L二甲双胍可以显著提高β2⁃M、HLA⁃E、HLA⁃A2402 mRNA水平,可见二甲双胍能够在转录水平影响HLA⁃I表达。虽然流式结果表明,二甲双胍对细胞表面经典的HLA⁃I蛋白表达无明显影响,但HLA⁃I的功能是与抗原结合后,将抗原递呈给肿瘤反应性细胞毒性T淋巴细胞,因此当环境中缺少抗原时,HLA的功能不能正常发挥,无法在细胞膜上检测到HLA⁃I的明显变化。且HLA⁃I的功能不仅受蛋白表达水平影响,也受抗原加工递呈(antigen⁃processing machinery,APM)分子的影响[15],所以二甲双胍除了调节HLA部分亚型的mRNA表达水平外,也可能通过APM分子间接影响MHC⁃I的抗原递呈功能,从而提高肿瘤细胞的抗原性和免疫原性,增强机体对肿瘤细胞免疫监视。此外,二甲双胍在转录水平上显著提高HLA⁃I轻链及部分重链分子的水平,却未在蛋白水平检测到类似的改变,推测HLA⁃I可能受到翻译及翻译后修饰的调节。
本研究的实验环境中缺乏抗原,这也可能是仅有部分亚型的HLA发生显著变化的原因,因此,为了更深入研究二甲双胍对肝癌细胞中HLA⁃I转录、翻译、翻译后修饰及功能的影响,笔者拟用有效浓度的二甲双胍处理肝癌HepG2细胞,再用抗原肽刺激该细胞,通过检测细胞表面抗原肽的表达水平等进一步探讨二甲双胍抗肝癌的免疫学机制。
