晶V型芒果苷对高尿酸血症小鼠的作用及其机制研究
2018-10-13杨海光周启蒙王海港赵晓悦方莲花杜冠华
杨海光,周启蒙,王海港,程 笑,赵晓悦,吕 扬,方莲花,杜冠华
(中国医学科学院北京协和医学院药物研究所 1. 北京市药物靶点研究与新药筛选重点实验室、2. 北京市晶型药物研究重点实验室,北京 100050)
高尿酸血症是由于机体内尿酸合成或排泄失衡,造成的一种代谢性疾病。《高尿酸血症和痛风治疗的中国专家共识》指出,随着我国人民生活水平的提高,我国高尿酸血症逐年上升,特别是在经济发达的城市和沿海地区,患病率达到5%~23.5%[1]。高尿酸血症也是痛风发病的关键因素[2]。目前,已上市治疗高尿酸血症的药物主要有黄嘌呤氧化酶抑制剂、尿酸转运体抑制剂、重组尿酸酶补充剂等几大类,但是其不良反应和肝肾毒性均较大。
芒果苷(mangiferin,2-β-D-吡喃葡萄糖苷-1,3,6,7-四羟基-9H-氧杂蒽酮),又称知母宁、芒果素,主要从漆树科和龙胆科植物的叶、茎、果实、树皮中提取得到,也是中药知母的主要活性成分[3]。芒果苷作为药用植物中提取的单一化合物,具有多种药理学活性。近年来,已有多篇论文报道了芒果苷的降尿酸作用。本研究采用固体灌胃方式给予晶V型芒果苷后,从脏器指数、生化指标、肾脏病理变化方面,探讨其对高尿酸血症小鼠的治疗作用,从尿酸转运体相关基因方面探讨其治疗作用机制。
1 材料
1.1实验动物SPF级昆明种♂小鼠70只,体质量(20±2)g,购自北京市华阜康生物科技股份有限公司,许可证号:SCXK 2014-0004。饲养于12 h照明、温度(25±2)℃环境中。
1.2试剂晶V型芒果苷(中国医学科学院药物研究所晶型中心提供);氧嗪酸钾(oteracil potassium)、别嘌呤醇(allopurinol, AP);苯海岸马隆(benzbromarone,BR)均购自Sigma公司;羧甲基纤维素钠(CMC-Na)、TRIzol(Thermo Fisher Scientific公司);反转录试剂盒(RR037Q)、实时荧光定量试剂盒(RR820Q),均购自TaKaRa公司;尿酸(uric acid,UA)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CRE)、低密度脂蛋白(low density lipoprotein,LDL)测定试剂盒,高密度脂蛋白(high density lipoprotein,HDL)测定试剂盒,均购自中生北控生物科技股份有限公司;黄嘌呤氧化酶(xanthine oxidase,XO)检测试剂盒(南京建成生物工程研究所)。
1.3仪器TBA-40全自动生化仪(日本东芝公司);EclipseTi-U荧光显微镜(日本尼康公司);小鼠固体给药系统(中国医学科学院药物研究所国家药物筛选中心研制)[4];实时荧光定量PCR仪(Bio-Rad公司);微量紫外/荧光核酸测定仪(DeNovix公司);低温高速离心机(Beckman公司);金属浴(杭州奥盛仪器有限公司);24孔样品研磨均质匀浆仪(OMNI公司)。
2 方法
2.1动物分组、给药和造模将小鼠随机分为7组:正常对照组(Control)、模型组(Model)、别嘌呤醇组(AP,25 mg·kg-1)、苯溴马隆组(BR,25 mg·kg-1)、晶V型芒果苷低、中、高剂量组(10、30、100 mg·kg-1),每组10只。正常对照组每天腹腔注射CMC-Na溶液,其他各组每天下午腹腔注射氧嗪酸钾CMC-Na混悬液(300 mg·kg-1)。连续造模7 d后,d 8起每天上午灌胃给予各组相应药物,其中晶V型芒果苷各剂量组通过固体给药方法灌胃,下午继续腹腔注射氧嗪酸钾混悬液,连续给药14 d。在末次给予氧嗪酸钾1 h后,每组取部分小鼠称重后摘眼球取血,解剖取肝脏、双侧肾脏称重,立即放入液氮中,再转移至-80 ℃冰箱,备用。其余小鼠4%多聚甲醛灌流,取肾,4%多聚甲醛固定,备用。
2.2脏器指数、血清生化指标、肝脏XO活性测定脏器指数为自身组织重量与自身体质量的比值。全血7 000 r·min-1离心10 min,分离血清,全自动生化分析仪测定UA、ALT、AST、BUN、CRE、LDL、HDL。取肝组织,加入适量预冷生理盐水,全自动匀浆器匀浆,4 ℃、12 000 r·min-1离心40 min,重复2次,取上清,12 000 r·min-1再次离心10 min,取上清,按试剂盒说明书测定肝XO活性。
2.3肾组织苏木精-伊红(HE)染色组织从低到高浓度乙醇脱水,二甲苯浸泡,石蜡包埋,切片成7 μm厚的组织样本。染色前,二甲苯脱去切片石蜡,用从高到低的浓度的乙醇浸泡,去离子水浸泡。HE染色,再脱水、透明、中性树胶封固。显微镜下观察并统计。
2.4RT-qPCR检测肾、肠尿酸转运体mRNA、肝XOmRNA的表达参考文献并查询NCBI,利用Pubmed中Pick Primer在线软件挑选引物,并对产物进行Blast,确保扩增基因特异性(Tab 1)。取50~100 mg肾脏、肝脏、结直肠组织到研磨管中,每管加入1 mL TRIzol,并低温研磨提取总RNA。取1 μL总RNA,测定纯度和浓度。总RNA定量2 μg加入反转录体系(5×Prime Script Buffer 2 μL,RrimeScript RT Enzyme Mix 0.5 μL,Oligo dT Primer 0.5 μL,Random 6 mers 0.5 μL,DEPC水定量至20 μL),37℃反转录15 min,85℃ 5 s。取反转录产物2 μL,加入实时荧光定量体系(SYBR Premix Ex Taq II 12.5 μL,PCR上、下游引物各1 μL,无菌dH2O 8.5 μL),95℃ 30 s,95℃ 5 s,60℃ 30 s,40个循环。采用2-△△t相对定量法统计。
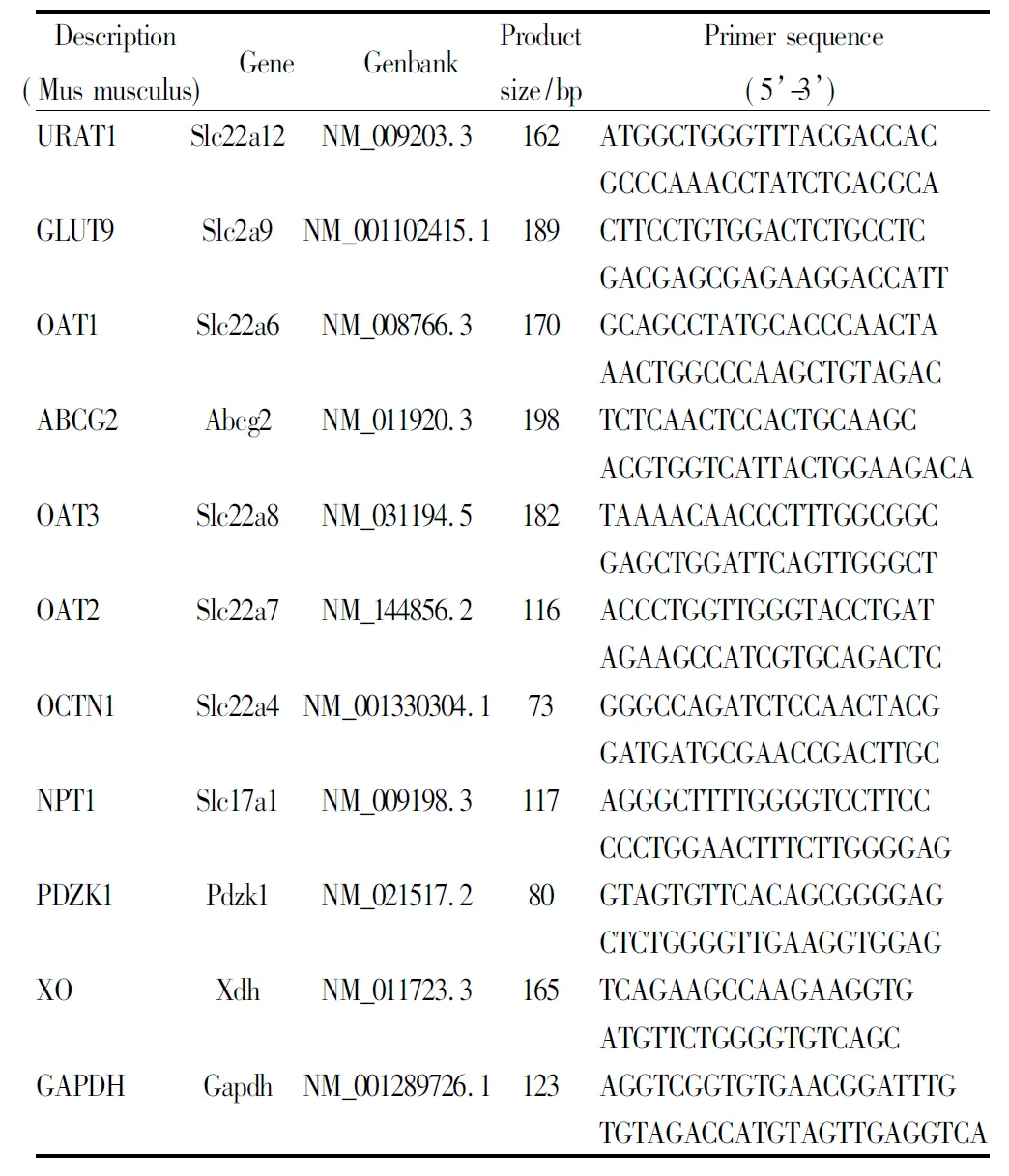
Tab 1 Primer sequence used in real time PCR analysis

3 结果
3.1晶V型芒果苷对高尿酸血症小鼠脏器指数的影响Tab 2结果显示,与正常组比较,阳性药BR组小鼠肝脏指数明显增高(P<0.01),而晶V型芒果苷各剂量组肝脏指数正常。与正常组比较,阳性

Tab 2 Effect of mangiferin (crystalⅤ) on visceral index in hyperuricemia mice induced by potassium n=10)
##P<0.01vscontrol
药AP和BR组肾脏指数均有所升高,提示两种阳性药对肾脏可能有一定的影响,而晶V型芒果苷各剂量组肾脏指数正常。晶V型芒果苷低剂量组的脾脏指数明显增大(P<0.01),其他各组对脾脏指数无明显影响。
3.2晶V型芒果苷对高尿酸血症小鼠血清生化指标的影响Tab 3结果显示,与正常组比较,模型组小鼠血尿酸水平明显升高(P<0.01),而两个阳性药组和晶V型芒果苷中剂量组均能明显降低UA水平(P<0.01),晶V型芒果苷低、高剂量组也具有一定降UA趋势。与正常组比较,模型组小鼠AST水平明显增加(P<0.05),阳性药AP组和晶V型芒果苷高剂量组也明显增高AST水平(P<0.01)。与正常组和模型组比较,阳性药AP组能够明显增高BUN和CRE水平(P<0.01)。与模型组比较,阳性药BR组、晶V型芒果苷低、高剂量组均能明显降低血清LDL(P<0.01,P<0.05)。与正常组比较,除BR组外,其他各组均能明显降低血清HDL水平(P<0.05,P<0.01)。
3.3晶V型芒果苷对高尿酸血症小鼠肝脏XO活性的影响如Fig 1所示,与正常组比较,模型组小鼠肝脏XO活性增高,阳性药和晶V型芒果苷均可以降低XO水平,其中AP和晶V型芒果苷高剂量组与模型组比较,差异具有显著性(P<0.05)。
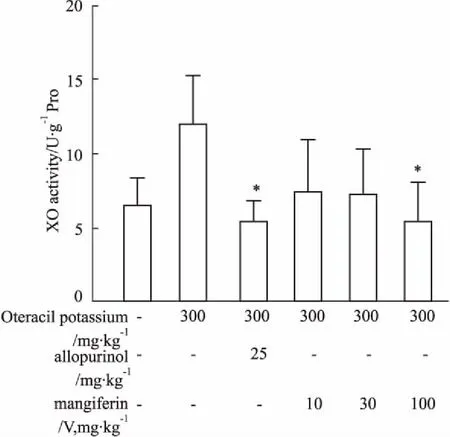
Fig 1 Effect of mangiferin (crystalⅤ) on activity of hepatic XO in hyperuricemia mice induced by
*P<0.05vsmodel
3.4晶V型芒果苷对高尿酸血症小鼠肾脏病理学变化的影响如Fig 2所示,与正常组相比,模型组肾小管上皮基底膜变薄,肾小管组织缺失。阳性药别嘌呤醇组肾小球萎缩,肾小球囊壁层收缩,结构不完整;BR组基底膜轻微变薄,近曲小管不完整。晶V型芒果苷低、中、高剂量组肾小管上皮细胞增厚,形态与正常组基本一致。
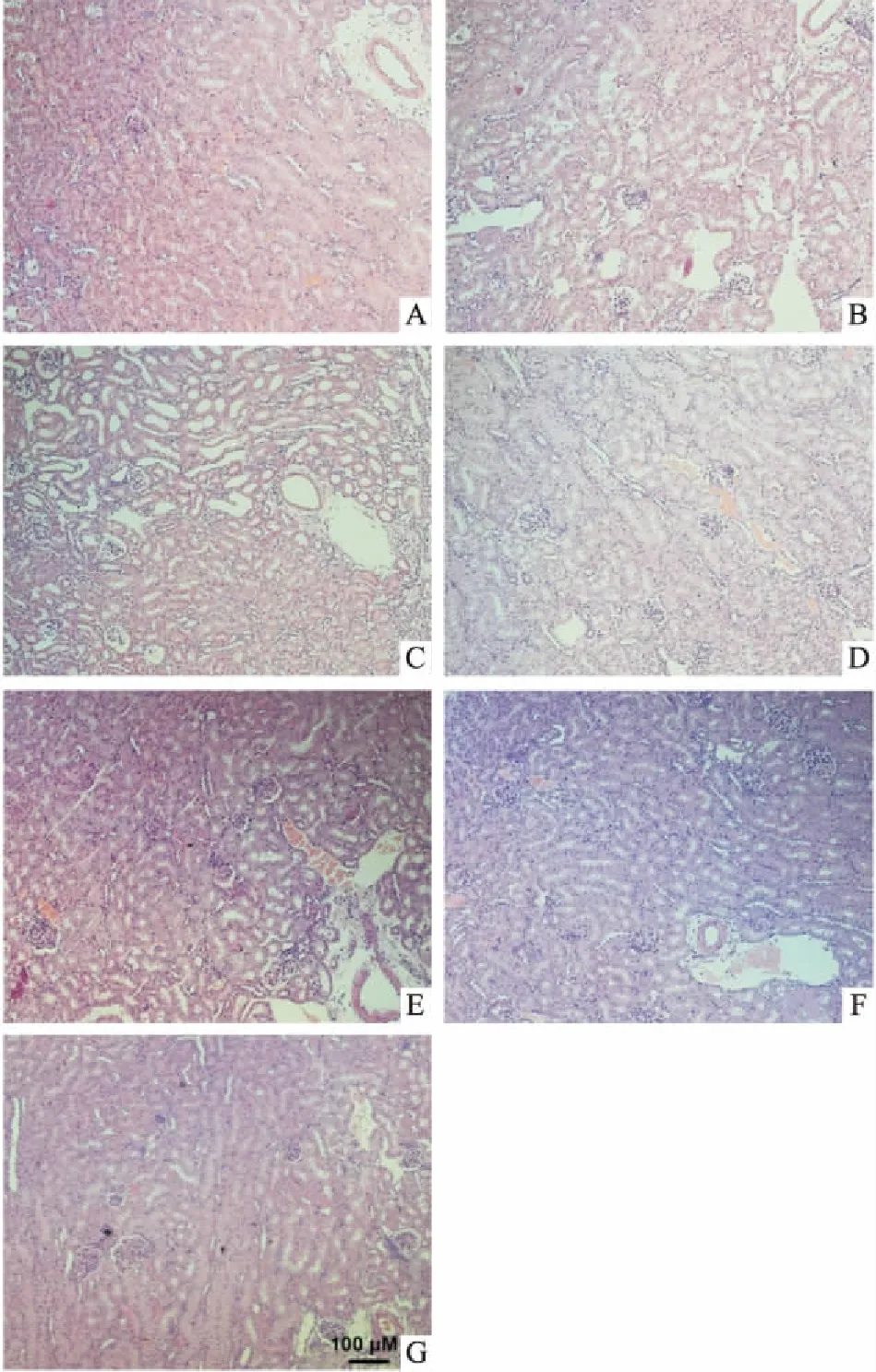
Fig2Effectofmangiferin(crystalⅤ)onhistopathologyinhyperuricemicmiceinducedbypotassiumoxonate(×100)
A: Control; B: Model; C: AP; D: BR; E: Mangiferin(Ⅴ, 10 mg·kg-1); F: Mangiferin (Ⅴ, 30 mg·kg-1); G: Mangiferin(Ⅴ, 100 mg·kg-1).3.5晶V型芒果苷对高尿酸血症小鼠肾脏尿酸转运体、结直肠尿酸转运体、肝脏XOmRNA表达的影响如Fig 3所示,在小鼠肾脏尿酸盐阴离子转运体1(urate anion transporter 1,URAT1)mRNA表达水平方面,阳性药BR与晶V型芒果苷各剂量组明显高于正常组和模型组;肾脏葡萄糖转运蛋白9(glucose transporter 9,GLUT9)mRNA表达水平方面,模型组、阳性药BR和晶V型芒果苷高剂量组表达水平上调,低、中剂量组表达低于模型组;肾脏ABC转运蛋白2(ATP-binding cassette superfamily member 2,ABCG2)mRNA表达水平方面,模型组表达水平明显降低,阳性药AP、BR能明显升高其表达,并高于正常组,而晶V型芒果苷各剂量组与模型组比较,表达水平无明显变化;肾脏有机阴离子转运蛋白1(organic anion transporter 1,OAT1)mRNA表达水平方面,模型组表达水平降低,阳性药BR组表达水平上调,其他各组与模型组比较差异无显著性;肾脏

Fig3Effectofmangiferin(crystalⅤ)onmRNAexpressionsof
renaluratetransporters,intestineuratetransportersandhepaticxanthineoxidaseinhyperuricemicmiceinducedby
A: GLUT9,URAT1 mRNA from kidney in mice; B: OAT1,OAT2,OAT3,NPT1,OCTN1 mRNA from kidney in mice; C: PDZK1 mRNA from kidney in mice; D: ABCG2,GLUT9 mRNA from colorectum in mice; E: XO mRNA from liver in mice.#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel.
OAT2、OAT3 mRNA表达水平方面,与正常组比较,其他各组表达水平均明显降低;磷酸盐转运蛋白1(sodium-dependent phosphate transport protein 1,NPT1)mRNA表达水平方面,各组表达水平无显著性差异;肾脏有机阳离子转运体1(organic cation transporter 1,OCTN1)mRNA表达水平方面,与正常组比较,模型组有一定的上调,与模型组比较,BR和晶V型芒果苷中剂量组表达有一定的下降;肾脏转

Tab 3 Effect of mangiferin (crystalⅤ) on biochemical indicators in serum of hyperuricemia mice induced by potassium n=10)
#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
运体支架蛋白1(PDZ domain containing 1,PDZK1)mRNA表达水平方面,与正常组比较,模型组、BR和晶V型芒果苷高剂量各组表达均上升,其余各组较模型组表达下降。
在小鼠肠道ABCG2 mRNA表达水平方面,与正常组比较,其他各组表达水平均明显下降;肠道GLUT9 mRNA表达水平方面,与正常组比较,其他各组表达水平均明显下降,同时晶V型芒果苷中剂量组能明显下调模型小鼠的表达水平;在小鼠肝脏XO mRNA表达水平方面,模型组表达水平明显高于正常组,其他各给药组均能明显降低模型小鼠的XO mRNA的表达(Fig 3)。
4 讨论
高尿酸血症是由于机体内尿酸合成和排泄失衡造成的代谢性疾病。尿酸的合成依靠一系列酶促反应,其中XO是尿酸合成的关键酶,核酸类化合物在肝脏组织中通过XO等酶促反应生成尿酸。根据核酸体内外来源不同,尿酸合成分为内源性和外源性两个部分。尿酸的排泄大部分通过肾脏排泄(70%),其余通过肠道(30%)。尿酸经过肾小球滤过、肾小管重吸收及分泌,一部分排出体外,另一部分重吸收入血[5]。当机体过多摄入核酸类物质或者尿酸排泄障碍时,均可以引起高尿酸血症。针对导致高尿酸血症的两种途径,目前已上市药物和在研药物的作用机制可以分为两类,抑制尿酸合成途径相关酶和调节尿酸排泄相关蛋白。另外,还可以向人体直接注入外源重组尿酸酶,瞬时降低尿酸水平。
近年来,针对尿酸转运蛋白的靶点研究愈发深入,它们主要分布在肾脏近曲小管上皮细胞基底外侧膜、顶侧膜和管腔膜。依据对尿酸转运机制不同,主要分为3种类型蛋白:第1类尿酸重吸收蛋白,包括葡萄糖转运蛋白9(GLUT9)、尿酸盐阴离子转运体1(URAT1)、有机阴离子转运蛋白4(OAT4)等;第2类尿酸分泌蛋白,包括机阴离子转运蛋白1(OAT1)、有机阴离子转运蛋白2(OAT2)、有机阴离子转运蛋白3(OAT3)、ABC转运蛋白2(ABCG2)、磷酸盐转运蛋白(NPT1)、肉毒碱转运体(OCTN1)等;第3类转运体支架蛋白1(PDZK1)[6]。肠道中,特别是结直肠上皮细胞中,也表达尿酸转运蛋白[7]。以上这些蛋白均参与尿酸的排泄,或辅助相关蛋白形成复合物,参与尿酸的排泄。URAT1是已上市药物苯溴马隆、丙磺舒、Verinurad治疗高尿酸血症的经典靶蛋白[8-9]。
本研究观察各组脏器指数结果,发现阳性药AP、BR组肝脏和肾脏指数均增大,提示肝肾可能出现病变,这种病变与两种阳性药的毒性和超敏反应有一定的相关性[10-11]。全血生化指标显示,腹腔给予氧嗪酸钾后,模型组小鼠血尿酸水平明显升高,阳性药AP、BR及晶V型芒果苷均能明显降低血尿酸水平,但是AP组的AST、BUN、CRE明显升高,提示阳性药AP具有一定的肝肾毒性,这与文献报道一致,而晶V型芒果苷中剂量组未出现肝、肾毒性。以上结果说明,晶V型芒果苷能降低尿酸,同时肝、肾毒副作用小。
肝脏XO活性测定和基因表达检测结果显示,模型组肝脏XO的活性和mRNA表达均明显升高,晶V型芒果苷各剂量组可以一定程度上降低XO活性,明显降低XO mRNA表达。提示晶V型芒果苷能够通过尿酸合成途径,抑制XO的合成,从而减少体内尿酸的生成。对小鼠肾脏、结直肠尿酸转运蛋白的机制研究显示,晶V型芒果苷低、中剂量组可以降低高尿酸血症小鼠肾脏和肠道中尿酸重吸收蛋白GLUT9 mRNA的表达,提高肾脏PDZK1 mRNA的表达。但是对其他转运蛋白无调节作用,或起到相反的调节作用。综合尿酸转运蛋白mRNA表达结果提示,晶V型芒果苷可能作用于GLUT9和PDZK1两种蛋白靶点,发挥排泄途径的降尿酸作用。这与已上市促尿酸排泄药物作用靶点不一样。
高尿酸血症能够引起急性尿酸肾病和慢性尿酸肾病。发病原理是由于高浓度尿酸导致尿酸结晶析出,并沉积在肾间质中,堵塞集合管,压迫远端肾血管,改变肾脏血流动力学变化,同时造成肾小管内皮损伤。尿酸肾病还可继续发展为尿酸性肾结石,甚至肾衰竭。治疗高尿酸血症肾损伤最根本的方法还是及时降低体内尿酸浓度,同时保护内皮,抑制炎症因子的释放[12]。本实验通过HE染色方法,考察各给药组对肾脏的影响,结果表明,晶V型芒果苷各组能够减少空泡化程度,肾皮质饱满,一定程度上改善肾损伤。而阳性药AP组出现更加严重的病理变化,这与其全血生化指标和脏器指数显示的肝、肾毒性现象一致。
本实验选用的晶V型芒果苷为前期筛选的优势晶型,生物利用度高。实验中采用固体给药的方式,避免溶解药物对晶型的破坏,使化合物在体内充分发挥药理作用。
综上所述,晶V型芒果苷作为来源于植物提取的优势晶型单一化合物,可以有效降低高尿酸血症小鼠血尿酸水平,改善高尿酸血症造成的肾损伤,未出现明显肝、肾毒性或损伤,发挥了天然产物低毒、有效的作用特点。机制研究表明,晶V型芒果苷通过作用于尿酸合成和排泄两个途径,起降尿酸作用。
