Vaspin在糖尿病心肌病中的作用及机制研究
2018-10-11李宾公郝艳琴李雪莲
柯 旋,李宾公,郝艳琴,李雪莲,邹 晋
(1. 南昌大学第一附属医院心内科,江西 南昌 330006;2. 武汉市第三医院心内科,湖北 武汉 430000;3. 江西省人民医院心内科,江西 南昌 330006)
糖尿病心肌病(diabetic cardiomyopathy, DCM)是由Rubler等[1]在1972年提出的概念,其典型的结构改变是心肌肥厚及心肌纤维化,早期心脏舒张功能受损明显,晚期收缩功能受损导致心力衰竭。DCM发病机制仍不甚明确,因此有必要深入探究其发病机制,为临床治疗提供理论基础。脂肪因子vaspin被认为是心血管保护因子,可抑制炎症通路,延缓动脉粥样硬化的进展,但其在DCM中的作用仍不清楚。本研究建立DCM模型,在体内探讨vaspin是否能改善DCM大鼠心肌纤维化,提高心功能,为治疗DCM提供新的方式。
1 材料与方法
1.1实验动物10周龄♂SD大鼠36只,体质量(200±20)g,购于南昌大学医学部动物实验中心,使用许可证号:SYXK(赣)2015-0001。普通饲料购于南昌大学医学部动物实验中心。
1.2试剂链脲霉素(streptozocin,STZ)、水合氯醛、Masson染色试剂盒,均购于北京索莱宝生物科技有限公司;大鼠肿瘤坏死因子α(tumor necrosis factor α, TNF-α)ELISA试剂盒购于上海研域化学试剂有限公司; β-actin、GAPDH抗体购于中杉金桥公司;LC3、Beclin-1、p62、Bcl-2、Bax抗体,购于Cell Signaling Technology公司;TGF-β1、Collagen I抗体购于Abcam公司。
1.3动物模型的建立及实验分组SD大鼠一次性腹腔注射STZ(60 mg·kg-1),2周后,大鼠尾静脉采血检测血糖,血糖高于16.7 mmol·L-1,表示糖尿病模型建模成功。实验分为以下3组,每组12只大鼠:⑴对照组:正常饲养,腹腔注射生理盐水(0.5 mL·kg-1·d-1);⑵DCM组:糖尿病模型成功后,腹腔注射生理盐水(0.5 mL·kg-1·d-1),继续喂养12周, 糖尿病大鼠出现感染,死亡2只;⑶ Vaspin组:糖尿病模型成功后,腹腔注射vaspin(320 ng·kg-1·d-1),继续喂养12周。
1.4大鼠空腹血糖检测在实验前1 d禁食12 h,期间保持正常的饮水,用75%酒精棉球消毒大鼠尾部,用剪刀剪去少许末端,轻轻挤压,第1滴弃之,第2滴滴于血糖仪上,测得的血糖值即为空腹血糖值。
1.5大鼠心脏彩超测定10%水合氯醛麻醉大鼠,用脱毛膏褪去心前区毛发,将大鼠仰卧固定于操作板上,30 MHz频率探头在左室乳头肌水平二维左室短轴切面测量左室舒张末径(LVIDd)、左室收缩末径(LVIDs)、左室射血分数(LVEF)、左室短轴缩短率(LVFS)、E峰/A峰(Em/Am),评估大鼠的心功能。
1.6ELISA检测实验末,从大鼠的颈静脉窦抽血,3 000 r·min-1离心5 min,取上清,按试剂盒说明书检测TNF-α浓度。
1.7心肌组织病理标本制作实验末,10%水合氯醛麻醉大鼠后,取出心脏,小心去除临近大血管,用预冷PBS 冲洗后,按冠状水平将左心室平均切成两部分,一部分-80℃保存,用于蛋白检测备用,另一部分置于10%中性福尔马林溶液中室温下固定。脱水处理后,石蜡包埋切片,切成4 μm薄片,脱蜡后行Masson染色。
1.8Westernblot检测剪取各组大鼠心脏组织,提取总蛋白,BCA测定蛋白浓度后,取20 μg蛋白量上样电泳,转膜、封闭,加相应一抗4℃孵育过夜,再用HRP标记的二抗孵育2 h。PBST洗膜3次,ECL化学发光液曝光,显影及定影后,用Image J分析软件,测得蛋白条带灰度值,并进行统计分析。

2 结果
2.1各组大鼠体质量及空腹血糖的变化如Fig 1所示,糖尿病大鼠出现体质量下降,空腹血糖升高(P<0.01)。相比于DCM组,vaspin处理会增加大鼠体质量,降低大鼠空腹血糖(P<0.01),说明vaspin可改善糖尿病大鼠高血糖水平。
2.2各组大鼠血清中TNF-α的变化如Fig 2所示,与对照组相比,DCM大鼠血清中TNF-α水平升高(P<0.01),而vaspin对TNF-α水平无明显影响(P>0.05)。
2.3Vaspin改善DCM大鼠的心功能如Fig 3所示,与对照组相比,DCM大鼠LVEF、FS、Em/Am降低(P<0.01),vaspin处理提高了大鼠LVEF、FS、Em/Am(P<0.01),说明vaspin可改善DCM大鼠舒张及收缩功能。
2.4大鼠心肌组织中LC3、Beclin-1、p62蛋白表达的变化如Fig 4所示,与对照组相比,DCM大鼠心肌组织中LC3-II/LC3-I、Bcelin-1的表达降低,p62表达升高(P<0.01)。Vaspin处理可以提高LC3-II/LC3-I、Bcelin-1表达,降低p62表达(P<0.01),提示vaspin可提高DCM大鼠心肌组织自噬水平。
2.5大鼠心肌组织中Bax、Bcl-2蛋白表达的变化如Fig 5所示,与对照组相比,DCM大鼠心肌组织

Fig 1 Changes of body weight and fasting blood glucose in each group n=12)
**P<0.01vscontrol;##P<0.01vsDCM
中Bax表达升高,Bcl-2表达降低, Bax/Bcl-2比值升高(P<0.01)。Vaspin处理可以减少Bax表达,增加Bcl-2表达,降低Bax/Bcl-2比值(P<0.01),提示vaspin可减少DCM大鼠心肌组织的凋亡。
2.6Vaspin减少心肌组织中胶原蛋白表达及心肌胶原沉积Fig 6的Masson染色显示,相比于DCM组,vaspin组心肌胶原沉积减少(P<0.05); Western blot结果显示,与DCM组相比,vaspin组的Ⅰ型
**P<0.01vscontrol;#P<0.05vsDCM
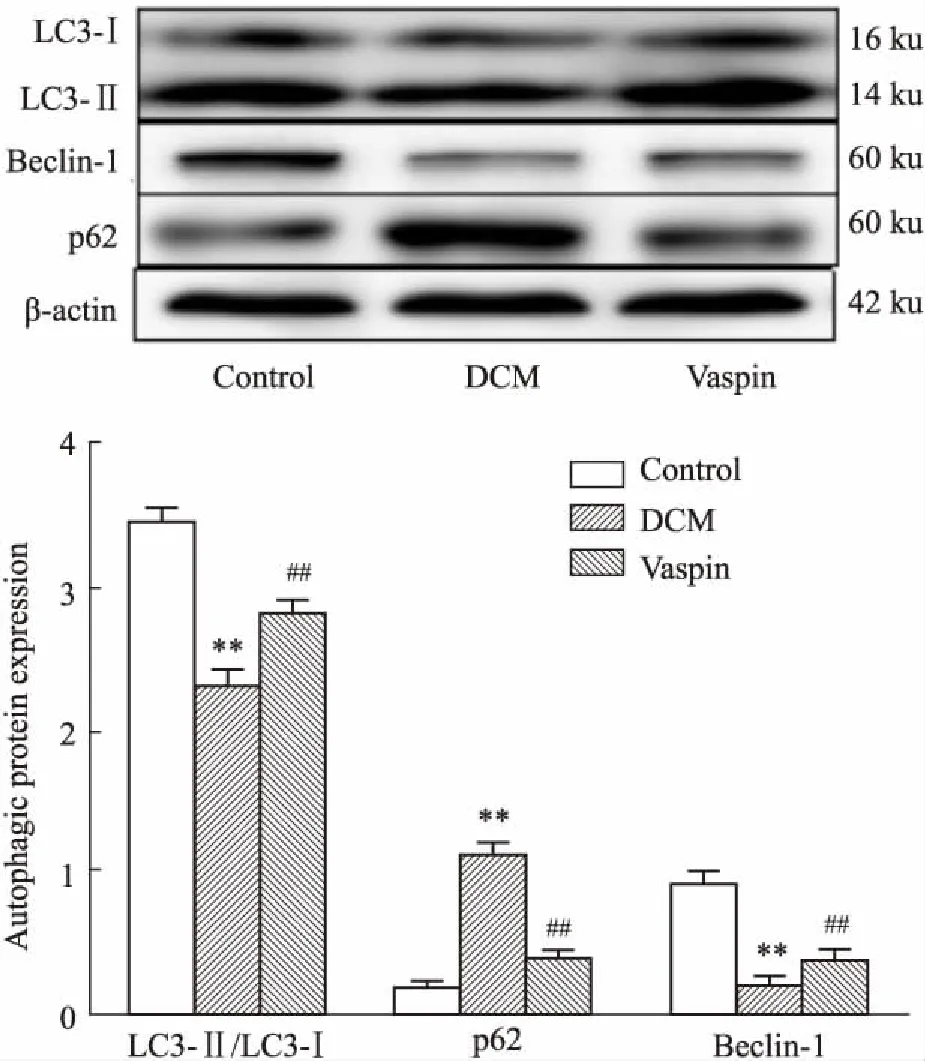
Fig 4 Expression of LC3, Beclin-1 and P62 in each group n=12)
**P<0.01vscontrol;##P<0.01vsDCM
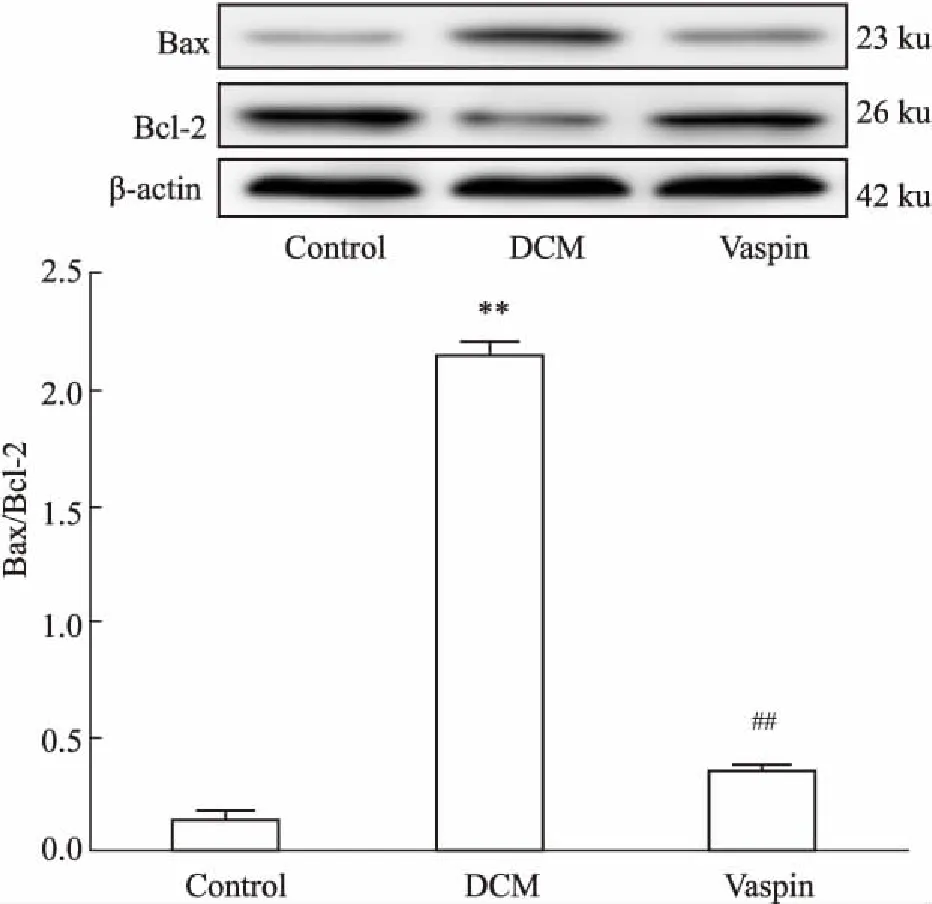
Fig 5 Expression of Bax, Bcl-2 in each group n=12)
**P<0.01vscontrol;##P<0.01vsDCM
胶原蛋白表达减少(P<0.01),而TGF-β1的表达无明显变化(P>0.05),说明vaspin是通过减少I型胶原蛋白沉积,抑制心肌纤维化,并非通过TGF-β信号转导通路干预心肌纤维化。
3 讨论
在本研究中,我们成功构建了DCM大鼠模型,与大多数研究不同的是,我们采用STZ(60 mg·kg-1)一次性腹腔注射,继以普通饲料喂养2周后,血糖明显升高,出现多饮、多食、多尿,并伴体质量明显下降,并在造模后12 周进行验证,证实出现心肌纤维化和心肌肥厚的糖尿病性心肌病状态,说明这种方式可以稳定地建立DCM模型。由于我们没有用高脂饲料喂养,本方法具有安全、可靠、可行性强、方便快捷的优点,我们的动物模型机制上是利用STZ破坏大鼠胰岛β细胞,造成胰岛素分泌障碍,因此,考虑我们的模型属于1型糖尿病心肌病模型。
Vaspin是2005年新研究发现的脂肪因子,总体上讲,其在心血管疾病中是有利的脂肪因子。Vaspin不仅在脂肪组织、胃、胰腺、肝脏、血管外膜周围脂肪中有表达,而且在心外膜脂肪组织也有不同程度的表达,且由于心外膜脂肪组织、血管壁和心肌之间没有纤维、筋膜层,所以vaspin可直接作用于整个心脏。Vaspin mRNA在肥胖糖尿病人群中高表达,糖尿病患者血清vaspin浓度明显高于非糖尿病人[2],当糖尿病患者合并心血管病变时,血清vaspin浓度降低[3-4],提示vaspin可作为糖尿病进展为糖尿病心血管损伤的敏感标记物。进一步研究提示,

Fig 6 Effect of vaspin on myocardial fibrosis
A: The expression of Collagen I and TGF-β1 in each group; B: Masson staining (×200); C: Myocardial fibrosis collagen volume fraction (CVF) analysis.**P<0.01vscontrol;##P<0.01vsDCM.
vaspin的降低是一种失代偿机制,具体的vaspin降低机制仍不是很明确,但是体外实验提高vaspin的水平,可表现出多种保护作用机制。Qi等[5]的研究指出,vaspin可抑制低密度脂蛋白,诱导肺动脉内皮细胞的炎症、凋亡、氧化应激;Sun等[6]的研究结果表明,vaspin通过PI3K/Akt/eNOS途径,调节内皮祖细胞中一氧化氮合酶(endothelial nitric oxide synthase, eNOS)表达和功能,可能对糖尿病患者有保护作用,以防止血管并发症的发生。Vaspin还可通过抑制内质网应激诱导的巨噬细胞凋亡,来延缓小鼠动脉粥样硬化斑块的进展[7]。本研究也发现,vaspin可减少糖尿病大鼠心肌凋亡,改善心功能。另外,我们研究还发现,糖尿病大鼠心肌组织中,除了凋亡蛋白增多外,心肌组织中自噬明显下调,vaspin的干预提高了自噬水平,减少了心肌胶原沉积,改善心肌纤维化。
自噬与DCM心肌纤维化密切相关。Xu等[8]利用STZ诱导1型糖尿病模型,发现小鼠心肌组织中自噬水平降低,与我们的实验结果一致。他们在OVE26转基因小鼠中,分别沉默Beclin-1单倍体或ATG16基因后,心肌纤维化和细胞凋亡水平明显降低,外源性给予Beclin-1后,小鼠心肌纤维化及细胞凋亡程度加重,说明提高自噬水平,心肌纤维化及细胞凋亡程度越严重,1型糖尿病心肌病自噬水平降低是应激性保护。相反,Xie等[9]在OVE26小鼠(1型糖尿病)中发现,AMPK的减少总是伴有自噬活性的降低,通过激活AMPK通路可增加糖尿病小鼠自噬水平,改善DCM心肌结构改变,他们的研究结果和我们一致。在本实验中,vaspin提高了自噬水平,减少了心肌细胞凋亡和纤维化程度,但是我们没有探讨自噬与心肌纤维化之间的因果关系,vaspin可能是通过促进自噬,改善心肌纤维化及凋亡,也可能存在自噬以外的其他途径,参与心肌纤维化及凋亡的调节,仍需进一步研究证实,但是至少说明提高自噬并没有加重糖尿病心肌损伤,这一点与Xu等[8]的研究结果相反。之所以存在上述差异,可能与糖尿病动物模型建立的差异有关。我们建立的1型糖尿病心肌病模型中自噬是降低的,而且心肌纤维化明显,与目前众多的研究一致[10]。在目前研究中,1型糖尿病中自噬是被抑制的,然而自噬抑制是应激性保护作用,还是失代偿作用,仍存在分歧,如Xu等[8]的研究提示提高自噬不利于心肌正常功能,而我们的研究和Xie等[9]的研究说明提高自噬可以保护心肌。而在2型糖尿病研究中自噬上调的居多,在2型糖尿病早期会有自噬下调,促进自噬有心肌保护作用[11-12]。
Vaspin可通过PI3K/Akt信号通路,改善内皮祖细胞功能[6],而PI3K/Akt激活可抑制mTOR,促进自噬,并且PI3K/Akt信号通路也可参与心肌纤维化的调控。我们进一步推测,vaspin对DCM中自噬的调节可能与PI3K/Akt/mTOR信号通路有关,我们团队将利用心肌细胞在机制层面进一步深入研究。
综上所述,既然vaspin可调节心肌细胞自噬,而自噬在心肌肥大[13]、氧化应激损伤[14]、胰岛素抵抗[15]、晚期糖基化产物[16]等多方面均有重要调节作用,这些因素与DCM密切相关,说明vaspin可通过调节心肌细胞自噬,参与多种途径影响DCM的发生发展,甚至参与调控其他心血管疾病。因此,调控vaspin可能成为心血管疾病重要治疗策略。
(致谢:本实验在江西省高血压研究所完成,在此感谢张婉老师及曾俊义老师在实验中给予的帮助与支持。)
