高效液相色谱-串联质谱法测定婴幼儿配方奶粉中酪蛋白磷酸肽含量
2018-10-08张京顺蒋易蓉果基施锑任一平
胡 蓓,张京顺,柯 星,蒋易蓉,周 健,果基施锑,任一平,*
(1.浙江工业大学化工学院,浙江 杭州 310014;2.浙江省疾病预防控制中心,浙江 杭州 310051;
3.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058;4.阿尔拉食品原料贸易(北京)有限公司,北京 100035)
酪蛋白磷酸肽(casein phosphopeptides,CPPs)是牛酪蛋白经单一酶或复合生物酶水解后的产物,分布于αs1-、αs2-、β-以及κ-酪蛋白中的不同区域。CPPs已被我国批准作为添加剂,应用于各种营养品、保健食品,能有效提高人体对钙、铁、锌等二价矿物质的摄入及吸收利用率[1-5];同时,CPPs还有预防龋齿[6-7]、有助于促进动物体外受精[8]、增强机体免疫力[9]和诱导细胞凋亡的生理功能[10]。CPPs生物活性的核心结构为:-Ser(P)-Ser(P)-Ser(P)-Glu-Glu-(Ser:丝氨酸,Glu:谷氨酸,P:磷酸基)[11]这一结构中,磷酸丝氨酸残基(-Ser(P)-)成簇存在,在肠道弱碱性环境下带负电荷,可阻止CPPs在消化酶的作用下进一步被水解,从而在小肠中稳定存在。研究发现,CPPs中氮磷比越小,其肽链越短,磷酸基的密度越大,则促进钙吸收作用越强[12]。此外还有研究证明CPPs的作用效果还与分子中氨基酸组成顺序或磷酸基分布有关[13-14]。CPPs有较强的促进钙吸收作用以及良好的高温稳定性[15],因此,随着钙高效辅助吸收剂的推广,将CPPs(以牛乳或酪蛋白制品为原料,通过酶解生产工艺制得的食品添加剂[16-19])添加到各种产品中,如保健品、儿童营养食品等。GB 14880—2012《食品营养强化剂使用标准》对CPPs可应用于婴幼儿配方食品、粮食和粮食制品、饮料等,并对使用量(婴幼儿配方食品中≤3.0 g/kg)作了明确规定[20]。
目前普遍采用钡盐沉淀法[21]、电泳法[22-23]、高效液相色谱法[24-25]、高效液相色谱-质谱联用法[26-27]测定CPPs的含量。赖奕坚等[26]采用高效液相色谱-质谱联用法中SIR模式检测钙片中CPPs的含量,根据扫描结果选取离子m/z为454.3的特征峰作为CPPs的代表,并使用SIR模式对该特征峰进行定量,但未对该特征峰作为CPPs的代表作进一步的分析。近几年,应用高分辨色谱-质谱联用法对不同种属哺乳动物乳的酪蛋白中磷酸化的具体位点[28]以及不同哺乳期中磷酸化位点的变化情况[27]作了较多报道,但对应用低分辨三重四极杆串联质谱用于样品定量分析的方法鲜见报道。而本实验针对婴幼儿配方奶粉等添加CPPs食品的定量检测方法进行分析。
本研究依据蛋白质数据库确定酪蛋白氨基酸序列信息,通过高分辨质谱筛选出CPPs原料中具有特异性的肽段,再通过低分辨串联质谱的多重反应监测建立定量模式。依据CPPs原料与CPPs特征肽之间的含量关系,采用同位素稀释内标法测定强化CPPs婴幼儿配方奶粉中CPPs的含量。该方法具有操作简便、灵敏度高、特异性强等特点,可满足目前市售婴幼儿配方奶粉中CPPs含量的测定。
1 材料与方法
1.1 材料与试剂
CPPs原料 丹麦Arla乳品公司;CPPs特征肽LSQSKVLPVPQK、同位素内标肽LSQSKVL*PV*PQK(L*:Leu-OH-13C6,15N;V*:Val-OH-13C5,15N)(纯度>95%) 上海强耀生物科技有限公司;甲酸、乙腈、乙酸铵(均为色谱纯) 德国Merck公司;乙酸(优级纯)、无水乙醇(分析纯) 国药集团化学试剂有限公司;盐酸、氢氧化钠(均为分析纯) 上海凌峰化学试剂有限公司;氯化钡(分析纯) 上海泗联化工厂有限公司;水为Millipore制备的超纯水。
1.2 仪器与软件
1290 Infinity超高压液相色谱仪、6460系列三重四极杆串联质谱仪 美国Agilent公司;Q Exactive Orbitrap、Proteome Discoverer 2.1软件 美国Thermo Fisher Scientific公司;Uniprot蛋白质组学数据库(http://www.uniprot.org)。
1.3 方法
1.3.1 试样前处理
乳制品中通常蛋白质含量较高,而其中酪蛋白又占多数,在前处理过程中对目标肽段的提取和准确测定会产生一定影响,因此需要采取适当的前处理以去除大部分的蛋白干扰。根据文献[29],酪蛋白的等电点为4.6,因此本实验采用等电点蛋白质沉淀法:称取5 g奶粉样品,超纯水溶解,定容至100 mL,取80 μL,加入50 μL同位素内标溶液(1 μg/mL),加870 μL乙酸铵-乙酸缓冲溶液(10 mmol,pH 4.6),8 000 r/min(4 ℃)离心5 min。取上清液用0.22 μm滤膜过滤。结果显示,经过蛋白沉淀后,再检测CPPs特征肽段,方法回收率高(105.4%)、稳定性好(相对标准偏差(relative standard deviation,RSD)为1.6%)、实验操作方便、分析效率高。
1.3.2 指标的测定
1.3.2.1 折算系数的确定
称取CPPs原料(共8 个待测样品)各0.1 g于试管中,用超纯水将试样充分溶解后定容至100 mL。定容后取125 μL用超纯水稀释至1.0 mL,涡旋混匀。取80 μL于2 mL试管中,加入50 μL同位素内标溶液(1 μg/mL)、870 μL乙酸铵-乙酸缓冲溶液(10 mmol,pH 4.6),8 000 r/min(4 ℃)离心5 min,取上清液过0.22 μm滤膜。CPPs特征肽含量计算见公式(1):

式中:Cx1为原料中CPPs特征肽的含量/(mg/100 g);na1为根据标准曲线计算得到的原料中CPPs特征肽质量浓度/(ng/mL);v1为原料的定容体积/mL;m1为原料的质量/g;F1为待测原料溶液的稀释倍数。
折算系数即为CPPs原料中CPPs特征肽的含量。根据公式(1)计算8 批原料中CPPs特征肽的含量分别为1 071.4、1 113.4、1 043.1、983.2、1 020.4、1 038.5、1 060.0、1 020.3 mg/100 g。将计算得到的所有批次中特征肽的含量通过SPSS软件分析,8 个批次的原料之间不存在显著性差异(P>0.05)。说明不同批次原料中CPPs特征肽的含量较为稳定,因此将所有批次中特征肽段含量的平均值1 043.7 mg/100 g作为折算系数,对其进行换算,折算系数=1 043.7×10-3g/100 g=1.0×10-2。
1.3.2.2 样品中CPPs含量的计算
样品中的CPPs按公式(2)计算:
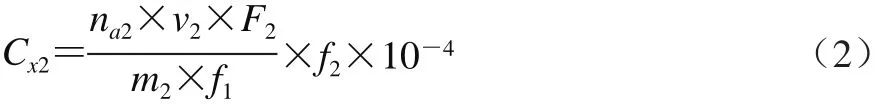
式中:Cx2为试样中CPPs的含量/(mg/100 g);na2为根据标准曲线计算得到的试样中CPPs特征肽的质量浓度/(ng/mL);v2为试样的定容体积/mL;m2为试样的质量/g;F2为待测原料溶液的稀释倍数;f1为折算系数,本方法中f1=1.0×10-2;f2为CPPs原料中CPPs的百分比含量。
1.3.3 色谱条件
色谱柱:ACQUITY UPLC BEH 300 C18(2.1 mm×100 mm,1.7 μm);柱温:35 ℃;进样量:10 μL;流速:0.3 mL/min。流动相A:0.1%甲酸溶液,B:0.1%甲酸-乙腈溶液。线性梯度洗脱程序:0~1 min,5% B;1~3.5 min,5%~27% B;3.5~4.5 min,27% B;4.5~5 min,27%~100% B;5~5.8 min,100% B;5.8~6.0 min,100%~5% B,保持2 min,等待下一针进样。
1.3.4 质谱条件
电喷雾离子源正离子模式;毛细管电压3.5 kV,脱溶剂温度375 ℃,脱溶剂气流量11.5 L/min。多离子反应监测模式,CPPs特征肽的监测母离子为3电荷[M+3H]3+,监测离子对为m/z 442.1→372.4和m/z 442.1→568.5,碰撞能量分别为15 eV和10 eV;同位素内标肽的监测母离子为3电荷[M+3H]3+,监测离子对为m/z 446.3→372.2和m/z 446.3→574.5,碰撞能量分别为15 eV和10 eV。
1.3.5 钡盐沉淀法
按照GB 31617—2014《食品营养强化剂 酪蛋白磷酸肽》[30]方法操作。称取试样1.5 g,精确至0.000 2 g,置于50 mL离心管A中,加入15 mL水使其完全溶解。用盐酸溶液(2 mol/L)调节试样溶液的pH值至4.6,然后置于冷冻离心机中,于4 ℃、6 000 r/min离心30 min,取上清液于预先在105 ℃干燥至恒质量的50 mL离心管B中,用氢氧化钠溶液(80 g/L)调节上清液的pH值至6.8,控制溶液总量在20 mL以内,加入氯化钡溶液(100 g/L)1.5 mL,再加入无水乙醇至50 mL,摇匀后于4 ℃冰箱中过夜。然后,从冰箱中取出置于冷冻离心机中,于4 ℃、6 000 r/min离心30 min,弃去上清液得沉淀物。沉淀物先在60 ℃干燥箱中烘1 h,再升高温度至105 ℃烘干至恒质量。
2 结果与分析
2.1 特征肽的选择结果
工业生产CPPs的工艺主要是通过对牛奶中酪蛋白的提取、酶解和富集,工艺复杂,且不同批次之间的含量存在差异,因此含量相对稳定特征肽段的确定是本方法建立的关键。将CPPs原料溶解后经色谱分离,通过高分辨质谱(Q Exactive Orbitrap)进行全扫描/数据依赖的二级扫描(Full MS/dd-MS2)模式扫描,经Proteome Discoverer 2.1软件及Uniprot蛋白质组学数据库(http://www.uniprot.org)分析比对,确定出不同批次产品中都存在的肽段,如表1所示。
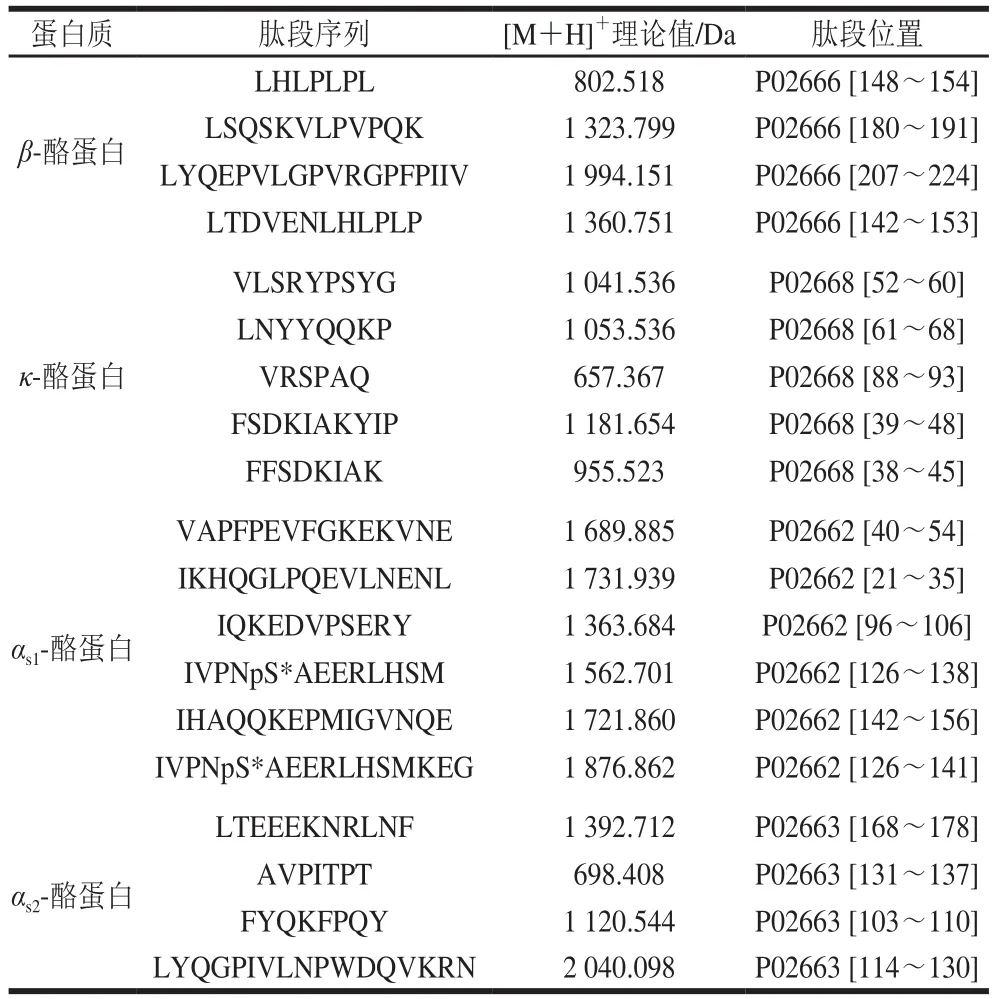
表1 通过蛋白质数据库分析所得到的肽段信息Table 1 Peptides obtained from protein database
根据各批次间肽段含量相对稳定的原则,连续检测3 d,每天按照相同方法处理CPPs原料,检测各批次原料中各肽段的含量。从中初步确定肽段含量稳定、并且RSD小于15%的7 条肽段(表2),其氨基酸序列分别为LSQSKVLPVPQK、VLSRYPSYG、LNYYQQKP、AVPITPT、FYQKFPQY、IVPNpS*AEERLHSM、IQKEDVPSERY。
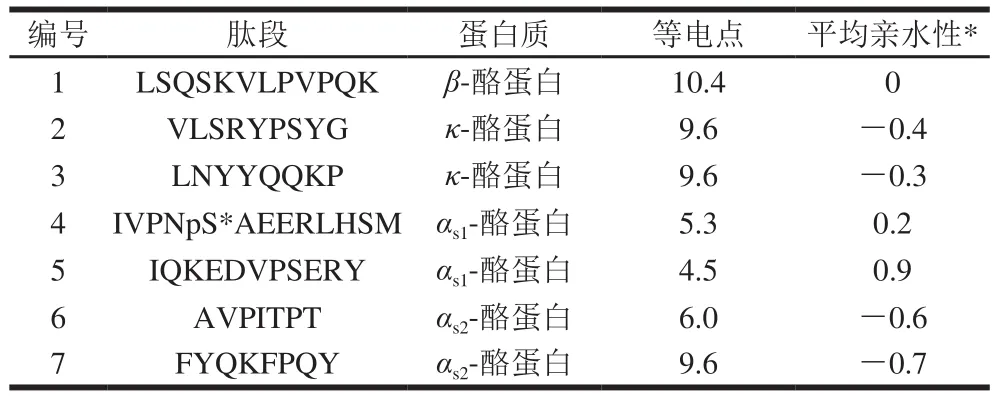
表2 候选肽段的等电点及亲水性Table 2 Isoelectric point and hydrophilicity of candidate peptides
在已查找到的7 条肽段中进行第2次筛选,选择特异性强和灵敏度高的肽段作为特征肽用于定量分析。筛选依照的原则:1)避选含有甲硫氨酸(M)的肽段,因甲硫氨酸在暴露的情况下易被氧化[31],影响对该肽段的准确定量。2)选择含6 个以上氨基酸的肽段。氨基酸组成个数相对越多,肽段序列越长的肽段其类同的可能性越小,其特异性越强。3)选择应用本法检测可获得高灵敏度、回收率(接近100%),且稳定的肽段。4)尽可能选择由β-酪蛋白和αs1-酪蛋白所酶解的肽段,由于酪蛋白中β-酪蛋白和αs1-酪蛋白含量最高,易于被检测。
根据以上原则,连续进行3 d样品同水平加标实验,每天按照相同方法处理CPPs原料,检测原料中各肽段的回收率及精密度。结果显示,肽段LSQSKVLPVPQK灵敏度高(图1)。由表3可知,肽段LSQSKVLPVPQK的回收率最佳,并且日内、日间精密度均小于5%。综上,本实验选择LSQSKVLPVPQK作为CPPs原料的特征肽。
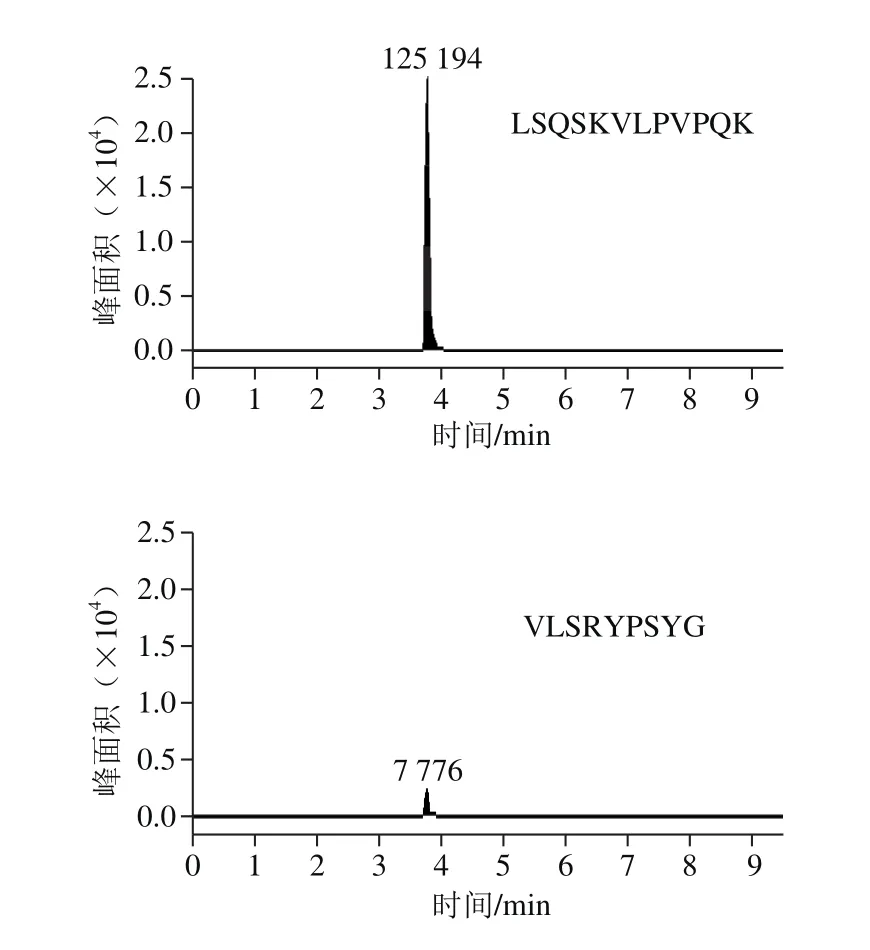
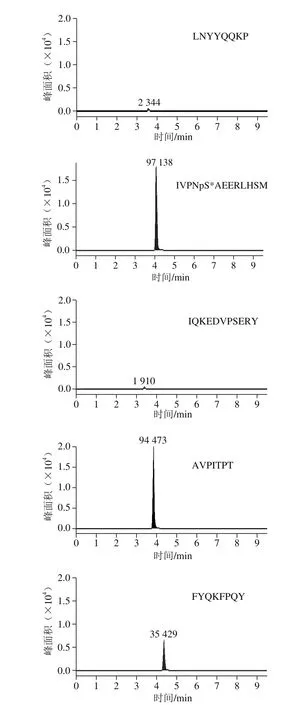
图1 所选肽段在CPPs原料中的响应Fig. 1 Response of selected peptide fragments in CPPs
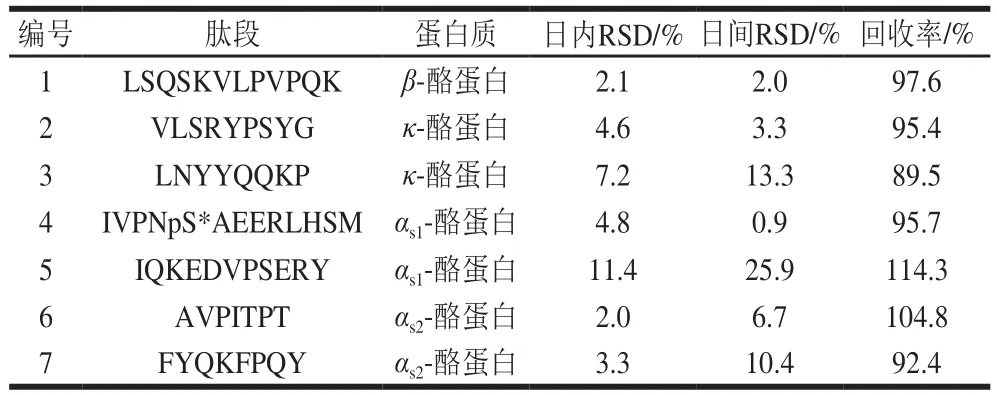
表3 各肽段的回收率及精密度Table 3 Recovery and precision (RSD) of each peptide
2.2 同位素内标肽的设计
影响质谱定量检测最大因素在于基质干扰,同位素内标的使用可以排除基质干扰,确保定量结果的准确性。鉴于多肽在电喷雾正离子模式下可产生双电荷或三电荷离子;另外,碳(1.11%13C)、氮(0.37%15N)元素的天然同位素丰度较高,在质谱检测器中响应较显著,若同位素标记个数过少则会存在离子干扰,同时需要考虑检测的成本,因此选择两个全同位素标记氨基酸(L和V),其质量数与原氨基酸差分别为7和6,同位素内标的序列为LSQSKVL*PV*PQK。对得到的同位素内标溶液进行质谱实验确证,待测肽段和同位素内标具有完全相同的色谱行为,并且相互之间不存在干扰。
2.3 方法学验证结果
2.3.1 特异性
为验证所选择的肽段为CPPs的特征肽段,在Uniprot蛋白数据库进行序列分析,发现所选肽段只存在于牛科动物乳的酪蛋白中,特异性强。此外,选择婴幼儿配方粉生产通常涉及的乳清蛋白、全脂粉、大豆蛋白、大米蛋白等不同类型的蛋白进行特异性验证实验,样品按照1.3节所述进行前处理,相同仪器条件下进行分析(图2)。结果显示,上述蛋白在所选肽段离子通道中均不存在干扰峰。
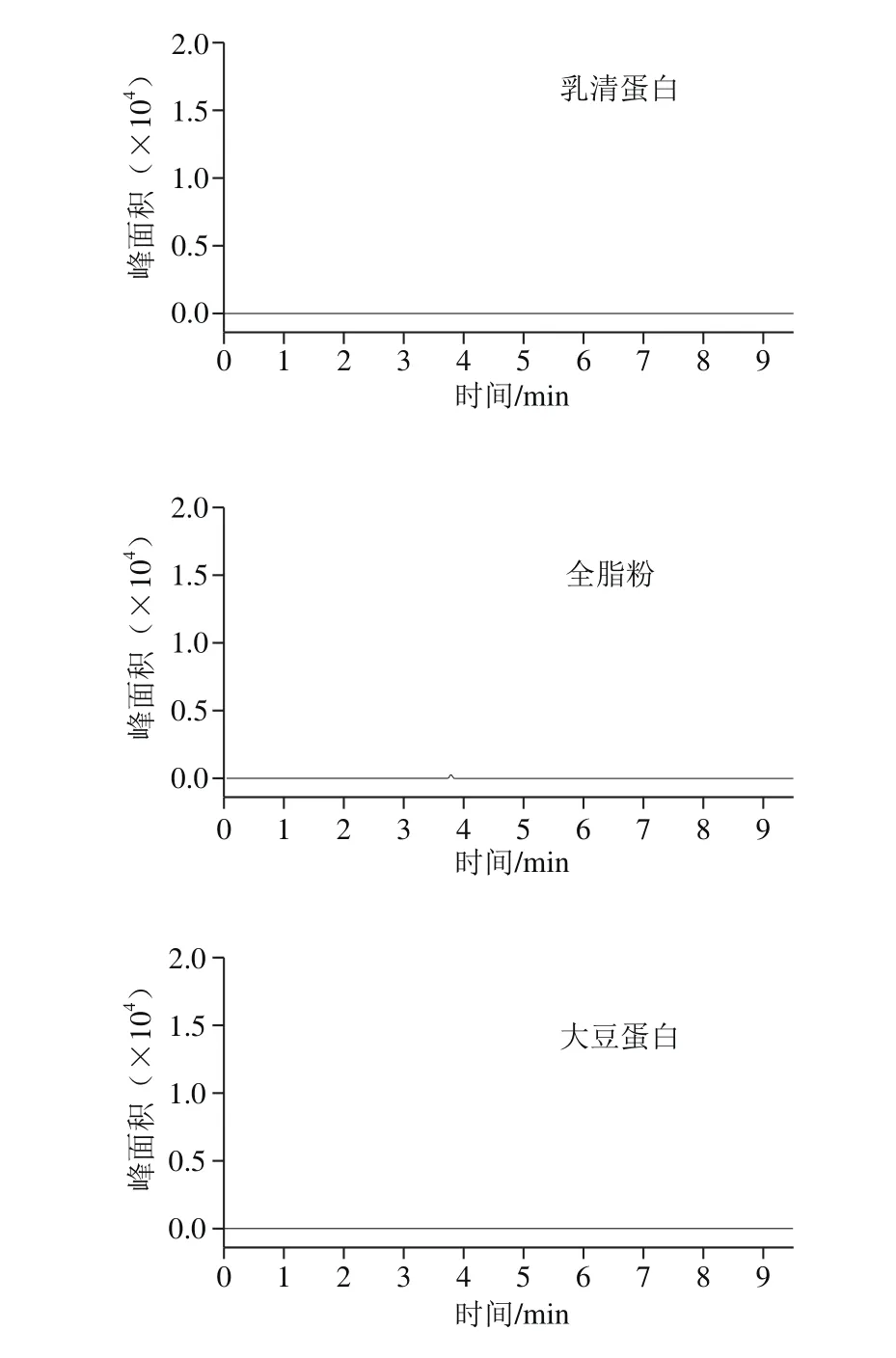
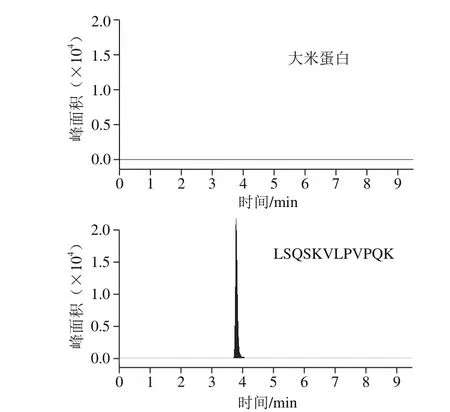
图2 不同蛋白对肽段的干扰情况Fig. 2 Interference effect of different proteins on the signature peptide
2.3.2 线性和灵敏度
线性范围为10~150 mg/100 g,CPPs的相关系数(R2)大于0.999。将前处理得到的加标样品溶液稀释标准品成一系列浓度梯度进样,以信噪比为3和10分别为方法检出限和定量限,为0.3 mg/100 g和1 mg/100 g。
2.3.3 准确度和精密度
方法准确性主要通过3 水平加标实验来评估,每个加标水平实验平行6 次,加标水平及回收率结果如表4所示。精密度则通过日间、日内(连续重复3 d)RSD表示,结果显示日内RSD均小于7.0%,日间RSD均小于8.0%。
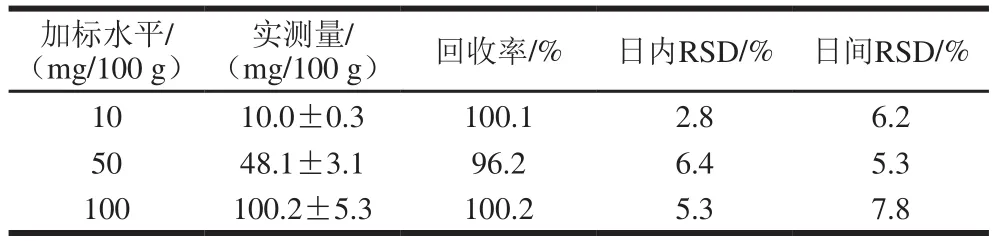
表4 准确度及精密度结果Table 4 Accuracy and precision of the method
2.4 方法验证应用结果
为了验证方法的适用性,对5 种婴幼儿配方奶粉按照建立的方法样品处理后进行测定。由表5可知,应用此方法测定的婴幼儿配方奶粉中CPPs的含量与标签标示值相近,通过T检验发现,P值为0.97(>0.05),说明两组结果不存在显著性差异,此方法能准确的测定婴幼儿配方奶粉中CPPs的含量,因此可用于婴幼儿配方奶粉的检测。钡盐沉淀法原理是钡离子和磷酸化肽段形成稳定的络合物,通过干燥后称质量的方法定量检测酪蛋白磷酸肽的含量。本实验中,钡盐沉淀法所得样品结果远大于标示值。可能的原因是样品中其他组分也和钡离子结合,从而导致检测结果偏高。
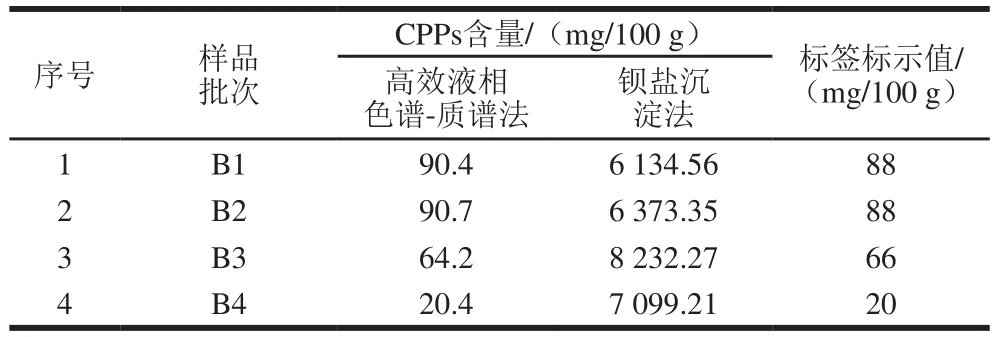
表5 婴幼儿配方奶粉中CPPs的含量Table 5 Actual and measured contents of CPPs in infant formulas
3 结 论
本实验通过高分辨质谱、Proteome Discoverer 2.1软件和Uniprot蛋白质组学数据库查询获得了酪蛋白的详细的肽段信息,经过低分辨质谱的反复实验确定了7 条可选择的肽段,再经第2次精选,确定序列LSQSKVLPVPQK的肽段作为对强化CPPs的产品定量检测的特异肽段。并且设计合成了可提供质谱准确定量的同位素内标。分别建立了适用与高含量原料和低含量强化样品的预处理方法;经对反复多批次的实际样品检测确定了特异肽段含量的折算系数和计算公式,可根据原料中CPPs的含量对婴幼儿配方奶粉中CPPs的定量检测。
方法学验证实验结果表明:方法具有良好的特异性,可排除样品中其他蛋白质的干扰;线性范围为10~150 mg/100 g,定量限为1 mg/100 g,不同含量样品的准确度与精密度结果良好。本方法相比于钡盐沉淀法具有前处理简单、分析速度快、灵敏度高、定量结果准确、检测限低等优点,适用于低含量CPPs的检测;本方法的建立为强化CPPs的婴幼儿配方奶粉中CPPs的定量检测提供了行之有效的手段。
