人结直肠癌中两种新分子生物标记物的筛选
2018-09-26赵宋礼李延鹏刘兴木彭红瑜屈军乐盛司潼王晓梅
许 特,王 筠,赵宋礼,李延鹏,刘兴木,钟 姗,彭红瑜,屈军乐,盛司潼,王晓梅
1)深圳大学生命与海洋科学学院,广东深圳518060; 2)深圳大学光电工程学院,光电子器件与系统重点实验室,广东深圳518060;3)佛山市三水区人民医院,广东佛山 528100; 4)汕头大学医学院第二附属医院,广东汕头 515065;5)深圳大学医学部,广东深圳518060
结直肠癌是人类最常见的恶性肿瘤之一,全球发病率居恶性肿瘤第3位[1]. 近年来,人们饮食结构和生存环境随着经济社会的高速发展而改变, 结直肠癌在中国的发病率呈上升趋势[2],致死率高居恶性肿瘤排名榜第5位[3]. 结直肠癌的发生发展与大多数肿瘤类似,可分为异常增生、原位肿瘤、恶性侵润和远端转移等数个病程阶段.当前,对结直肠癌的治疗策略主要是确诊后的外科手术、放射治疗和化疗[1],但此时癌症多已处于中晚期,可发生淋巴结转移和远处器官转移,如肝脏[4]、大脑或肺部等[5],故大部分患者已不能通过以上方案有效治愈,5年内存活率不到60%. 因此,如果在癌症初发期就能确诊并采取有效的治疗手段,病人存活率无疑会大幅提升. 但迄今为止,结直肠癌的早期诊断依然处于瓶颈阶段. 对结直肠癌发病机制的深入研究和分子层面上的靶向标志物筛选已成为科学家关注的热点.
TAF1L(TATA-box binding protein associated factor 1 like,又称TAF(Ⅱ)210)基因主要生物学功能与同源物TAF1类似[6-7].TAF1基因主要作为TATA box结合蛋白,参与核糖核酸(ribonucleic acid,RNA)聚合酶相关的转录起始过程,是转录起始复合物TFⅡD的重要组成部分[8-9]. 据文献[10]报道,TAF1L为体细胞突变最多(约为10.6%)的基因之一,在口腔鳞状细胞癌中,TAF1L与TAF1基因的突变能激发体细胞突变. 胃癌、结直肠癌与TAF1L以及其同源物TAF1的突变有关[6],但它们在癌症发生过程中的分子作用机制并不清楚. stomatin-like protein 1(STOML1)基因主要存在于细胞囊泡和细胞膜,可调节离子通道活性[11],参与调控细胞膜系统上的离子通道外围膜蛋白,调节胞外离子进出细胞速率[12]. STOML1蛋白在游离的N端和C端上有特殊的结构域,可通过与其他调节因子结合参与原癌基因的退化调控[13]. 此外,前期研究也发现,STOML1可能参与口腔鳞状上皮细胞癌的发生发展[14].TAF1L和STOML1基因可能在癌症发病机制的调控领域发挥了重要作用.因此,为进一步探究这两个基因在结直肠癌发生发展中的生理与病理功能,本研究利用优化的多重免疫组织化学染色技术,在高通量微阵列组织芯片上观察、比较TAF1L和STOML1基因在癌组织与相匹配的癌旁正常组织上的分布及表达差异;分析其在结直肠癌不同临床及病理分期的表达变化,判断它们是否与结直肠癌的发生发展相关,并评估可否作为新的结直肠癌的分子标志物,以辅助结直肠癌的早期诊断、疗效评估及预后判定提供实验依据.
1 材料与方法
1.1 组织标本
微阵列组织芯片(CO803a,US Biomax)购于西安艾丽娜生物科技有限公司,共有结直肠组织80例,其中,腺癌39例、印戒细胞癌1例、相匹配的癌旁结肠组织40例.
1)根据临床分期分类.结直肠癌临床Ⅰ期组织4例、Ⅱ期组织21例、Ⅲ期组织15例.
2)根据病理分型分类.低分化组织14例、中分化组织12例、高分化组织11例.
3)按照tumor-lymph node-metastasis(TNM)分期分类.T2期组织切片4例,均为N0期(因不包含淋巴结转移的组织);T3期组织切片23例,其中,未发生淋巴结转移的11例,为N0期;出现了淋巴结转移的12例,均为N1期;T4期组织切片13例,3例发生了淋巴结转移,其中,2例为N1期、1例为N2期.所以,从组织芯片上共观察分析N0期癌组织25例,N1期癌组织15例. 因为该结直肠癌组织芯片上缺少T1期组织,故此次T1期组织不纳入统计范围. 由于N2期的组织切片样本数量太少,无法进行统计学计算,故N2期也不纳入此分析.另外,所有结直肠癌组织切片中均未出现远处转移情况,都处于M0期,故不进行M分期分析.
1.2 多重免疫组织化学染色
运用本实验室改良的多重免疫组织化学染色技术,在同一微阵列组织芯片上,先进行TAF1L抗体染色,显微镜拍照,随后芯片脱色,再进行STOML1抗体染色,并记录特异性信号和数据统计.
1.2.1 组织切片首次染色处理
组织切片首次染色步骤为:① 将石蜡包埋的组织芯片置于60 ℃烘箱2 h;② TO透明剂脱蜡10 min后,梯度酒精依次浸泡各5 min,PBS缓冲液清洗3遍,每次5 min;③ 将芯片置于抗原修复蒸锅加热30 min,自然冷却至室温,PBS清洗3遍,每次5 min;④ 一抗孵育过夜;⑤ PBS清洗3遍,每次5 min;⑥ 滴加PV9000反应增强液,室温孵育20 min,PBS清洗3遍,每次5 min;⑦ 滴加PV9000增强酶标抗兔IgG聚合物,室温孵育20 min, PBS清洗3遍,每次5 min;⑧ AEC检测试剂盒显色,将组织芯片置于苏木素染液中染色, 且自来水流缓冲10 min; ⑨甘油明胶封片.
1.2.2 组织切片脱色与复染处理
将组织切片置于60 ℃水浴锅中浸泡10 min,用体积分数为80%的乙醇溶解3-氨基-9-乙基咔唑(3-amino-9-ethylcarbazole,AEC)染色,PBS缓冲液清洗3遍,每次5 min.后续的再次染色操作自抗原修复始,余同第1次染色步骤.
1.2.3 图像采集与数据分析
利用蔡司显微镜进行扫描拍照,ZEN成像软件观测阳性信号. 综合染色强度和阳性细胞占总细胞数的百分比等参数,依据文献[15-17],采用如下标准:
1)染色强度.强(深红棕色)计3分;中等(红)计2分;弱(浅红)计1分;无着色(蓝)计0分.
2)阳性细胞率.阳性细胞(染色为红色的细胞)所占总细胞数百分比>75%计4分;51%~75%计3分;26%~50%计2分;6%~25%计1分;≤5%计0分.
总积分=染色强度×阳性细胞率
(1)
总积分≥4分,判定为阳性;总积分<4分,判定为阴性. 分级标准:0~1分视为阴性(-);2~3分为可疑阳性染色(±);4~5分为阳性染色(+);6~7分为中等阳性染色(++);≥8分为强阳性染色(+++).
2 结果与分析
2.1 TAF1L蛋白质在结直肠癌组织芯片上的免疫组织化学染色结果
免疫组织化学染色的阳性结果呈现红色或棕红色着色信号. 图1染色结果显示,在癌旁组织中,染色结果为阴性,而在结直肠组织中,染色为中等阳性或强阳性. TAF1L主要在胞浆中表达、部分在细胞核中表达,如图1(a)和(b). 此外,图1(c)染色综合评分结果表明,TAF1L在结直肠癌组织中表达呈显著上调,P<0.000 1. 由此说明,TAF1L蛋白的高表达很可能与结直肠癌的病变直接相关.

图1 免疫组织化学染色显示TAF1L蛋白质在癌旁组织和结直肠癌组织中的表达情况Fig.1 TAF1L protein expression in the paratumor and colorectal cancer with immunohistochemistry
2.2 TAF1L蛋白在结直肠癌患者不同临床参数与病理分期、分级间的免疫组织化学染色结果
为分析TAF1L蛋白在结直肠癌组织上的表达与其临床参数之间的关系,利用免疫组织化学染色技术对TAF1L蛋白在结直肠癌不同临床分期、病理分级、TNM分期间的表达水平进行观察,结果见图2至图4,统计分析结果见表1.
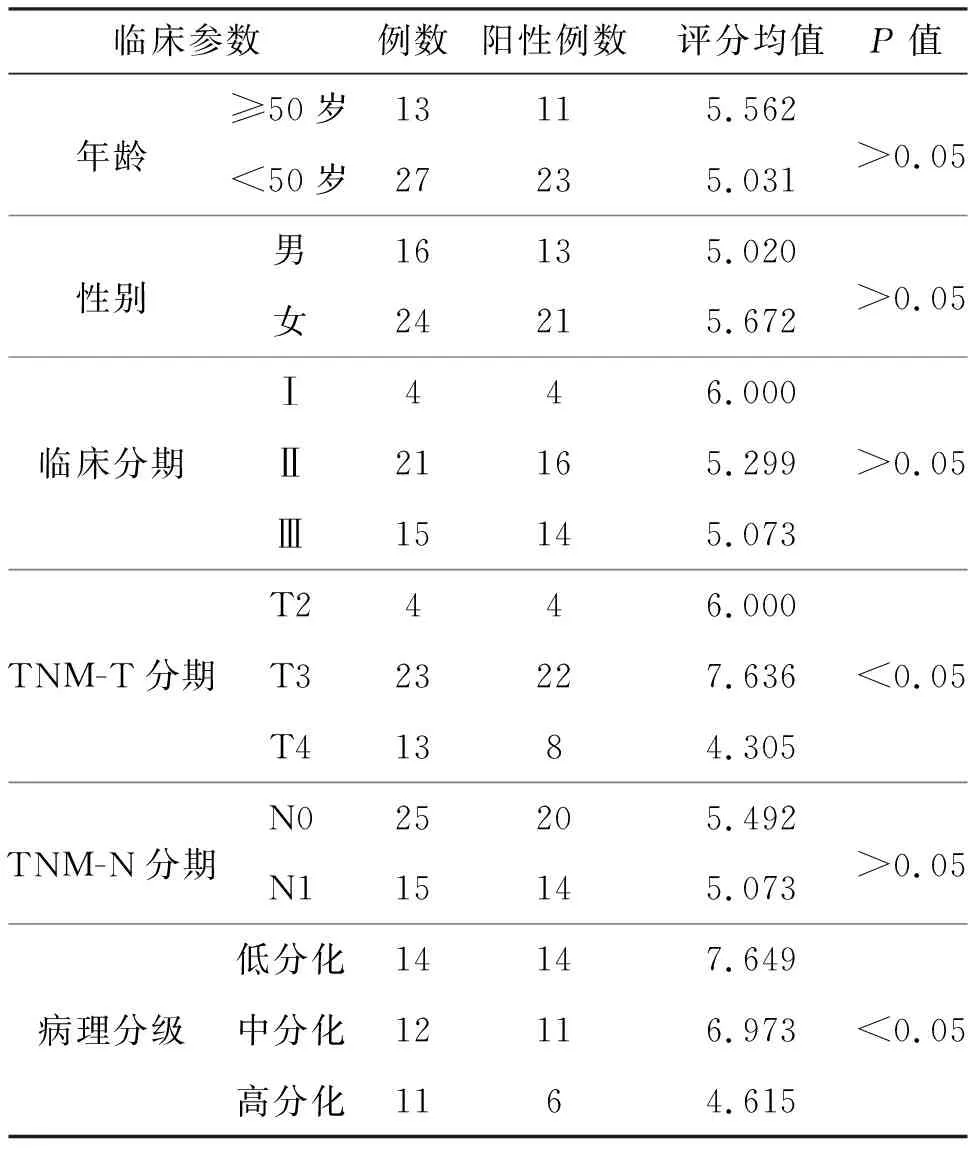
表1 结肠癌组织芯片参数及TAF1L蛋白在结肠癌的表达情况
2.2.1 TAF1L蛋白在结直肠癌不同临床分期中的表达情况
运用One Way-ANOVE方法对癌旁正常组织与结直肠癌不同临床分期组织进行统计分析(图2).由图2可见,TAF1L在结直肠癌不同临床分期组织中表达均高于癌旁正常组织;临床Ⅱ期及Ⅲ期癌组织染色显著高于癌旁正常组织(P<0.05,P<0.01),见图2(a)至(d).分析表明,TAF1L蛋白的表达水平随病程恶化而增高,但不同临床分期间的阳性表达差异无统计学意义(P>0.05), 见图2(e).
2.2.2 TAF1L蛋白质在结直肠癌不同病理分级中的表达
图3结果显示,TAF1L蛋白质在结直肠癌不同病理分级中的染色强度均高于癌旁正常组织.在高分化和中分化的癌组织中,表达显著上调,分别为P<0.05和P<0.01. 而在低分化癌组织中,P>0.05,虽表达上调,但无统计学意义.
2.2.3 TAF1L蛋白在结直肠癌TNM分期中的表达
在结直肠癌组织TNM分期中,TAF1L阳性表达率呈增加趋势.对于TNM-N分期,相较癌旁正常组织,N0和N1组均显著增加,分别为P<0.01和P<0.001, 见图4(b)、(c)和(g),但N0和N1组间增加不明显,无统计学意义(P>0.05). 对于TNM-T分期,相比癌旁正常组织,TAF1L在T2、T3和T4期组织表达均有不同程度增加,T3期最为显著(P<0.000 1), T2和T4均无统计学意义(P>0.05), 见图4(d)、(f)和(h).
此外,对组织芯片中患者的年龄和性别进行卡方检验、t检验与One Way-ANOVE半定量检验,结果显示,各组数据相差较小.表明TAF1L蛋白质在结直肠癌上的表达与患者的年龄及性别关系不大.
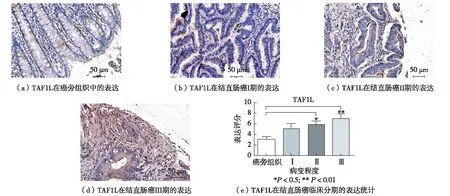
图2 TAF1L蛋白在癌旁组织和结直肠癌不同临床分期中的免疫组织化学染色Fig.2 TAF1L protein expression at different clinical stages of colorectal cancer with immunohistochemistry

图3 TAF1L蛋白质在癌旁组织和结直肠癌不同病理分级中的免疫组织化学染色Fig.3 TAF1L protein expression at different pathological grades of paratumor and colorectal cancer with immunohistochemistry
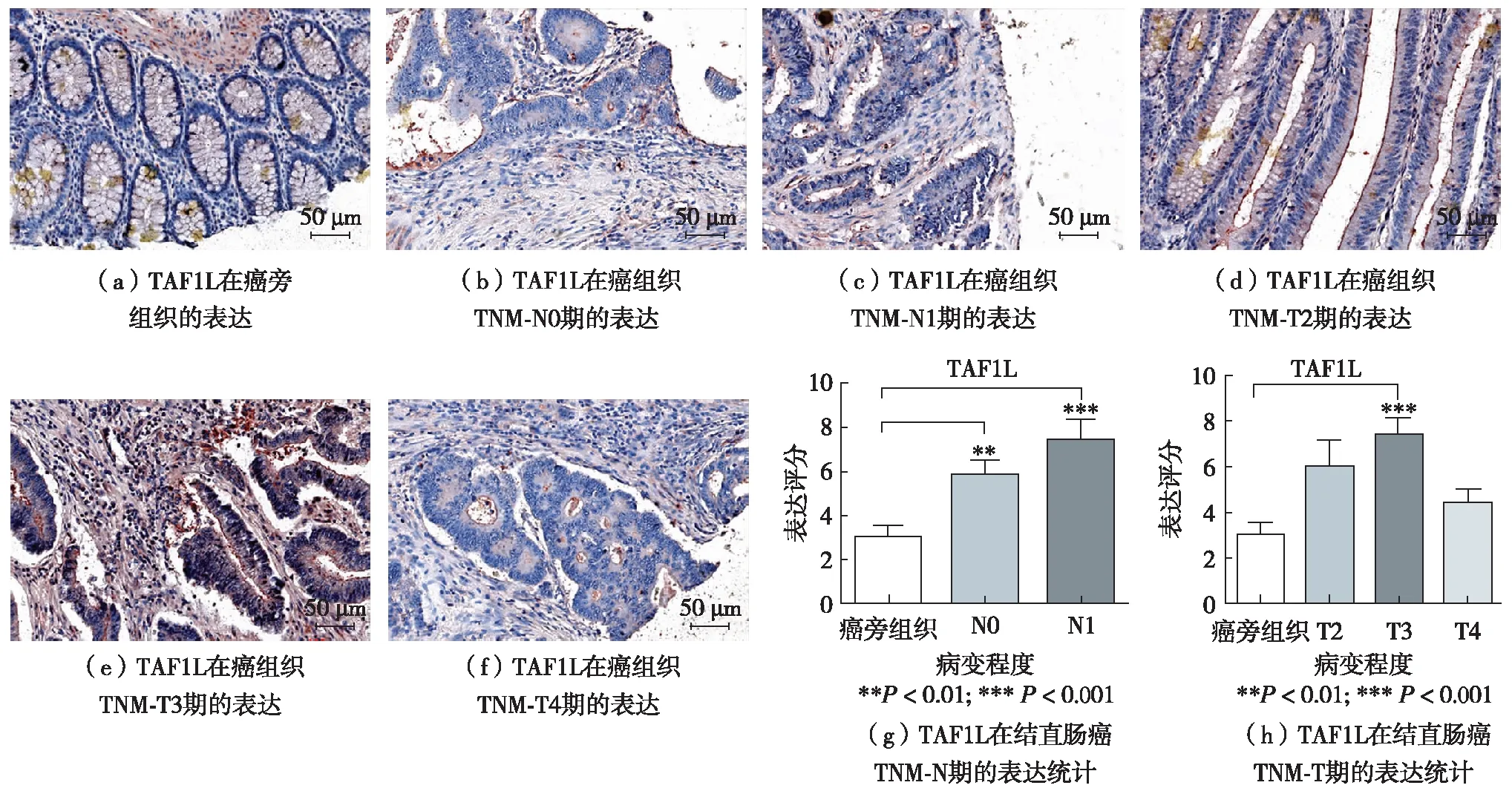
图4 TAF1L蛋白在癌旁组织和结直肠癌TNM分期中的免疫组织化学染色Fig.4 TAF1L protein expression at paracancer and TNM of colorectal cancer with immunohistochemistry
2.3 STOML1蛋白在结直肠癌组织芯片上的免疫组织化学染色结果
免疫组织化学染色结果显示,STOML1主要在细胞膜和胞浆内表达,部分阳性信号出现在细胞核中,见图5(a). 统计方法同上述TAF1L. 图5染色综合评分结果表明,与癌旁正常组织比对,STOML1在结直肠癌组织表达无明显差异.因此,不再进一步分析STOML1在结直肠癌不同临床分期、病理分级、TNM分期以及性别、年龄等疾病参数方面的表达差异性.
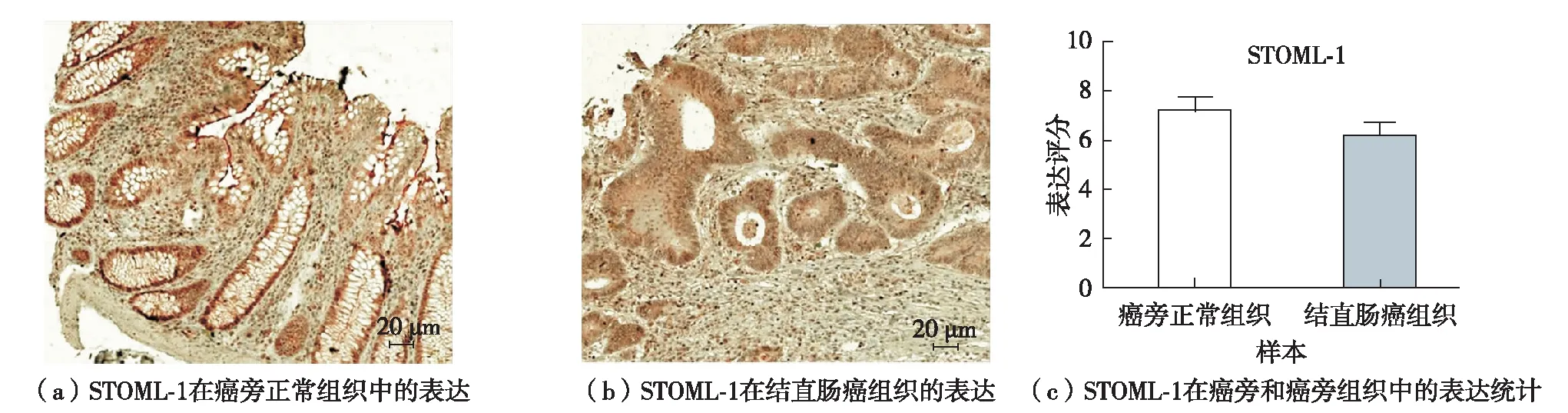
图5 STOML1蛋白质在结直肠癌组织及相匹配的癌旁组织中的表达情况Fig.5 STOML1 protein expression in paratumor and colorectal cancer with immunohistochemistry
3 讨 论
本研究选用微阵列组织切片作为实验对象,克服了肿瘤组织标本大样本群采集受限和高通量组织切片多源性所致的难以标准化评判等缺陷. 并将本课题组优化的多重免疫组织化学染色技术和计算机数字扫描用于微阵列组织切片的染色、观察、记录和分析,极大地提高了组织芯片利用效率和应用范围.
寻找新的、精准的、有效的分子生物靶标,目前是结直肠癌诊治研究和治疗的重点. 近年来,随着二代测序技术的快速发展,一些研究揭示在肿瘤的病变进程中可伴随TAF1L基因突变[18].TAF1L基因可通过突变导致肿瘤内异质性,包括在微卫星不稳定性型的胃癌和结直肠癌中发挥作用[7].前期研究显示,TAF1的Thr55位点磷酸化p53,导致p53从p21启动子解离,进而使DNA损伤修复反应中的p53依赖性转录失活[19]. 另有报道指出,TAF1可调节细胞生长,与细胞周期相关,并在基因毒性应激中具有细胞凋亡调节作用[20-22].前期通过RNA-Seq数据中分析确认了TAF1L基因在口腔鳞状细胞癌中存在突变累积[14].本研究通过多重免疫组织化学染色法、电子数字扫描和软件分析,结果表明,与癌旁组织相比较,TAF1L蛋白质在结直肠癌组织中呈高表达,差异具有显著的统计学意义(P<0.000 1). 逐步分析还发现,TAF1L的高表达与结直肠癌的临床分期、病理分级和TNM分期等病变程度均具有一定的相关性.在结直肠癌不同临床分期组织中其表达水平均高于癌旁正常组织,临床Ⅱ期及Ⅲ期癌的组织阳性信号染色显著高于癌旁正常组织(P<0.05与P<0.01); 在结直肠癌不同病理分级中其阳性信号均高于癌旁正常组织,分别在高分化和中分化的癌病灶表达呈显著性上调(P<0.05与P<0.01). 但在低分化癌变组织中,虽也表现出上调趋势,但无统计学意义(P>0.05); 在结直肠癌TNM分期中,相比癌旁正常组织,N0和N1组均呈显著性增加,分别为P<0.01和P<0.001, 但N0和N1组间增加不明显,差异无统计学意义(P>0.05). 对于TNM-T分期,相比癌旁正常组织,TAF1L在T2、T3和T4期组织表达均不同程度增加,在T3期表现为最为显著(P<0.000 1), T2和T4差异均无统计学意义(P>0.05).由此,进一步确定了TAF1L基因的高表达在结直肠癌发生发展中具有重要的生理与病理意义.本研究无统计学意义的部分结果可能是由于个别组别的样本量小,导致平均值偏大,使变化趋势不明显或无统计学意义;或因各个组别的样本量不匀衡,有极少组别样本缺失,使一些数据无法参与统计学处理. 例如,各组临床参数之间经分析,TAF1L虽有高表达趋势,但与病变程度差异无统计学意义.
本实验结果提示,TAF1L基因有可能是结直肠癌的致病基因或参与调控病变发展的关键因子.需要进一步扩大样本量,通过细胞和动物模型,深挖其生物学意义和作为结直肠癌诊治标志物的潜在能力.
本研究重点检测、观察、分析了TAF1L与STOML1两个蛋白质组织原位表达水平在结直肠癌组织中的改变,以及其与结直肠癌临床分期、病理分级和TNM分期等相关病程特征指标的可能关联,预测评估它们作为该肿瘤精准诊治的生物靶标的可能性,并为进一步完善结直肠癌的致病机制提供了新的分子病理依据.
