半夏多糖对脂多糖诱导人肺微血管内皮细胞损伤的保护作用
2018-09-12祝春燕潘雨萍吴伟斌
罗 超,祝春燕,潘雨萍,吴伟斌
(1.绍兴文理学院元培学院,浙江绍兴 312000;2.绍兴文理学院附属医院综合康复科,浙江绍兴 312000;3.肇庆医学高等专科学校,广东肇庆 526020)
急性肺损伤(acute lung injury,ALI)是心源性以外的各种肺内外致病因素引起的急性、进行性缺氧性呼吸衰竭,是肺部炎症和通透性增加的综合征,其严重恶化阶段为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1]。研究认为,细菌感染导致的脓毒血症及严重肺炎是ALI最常见的诱发因素[2]。在严重感染期,大量的脂多糖(lipopolysaccharide,LPS)被细菌释放进入循环系统,被细胞膜上相应受体所识别,进而攻击靶细胞。人肺微血管内皮细胞(human pulmonary microvascular endothelial cells,hPMEC)是肺气血交换的物质基础,也是肺部最早受到LPS攻击的效应细胞[3]。LPS的刺激一方面增加hPMEC细胞壁的通透性,引起肺部蛋白渗出及水肿;另一方面,LPS通过刺激内皮细胞分泌肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),白细胞介素6(interleukin-6,IL-6)和IL-8等炎症细胞因子以及细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)等黏附分子,诱导大量中性粒细胞的聚集,导致肺组织的氧化损伤和炎症反应,促进肺损伤的发展[4-5]。
半夏(Pinelliae Rhizoma)为天南星科植物半夏〔Pinellia ternata(Thunb.)Breit〕的干燥块茎[6]。其生药有毒,常以炮制品入药,具有燥湿化痰、降逆止呕、消痞散结之功效,是呼吸系统疾病的常用中药。研究表明,半夏提取物及其经典方剂在哮喘、急慢性支气管炎等肺部炎症性疾病中有着良好的治疗效果[7-8]。抗炎实验研究显示,半夏及其炮制品提取物能降低小鼠主动脉内皮细胞炎症损伤时IL-6和TNF-α的表达,降低内皮细胞的炎症反应[9]。半夏多糖(polysaccharide from Pinelliae Rhizoma,PSPR)具有抗肿瘤、抗炎和抗氧化的生物活性[10-11],是半夏的主要活性部位之一。本研究以《中国药典》收录的3种半夏(姜半夏、法半夏和清半夏)炮制品为受试药原料,提取PSPR,以LPS诱导的hPMEC为模型,研究PSPR对ALI早期hPMEC炎症损伤的保护作用,为PSPR应用于ALI治疗提供实验基础。
1 材料与方法
1.1 药物、试剂和仪器
清半夏(产地:河南,批号160401)、姜半夏(产地:河南,批号160226)和法半夏(产地:湖北,批号160301)(河南张仲景大药房)。经肇庆医学高等专科学校药学系唐铁鑫副教授鉴定为天南星科植物半夏的块茎,符合《中国药典》2015年版项下标准。
D-无水葡萄糖对照品(批号:110833-201506)(中国食品药品检定研究院);M131培养基、胎牛血清、谷氨酰胺、微血管细胞生长因子(microvascular growth supplement,MVGS)和黏附因子(美国Gibco公司);LPS(美国Sigma公司);CCK-8检测试剂盒(上海碧云天生物);TNF-α,IL-1β,IL-6和IL-8 ELISA检测试剂盒(深圳达科为生物技术有限公司);BCA蛋白定量试剂盒和ECL发光液(杭州弗德生物);兔抗人IL-8多克隆抗体和兔抗人ICAM-1多克隆抗体(美国Affinity Biosciences公司);辣根过氧化物酶标记的山羊抗兔IgG二抗(美国Jackson ImmunoRe⁃search公司);逆转录试剂盒(德国DBI试剂);Trizol和定量PCR检测试剂盒(北京天根);PCR引物由上海捷瑞生物工程有限公司合成。
旋转蒸发仪(上海亚荣),生物倒置显微镜(日本Olympus),CO2细胞培养箱和多功能酶标仪(美国Thermo Scientific),荧光定量PCR仪(美国ABI),微量核酸定量仪(美国Merinton),电泳仪及转移装置(北京六一)。
1.2 PSPR的制备
半夏药材60℃烘干至恒重,粉碎,精密称取相同质量的3种半夏炮制品,先后用石油醚、乙醇各浸渍6 h进行脱脂,挥干溶剂,90℃热水抽提3次,每次2 h,过滤,合并滤液,减压蒸馏浓缩,向浓缩液中加入无水乙醇,至乙醇浓度达80%,4℃孵育24 h,离心收集沉淀,挥干,60℃热水复溶后,Sevag法除蛋白,离心取上清,移入3500 U透析袋透析48 h,除去水溶性小分子,透析液加入乙醇沉淀,收集沉淀,分别用乙醇、丙酮和乙醚清洗3次,干燥收集总多糖[11]。以D-无水葡萄糖为对照品,采用苯酚-硫酸法测定PSPR中糖含量[12],紫外分光光度计490 nm检测吸光度,根据标准曲线(y=9.5424x+0.0124,R2=0.9999),计算得到3种PSPR中多糖含量分别为87.0%(法半夏)、85.3%(姜半夏)和89.6%(清半夏)。并根据提取率公式〔提取率(%)=多糖质量/药材质量×100%〕计算3种半夏炮制品饮片中多糖的含量分别为4.97%(法半夏)、14.83%(姜半夏)和11.21%(清半夏)。
1.3 细胞及分组
hHPMEC-ST1.6R[13]受赠于德国美因兹大学病理研究所KIRKPATRICK教授;培养于含20%胎牛血清、谷氨酰胺2 mmol·L-1和5%MVGS的M131培养基,置于5%CO2,37℃培养箱中培养,2~3 d换液1次,待细胞生长至70%~80%融合度后进行传代,4~6 d传代1次。
以基础培养基为溶剂对照组,设LPS 1 mg·L-1作用24 h组和LPS+PSPR组(3种PSPR 100和400mg·L-1分别与LPS1mg·L-1同时加入,作用24h)。
1.4 CCK-8法检测细胞存活
调整细胞密度为1×108L-1,加入96孔板内,每孔100 μL,置37℃,5%CO2培养箱培养24 h后按1.3分组加药处理,作用24 h后,每孔加入20 μL CCK-8试剂,置细胞培养箱内继续孵育4 h后,酶标仪450 nm测定吸光度(A450nm)值,计算细胞存活率。存活率(%)=(加药组A450nm-空白组A450nm)/(对照组A450nm-空白组A450nm)×100%。
1.5 ELISA检测细胞培养液中TNF- α,IL-1 β,IL-6和IL-8含量
调整细胞密度为1×108L-1,加入96孔板内,每孔100 μL,置37℃,5%CO2培养箱培养24 h后,按1.3分组加药处理,作用24 h,收集细胞上清液,采用ELISA法测定细胞培养液中TNF-α,IL-1β,IL-6和IL-8的含量,按试剂盒说明操作,酶标仪测定A450nm值,根据标准曲线计算含量。
1.6 Western蛋白质印迹法检测IL-8和ICAM-1蛋白表达
按每孔1×106细胞接种12孔板,按1.3分组加药处理24 h后,收集各组细胞,用RIPA裂解液裂解细胞,离心取上清,以BCA蛋白定量试剂盒测定总蛋白浓度,然后进行SDS-PAGE电泳分离蛋白并转膜,5%脱脂奶粉封闭1 h,兔抗人IL-8多抗、兔抗人ICAM-1多抗(1∶1000)4℃孵育过夜,洗膜后,室温下加辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶5000)孵育30min,最后通过ECL化学发光法显影成像,利用Image J软件进行蛋白相对积分吸光度分析,以β肌动蛋白为内参,以目标蛋白与β肌动蛋白积分吸光度值比值表示IL-8和ICAM-1蛋白相对表达量。
1.7 实时定量PCR检测细胞IL-8和ICAM-1 mRNA水平
按每孔1×106细胞接种12孔板,按1.3分组加药处理24 h后,收集各组细胞,以Trizol法提取细胞总RNA,逆转录成cDNA,以GAPDH为内参,在荧光定量PCR仪上用相应的引物、cDNA等材料按步骤进行扩增,采用2-ΔΔCt相对定量法进行基因表达分析。IL-8和ICAM-1对应的PCR引物如表1所示。

Tab.1 Sequences of RT-PCR primers
1.8 统计学分析
实验结果数据用x±s表示,应用SPSS 18.0软件进行统计分析,多样本均数间比较采用one-way ANOVA检验,组间的两两比较采用LSD法,P<0.05为差异具有统计学意义。
2 结果
2.1 PSPR对LPS诱导的人肺微血管内皮细胞存活率的影响
CCK-8结果(图1)显示,与溶剂对照组相比,LPS组细胞存活率显著降低(P<0.01);与LPS组相比,3种PSPR 100和400 mg·L-1组细胞存活率显著升高(P<0.01)。
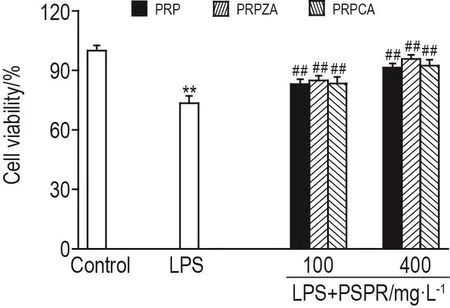
Fig.1 Effect of three kinds of polysaccharides from Pinelliae Rhizoma(PSPR)on cell viability of human pulmonary microvascular endothelial cells(hPMECs).PRP:Pinelliae Rhizoma Praeparatum;PRPZA:Pinelliae Rhizoma Praeparatum Cum Zingibere Et Alumine;PRPCA:Pinelliae Rhizoma Praeparatum Cum Alumine.Cells were pretreated with PSPR 100 and 400 mg·L-1and then with lipoapolysaccha⁃ride(LPS)1 mg·L-1for 24 h.±s,n=5.**P<0.01,compared with vehicle control group;##P<0.01,compared with LPS 1 mg·L-1 group.
2.2 PSPR对LPS诱导的人肺微血管内皮细胞TNF- α,IL-1 β,IL-6和IL-8释放的影响
与溶剂对照组相比,LPS 1 mg·L-1组细胞培养液中TNF-α,IL-1β,IL-6和IL-8含量升高(P<0.01)(图2),提示LPS作用导致hPMEC发生炎症反应,分泌炎症因子。与LPS 1 mg·L-1组相比较,3种PSPR 100和400 mg·L-1组细胞培养液中TNF-α,IL-1β,IL-6和IL-8含量均降低(P<0.01),提示3种PSPR在100和400 mg·L-1浓度对LPS诱导的hPMEC炎症损伤有起到保护作用。

Fig.2 Effect of PSPR on tumor necrosis factor- α(TNF-α),interleukin-1 β (IL-1 β),IL-6 and IL-8 release from LPS-induced hPMECs.See Fig.1 for cell treatment.±s,n=3.**P<0.01,compared with vehicle control group;##P<0.01,compared with LPS 1 mg·L-1group.
2.3 PSPR对LPS诱导的人肺微血管内皮细胞IL-8和ICAM-1蛋白表达的影响
Western蛋白质印迹法结果显示(图3),与溶剂对照组相比,LPS刺激能促使hPMEC内IL-8和ICAM-1蛋白表达显著升高(P<0.01)。与LPS组相比,3种PSPR 100和400 mg·L-1组细胞IL-8和ICAM-1的表达均降低(P<0.01)。以上结果提示,3种PSPR在100和400 mg·L-1浓度下能够有效降低LPS诱导的hPMEC中IL-8和ICAM-1表达升高。
2.4 PSPR对LPS诱导的人肺微血管内皮细胞IL-8和ICAM-1 mRNA水平的影响
与溶剂对照组相比,LPS刺激导致hPMEC内IL-8和ICAM-1 mRNA水平显著升高(P<0.01)(图4)。与LPS 1 mg·L-1组相比,3种PSPR 100和400 mg·L-1组均可显著降低细胞内IL-8和ICAM-1 mRNA的水平,(P<0.01)。提示3种PSPR在100和400 mg·L-1浓度对LPS诱导的hPMEC IL-8和ICAM-1 mRNA水平具有一定的抑制作用。

Fig.4 Effect of PSPR on IL-8(A)and ICAM-1(B)mRNA level in hPMECs induced by LPS detected by RT-PCR.
3 讨论
本研究结果显示,3种PSPR对LPS诱导的hPMEC炎症损伤有显著的保护作用,抑制LPS诱导的TNF-α,IL-1β和IL-6释放,并能从基因水平抑制IL-8和ICAM-1的表达。上述结果表明,PSPR可通过抑制TNF-α,IL-1β和IL-6等早期促炎因子的释放而保护LPS损伤的hPMEC,缓解ALI早期hPMEC的损伤;此外,PSPR还可有效抑制IL-8和ICAM-1的表达,缓解IL-8和ICAM-1过表达而触发的中性粒细胞趋化作用,减缓中性粒细胞聚集,延缓肺损伤的发展。
PMEC损伤和功能失调是ALI发病机制的中心环节[14],LPS刺激内皮细胞活化,触发炎症反应,释放大量促炎因子,导致细胞凋亡或功能障碍,增加血管通透性,促进循环中的炎症细胞穿过血管内皮屏障向肺部聚集,进而引起机体产生一系列级联反应,导致肺组织的进一步损伤[15-16]。TNF-α,IL-1β和IL-6是ALI早期发展过程中的主要促炎因子,这些因子不仅可直接导致肺损伤,还可激活其他信号通路,促进炎症因子的表达,导致肺损伤[17]。TNF-α是炎症的重要启动子,是ALI最先出现的细胞因子,可诱导IL-1,IL-6和IL-8等炎症因子的分泌,促进炎症反应,其分泌水平与肺部损伤程度呈正相关[18]。IL-1β是一种调节自然免疫的细胞因子,可诱导调控其他炎性因子在多种细胞中的表达,在炎症反应中起协同作用[19]。IL-6是启动全身炎症反应的最强内源性炎症因子,在ALI中,IL-6可直接损伤内皮细胞,导致血管通透性增加[20]。3种PSPR均可通过抑制TNF-α,IL-1β和IL-6等促炎因子的释放而缓解LPS诱导的hPMEC损伤,并有助于缓解促炎因子引起的进一步炎症级联扩大反应和肺组织的进一步损伤,达到减轻ALI炎症损伤的效果。
中性粒细胞募集在ALI/ARDS的炎症反应中起着关键作用,而IL-8和ICAM-1对中性粒细胞的激活及向肺组织聚集具有重要的影响。IL-8是体内潜在的中性粒细胞趋化因子,研究显示,ALI/ARDS患者存在IL-8表达升高的现象,抑制IL-8可有效缓解肺部炎症和组织损伤[21]。除诱导中性粒细胞聚集外,IL-8还可上调内皮细胞中性粒细胞β2黏附受体表达,介导中性粒细胞在内皮细胞间迁移,激活中性粒细胞[22],进一步导致肺组织的氧化损伤和炎症反应,促进肺损伤的发展。ALI发病过程中,ICAM-1表达升高,与中性粒细胞表面的整合素相互作用,介导中性粒细胞黏附于内皮细胞[23-24]。此外,ICAM-1还是介导中性粒细胞参与肺损伤级联扩大反应的分子生物学基础,能促进中性粒细胞介导的细胞毒作用[25],是预测ALI严重程度的指标。研究结果显示,3种PSPR均可抑制LPS诱导的hPMEC内IL-8和ICAM-1表达升高,具有抑制ALI中性粒细胞向肺组织聚集的潜在活性,可有效缓解因中性粒细胞激活和向肺组织聚集而引起的ALI病情进一步加重。其上游机制一方面可能与抑制TNF-α等促炎因子的释放相关,另一方面可能与NF-κB等通路对IL-8和ICAM-1 mRNA表达的调控相关。
天然产物防治ALI的应用研究越来越受到关注,人参皂苷、丁香酚、丹参酮ⅡA、汉防己碱和黄芩苷等均表现出一定的防治ALI的活性,且可通过调节NF-κB和促分裂原活化的蛋白激酶等信号通路及Toll样受体、过氧化物酶体增殖物激活受体γ和腺苷A2A受体等途径,抑制炎症反应,改善屏障功能及减轻氧化应激等ALI病理特征,显示出广阔的应用前景[26]。半夏及其方剂在治疗呼吸系统疾病方面有着悠久的历史和显著的疗效,其抗炎和镇咳的功效是其应用于ALI防治研究的潜在基础。多糖是天然产物抗炎活性的主要部位,PSPR成分复杂,主要由甘露糖、半乳糖糖羰酸、葡萄糖、半乳糖和树胶醛醣(摩尔比 1.83∶0.55∶75.75∶1.94∶0.45)等组成[27]。 本研究结果显示,3种PSPR对LPS诱导的hPMEC损伤都有显著的保护作用,其作用效果与丹参酮ⅡA和丁香酚等天然产物相近[28-29]。不同的炮制方法对半夏炮制品中多糖的含量影响较大,但对相同浓度的多糖的抗炎活性影响较小,3种PSPR抗炎活性差异无统计学意义。
本研究初步证实了PSPR对LPS诱导的hPMEC炎症损伤具有保护作用,抑制促炎因子的释放,且能从基因水平抑制相关中性粒细胞趋化因子的表达,预示着PSPR可以从急性炎症的抑制和中性粒细胞聚集的调控2个方面有效缓解ALI的发展。其总多糖中确切的起效成分及其对上游通路的影响机制值得进一步研究。
