玉米太空诱变核不育突变体矮化性状的QTL定位及分析
2018-09-08牛群凯时子文曹墨菊
牛群凯,杨 聪,时子文,曹墨菊
(四川农业大学玉米研究所/农业部西南玉米生物学与遗传育种重点实验室,成都 611130)
玉米是世界范围内种植面积最广泛的作物之一。玉米对我国粮食增产的贡献率要明显高于水稻与小麦[1],因此提高玉米产量是保障我国粮食安全重要的一步。利用玉米雄性不育系制种不仅能够省去人工去雄的繁杂劳动,同时可提升种子纯度。近年来由于SPT技术的出现有效解决了玉米隐性核不育系的保持与繁殖问题,故利用细胞核雄性不育系进行不育化制种已成为玉米杂交种制种技术的重要发展方向。
从玉米雄蕊原基开始分化直到成熟花粉粒形成期间,任何一个发育过程受阻都可能影响雄蕊的正常发育,导致败育的发生。例如ms32基因能使造孢组织发生额外的周缘细胞分裂,形成多余的壁细胞并不断向内挤压造孢细胞,同时绒毡层细胞液泡化丧失功能,使花粉母细胞畸形失活[2];ms8基因能使花粉母细胞在减数分裂中期后积累过多的胼胝质,导致花粉母细胞在第一次减数分裂后形成多核四分体,随后花粉逐渐解体[3];ms26基因与花药角质层和花粉外壁的形成有关,同时发现该基因能使绒毡层细胞高度液泡化,最终导致花粉解体[4];ipe1基因使花药角质层和乌氏体的形成受阻,同时发现孢粉素随机堆积和花粉粒外壁不规则,致使小孢子逐渐解体[5];T.Fox等[6]对玉米显性雄性不育基因Ms44进行研究,发现由于突变体中的单碱基突变导致在Ms44蛋白的信号肽切割位点处由丙氨酸转变为苏氨酸,阻碍了蛋白质的加工和绒毡层细胞中蛋白质的分泌从而导致雄性不育,不育株由于雄穗的败育使雌穗的氮素利用率增加,使单株产量得到提升。由此可见,今后对雄性不育系的利用将更加的多元化。
第一次绿色革命的出现得益于矮秆、半矮秆材料的利用。因此,株高这一性状受到育种家们的广泛关注。随着分子标记技术的出现及发展,有关株高QTL的研究取得了长足的进步并定位到了一系列株高QTL,张志明等[7]利用R15×掖478组配的F2群体定位到11个株高、穗位高QTL,分布于第 2、3、4、5 和 8 号染色体上;严建兵等[8]利用 K22×C17、K22×Dan340 的 F2群体在 1、5、6、7、9 号染色体上都定位到株高QTL。汤继华等[9]以自交系豫玉22的“永久F2”和RIL群体分别定位到12个和10个株高QTL,分布于第1,3,4,5和9号染色体。目前在MaizeGDB(http://www.maizegdb.org/)网站已经收录了共314个控制株高的QTL,这些QTL在玉米10条染色体上都有分布。Lin Y.R.等[10]通过总结他人研究发现玉米株高QTL主要集中分布在染色体bin1.06、bin1.08、bin3.04~3.06、bin8.05~8.06 和 bin10.3~10.4区域内,其中的一些主效QTL也被相继克隆。目前已报道的玉米株高相关基因有d1、na1、br2、yd2等,这些控制株高的基因通常都参与赤霉素、油菜素内酯、生长素等植物激素的合成、运输和信号传导等过程。Teng F.等[11]利用综3及其单片段导入系SL15成功克隆了一个主效株高QTL,研究发现该基因(ZmGA3ox2)编码参与赤霉素合成的GA3-β羟化酶。Xing A.等[12]利用重组自交系RIL88定位到一个主效株高位点qph1,研究发现该突变体的矮化是由于在Brachytic 2基因第5外显子处出现了一个碱基突变所致,通过抑制生长素的极性运输导致株体矮小。
人工创制矮败材料最早在小麦中获得成功,1986年中国农业科学院刘秉华等[13]利用杂交的方法将矮秆基因Rht-Dlc和太谷核不育基因Ms2进行聚合,创制出Rht-Dlc和Ms2紧密连锁的“矮败小麦”,该材料的创制为提高小麦的群体改良效率奠定了重要的材料基础。但这种通过人工杂交聚合不育与矮化性状的方法费时费力,因此通过诱变育种选育兼具雄性不育又能够降低植株高度的矮化不育突变体是最为简单有效的方法。
1996年四川农业大学玉米研究所利用返回式卫星搭载川单9号玉米种子,在其后代中得到一份受隐性单基因控制的雄性核不育突变体。该不育基因已被定位在第3染色体长臂[14],命名为ms39。经过多年观察发现大多数不育株伴随着植株矮化的现象,不育株矮化的同时还伴随着雄穗分枝数及雄穗长度的减少。本研究以不育株(ms39)与自交系B73杂交的F2代为作图群体,构建了相应的分子遗传图谱,对株高、穗位高、雄穗分枝数、雄穗长度4个性状进行QTL定位,旨在探讨该核不育材料不育与矮化之间的遗传关系,发掘相应的矮化基因。
1 材料和方法
1.1 试验材料
本研究以从卫星搭载川单9号(48-2×5003)种子后代中选育的雄性不育突变体(见图1)为材料,在姊妹交后代中选择株高与可育株存在较大差异的不育株做母本,与自交系B73杂交构建(ms39ms39×B73)F2群体。
1.2 田间试验及性状测定
2016年春,在四川温江试验基地种植(ms39ms39×B73)F2群体,并对群体内120个单株进行各个性状的表型鉴定。在植株散粉期按D.N.Duvick[15]提出的玉米雄花育性5级分级标准对每个单株的育性进行鉴定,每隔两天调查一次育性,直到群体中每个单株散粉期结束为止。在植株抽丝期后,测量每个单株的株高、穗位高、雄穗分枝数及雄穗长度。株高(PH)为测量从植株基部至主茎顶部的距离;穗位高(EH)为测量植株基部至果穗第一着生节的距离;雄穗分枝数(TBN)为统计雄穗中除主穗之外的一级分支数;雄穗长度(TL)为测量雄穗主轴的最顶端至主轴下部的第一个分枝着生处的距离。

图1 姊妹交群体中矮化不育株与可育株的比较Figure1 Comparison of dwarf sterile and fertile lines in sister cross population
1.3 遗传图谱的构建及QTL定位
利用CTAB法提取不育株(ms39)、B73及(ms39 ms39×B73)F2群体中120个单株的DNA,利用聚丙烯酰胺凝胶电泳对覆盖全基因组的1 277对分子标记进行双亲间多态性筛选,其中包括1 114对SSR和163对Indel标记。首先将各多态性标记按其所在物理位置进行染色体归类,然后检测群体中每个个体的基因型。利用软件mapmaker 3.0根据群体基因型数据计算各标记间的遗传距离(cM),结合表型数据基于完备区间作图方法(ICIM)的IciMapping Version 3.0软件中ICIM-ADD(加性-显性)模型,抽样1 000次逐步迭代(显著水平<0.05),匹配2 cM的基因组扫描速度,构建相应的遗传图谱并对(ms39 ms39×B73)F2群体的株高、穗位高、雄穗分枝数及雄穗长度进行QTL定位。
2 结果与分析
2.1 不育性状的遗传分析
通过田间育性调查发现在120株的(ms39ms39×B73)F2群体中共包含92株可育株与28株不育株,可育株与不育株的分离比例经卡平方检验符合3∶1(χ2=0.09,P>0.05),再次验证该雄性不育突变体的育性由一对隐性核基因控制。
2.2 定位群体株高及相关性状的表型分布
通过对(ms39ms39×B73)F2群体 120个单株的株高、穗位高、雄穗长度、雄穗分枝数进行作图统计(见图2),发现各性状均表现出数量遗传的特征。F2群体的株高在134.8~273.0 cm范围内连续分布,但在190~200 cm与220~230 cm两个范围均出现一个峰值,“双峰”现象的出现说明(ms39ms39×B73)F2群体中可能存在一个控制株高的主效位点。可育株平均株高为212.4 cm,不育株平均株高为173.9 cm,群体中除一株不育株株高达到204.6 cm外,其余不育株株高均分布于200 cm以下,说明群体中的大多数不育株矮于可育株,但也存在极少数“高秆不育株”;同时发现一株可育株的株高仅为138.6 cm,表明群体中同样也存在“矮秆可育株”。
(ms39ms39×B73)F2群体的穗位高在 41.1~101.4 cm范围内分布。与株高数据分布相似,不育株的穗位高均在80 cm以下,可育株的穗位高均高于80 cm,表明植株表现不育的同时也伴随着穗位高降低的现象。群体中不育株的雄穗长度在12.1~24.0 cm范围内,可育株的雄穗长度在11.2~31.2 cm范围内,雄穗长度最大及最小植株的育性均为可育。不育株雄穗分枝数在5~14范围内,可育株雄穗分枝数在4~17范围内,雄穗分支数最大及最小植株的育性也均为可育。雄穗长度及分支数分布的这一特点与株高及穗位高有所不同,在株高及穗位高最低的植株中同时存在可育株与不育株,而雄穗长度最小及雄穗分支数最低的植株均为可育株。
2.3 遗传图谱的构建
通过对分布于10条染色体上的1 277对引物进行双亲间多态性筛选,得到180对多态性分子标记用于群体基因型检测,其中包含71对Indel标记与109对SSR标记。在10条染色体上的引物及多态性标记的分布如表1所示。利用多态性标记对F2群体内所有单株进行基因分型,部分结果如图3所示。将180对多态性标记对120个单株的基因分型结果汇总,利用IciMapping Version 3.0软件构建遗传连锁图谱(见图4),该图谱总长度为1 173.4 cM,标记间的平均间距为6.63 cM。
由于本课题组前期已把该雄性核不育突变体的不育基因(ms39)定位于玉米第3染色体长臂,介于分子标记 mmc0071(物理位置:205,258,950)与umc2276(物理位置:213,258,950)之间,所以通过对第3染色体进行标记加密,重点关注在不育基因定位区间附近是否存在株高QTL,结果在第3染色体的262对分子标记中筛选到53对多态性标记用于群体基因型检测。第3染色体遗传图谱的长度为142.06 cM,标记间的平均间距为2.68 cM。

图2 (ms39ms39×B73)F2群体性状频率分布图Figure2 Frenquency distribution of several traits investigated with in(ms39ms39×B73)F2population
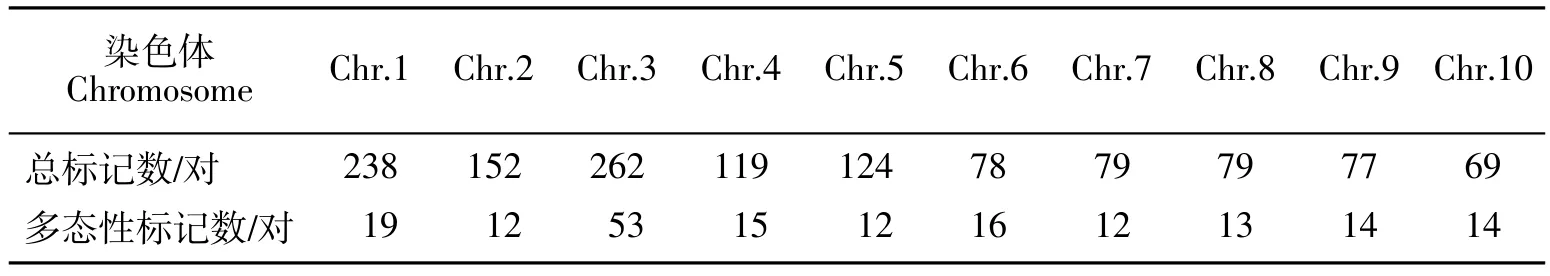
表1 (ms39ms39×B73)F2群体多态性分子标记分布表Table1 Distribution of polymorphism molecular markers in(ms39ms39×B73)F2population

图3 利用分子标记umc2075检测F2群体基因型Figure3 The electrophoretic result of part of F2plants was detected by umc2075

图4 目标性状QTL在遗传图谱上的分布Figure4 Distribution of QTL for objective traits on genetic linkage maps
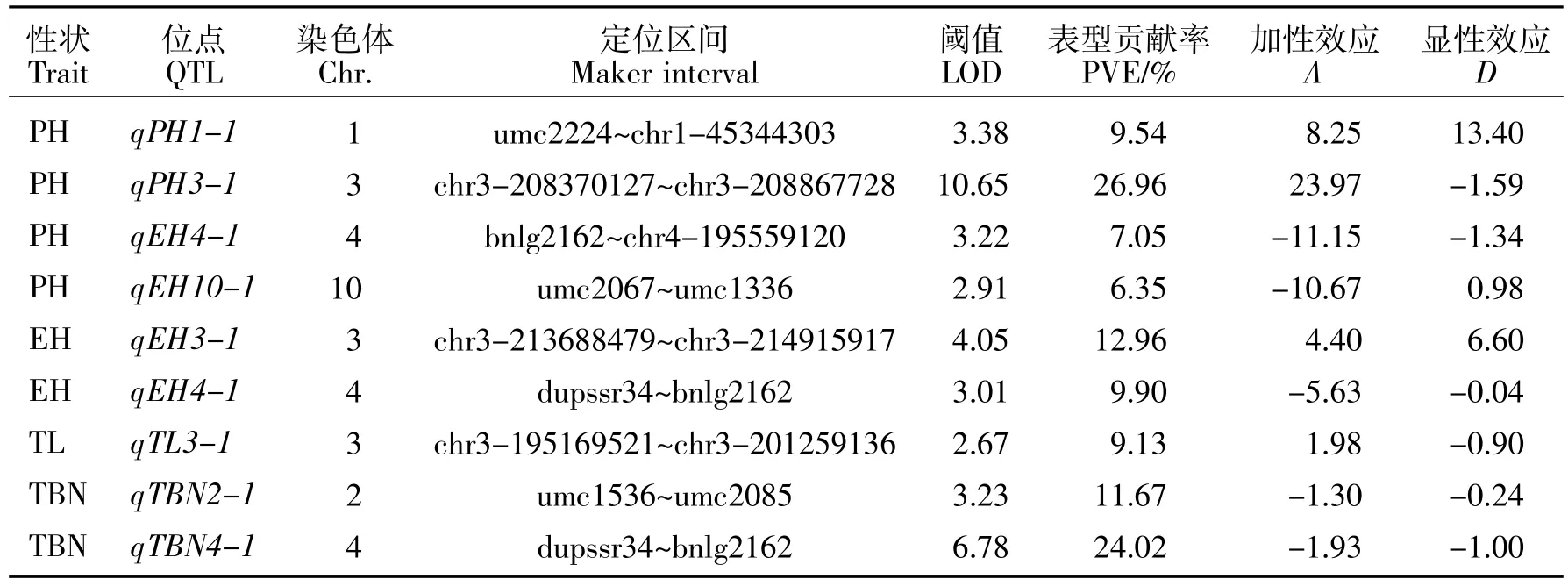
表2 (ms39ms×B73)F2群体目标性状QTL定位结果Table2 The QTL for objective traits in(ms39ms39×B73)F2population
2.4 目标性状QTL定位
利用软件IciMapping Version 3.0进行1 000次排列获得QTL显著的LOD阈值均为2.5。通过对(ms39ms39×B73)F2群体进行株高、穗位高、雄穗主穗长度、雄穗分枝数的QTL定位,共检测到9个QTL,具体分布如表2所示。其中包含4个株高QTL,分别分布在第 1、3、4、10 号染色体上;qPH1-1 位于标记 umc2224~chr1-45344303之间,LOD 值为 3.38,表型贡献率为 9.54%;qPH3-1位于标记 chr3-208370127~chr3-208867728之间,LOD 值为 10.65,表型贡献率达到26.96%;qPH4-1位于标记bnlg2162~chr4-195559120之间,LOD值为3.22,表型贡献率为7.05%;qPH10-1位于标记umc2067~umc1336之间,LOD值为2.91,表型贡献率为6.35%。在第3染色体上扫描到一个主效株高位点qPH3-1,该株高位点与不育基因定位区间几乎一致,说明该位点是引起不育株株高降低的主要原因。
同时利用该群体定位到2个穗位高QTL,qEH3-1位于第3染色体分子标记chr3-213688479~chr3-214915917之间,LOD值为4.05,表型贡献率为 12.96%;qEH4-1位于第 4染色体分子标记dupssr34~bnlg2162之间,LOD值为3.01,表型贡献率为9.9%。在第3染色体上定位到一个控制雄穗长度的QTL,qTL3-1位于分子标记chr3-195169521~chr3-201259136之间,LOD值为2.67,表型贡献率为9.13%。在第2、4染色体上各定位到一个控制雄穗分支数的QTL,qTBN2-1位于分子标记umc1536~umc2085之间,LOD值为 3.23,表型贡献率为11.67%;主效位点qTBN4-1位于分子标记dupssr34~bnlg2162之间,LOD值为6.78,表型贡献率为24.02%。该主效位点qTBN4-1目前已被克隆,G.S.Chuck等[16]研究发现unbranched3基因编码一个SBP-box转录因子从而影响玉米的雄穗分枝数与穗行数。
qPH3-1、qEH3-1、qTL3-1 都存在于第 3 染色体长臂且与不育基因所在位置相距较近,暗示着这3个QTL与不育基因存在连锁关系。同时这3个位点的加性效应均为正值,表明父本B73携带的相应等位基因起到增加株高、穗位高和雄穗长度的作用,母本不育株携带的相应等位基因起到降低株高、穗位高和雄穗长度的作用。
3 讨论与结论
3.1 在玉米核不育基因ms39定位区段附近检测到株高QTL位点
本研究通过对玉米太空诱变核不育株与B73组配的(ms39ms39×B73)F2群体进行株高 QTL扫描,在不育基因(ms39)定位区间附近检测到一个主效株高QTL,qph3-1,其表型贡献率高达26.96%。许多学者在不同环境下、利用不同的群体均在玉米第3染色体检测到控制株高的QTL。郑克志等[17]利用玉米自交系T319与9406为亲本,在玉米bin3.06位点定位到的株高QTL可解释12.99%的表型变异;李清超等[18]利用玉米骨干亲本黄早四与其他11个骨干自交系组配的11个RIL群体,在玉米bin3.05~3.06间扫描到8个株高、穗位高QTL;郑德波等[19]以K22×CI7 、K22×Dan340 的 F2群体,在 bin3.06定位到4个株高QTL,可解释表型变异率分别为6.40%、7.92%、8.26%、10.69%。在玉米第3染色体上控制株高的基因有d1、sdw2、yd2和na1,分别存在于bin3.02、bin3.05、bin3.06、bin3.07 位点[20]。这些结果一致表明玉米第3染色体bin3.05~3.06区间可能是株高QTL的富集区域,且玉米太空诱变核不育基因ms39也被定位于该区域附近。
在(ms39ms39×B73)F2群体中虽然不育株大多矮于可育株,但也存在“高秆不育株”与“矮秆可育株”,针对这种现象可从两个方面进行解释:一方面,“高秆不育株”与“矮秆可育株”的出现,暗示着不育基因与矮化基因可能是相互连锁的,通过杂交重组打破了基因间的连锁关系,所以在后代群体中出现了“高秆不育株”与“矮秆可育株”的现象;另一方面,由于株高是典型的数量性状,其他微效株高QTL也可能对不育株和可育株的株高产生影响,导致“高秆不育株”与“矮秆可育株”的形成。
3.2 矮败材料是植物基础研究和育种应用的重要资源
玉米雄性核不育突变体ms39伴随着植株高度的明显降低,这一矮败材料是从太空诱变后代中选育而来。目前关于雄性不育材料伴随株高降低的这一现象,在其他植物中也存在类似报道。例如棉花中的SDA基因能导致植株发生雄性不育且伴随着植株矮化现象,Wu C.等[21]研究发现SDA基因与脱落酸(ABA)的生物合成及信号传导途径有关;林冰等[22]对水稻OsOFP2与OsOFP1基因分别进行过量表达,发现转基因植株均表现出花药败育及矮化的现象,推测OsOFP2与OsOFP1表达量升高能抑制赤霉素的合成影响植株的生长发育。
雄花发育和植株生长是植物生长发育的两个重要方面,有研究表明一些转录因子会通过调节植株的生长发育来影响植株的育性及株高,例如MYB转录因子家族在植物的基础代谢及生长发育环节中扮演重要角色,Yang X.Y.等[23]发现AtMYB24基因属于拟南芥R2R3-MYB基因家族,该基因编码的转录因子与花药发育和植株的生长有着密切关系;陈利维等[24]在水稻中分离获得了一个新的OsMYB106基因,通过RNA干涉试验发现植株表现出花粉败育及矮化现象;张娟等[25]发现WRKY转录因子家族的WRKY51在水稻中超表达后植株表现出超级矮化及败育等性状,推测该基因在水稻生长发育阶段起到重要调控作用。这些不育基因和转录因子大多与植物的生长发育调控网络有关,能同时影响植株的高度与育性。
雄性不育在植物杂种优势利用上具有重要的应用价值。将其他一些重要的育种目标性状聚合到不育材料中,将大大提高杂交育种的效率。Afsana Ansari等[26]通过对半矮化基因sd-1与绒毡层特异性基因RTS进行RNA干涉创制了一种人工矮败不育水稻;刘秉华等[27]则通过杂交聚合的方法创制出“矮败小麦”。由此可见,矮败材料在植物基础研究和育种应用中具有重要的应用价值。
本研究中的玉米太空诱变核不育突变体能够明显降低植株的株高,前期已将该不育基因定位于第3染色体长臂,本研究通过全基因组作图和QTL定位,在不育基因定位区间的附近检测到一个影响植株高度的主效QTL,推测该不育突变体的矮化可能是由于控制株高的QTL与不育基因的连锁所致。前人的研究也表明在玉米第3染色体的长臂上存在一个控制株高的QTL富集区,这些都为进一步认识该核不育突变材料矮化现象的遗传机理奠定了基础。
