NO对Cd2+胁迫下绿豆幼苗DNA及光合作用的影响
2018-09-07李惠民罗芬兰贺军民
李惠民 ,罗芬兰,贺军民
1. 陕西师范大学 生命科学学院,西安 710062
2. 商洛职业技术学院,商洛 726000
随着工业化进程的加速,重金属污染已成为当今世界关注的热点问题之一。Cd2+是比较常见的重金属污染物,因此关于Cd2+胁迫对植物生活的影响已受到广泛关注(林单等,2010)。DNA是遗传信息的载体,其含量和正常结构的维持是生物体生命活动的基础。一些研究显示,Cd2+胁迫不仅能影响DNA的合成和降解,导致DNA含量的降低(Tuteja et al,2001;郭燕梅等,2008;林单等,2010),而且能引起DNA链的断裂、链内和链间的交联、甲基化水平、构象和多态性等多方面的改变(陈霞等,2001;Atienzar et al,2002;刘宛等,2006;马引利和佘小平,2006;李慧等,2010;张芬琴等,2012)。光合作用是植物最基本的物质代谢和能量代谢,是唯一能把太阳能转化为稳定的化学能贮藏在有机物中的过程。大量研究表明,Cd2+胁迫能降低植物光合速率、气孔导度、光合色素含量、光系统的光化学效率、光合电子传递效率、光合磷酸化效率和光合碳同化过程中许多酶的活性,也能导致聚光色素复合体的解聚和叶绿体结构的破坏(Weigel,1985;Ghoshroy and Nadakavukaren,1990;Padmaja et al,1990;Sheoran et al,1990;Malik et al,1992;陈国祥等,1999)。尽管前人对Cd2+胁迫影响光合作用的机制进行了大量研究,但对Cd2+胁迫抑制光合作用过程中到底是气孔限制还是叶肉细胞光合活性的变化起了主要作用却并不清楚。同时,探寻安全而有效的防护措施来缓解Cd2+污染对植物的毒害作用,进而提高农作物的产量已显得尤为重要,但目前该方面的研究仍较薄弱。
一氧化氮(NO)是一种新型信号分子,在植物的生长发育、防御反应以及抗逆性等方面都发挥着重要的作用(Fancy et al,2017)。已有研究表明NO能缓解一些逆境对植物的毒害效应,如:外源 NO提高植物抗旱性(李蕾蕾,2016);增强农作物的抗寒性(马向丽等,2005;牟雪姣和张远兵,2015);减轻盐胁迫下植物叶片的膜脂过氧化(陈明等,2004);延缓植物在盐胁迫和高温胁迫下叶片叶绿素的降解,维持光系统Ⅱ的高活性(Akio et al,2002)等。然而,目前关于NO对重金属胁迫抑制植物生长发育的影响的研究工作较少,特别是外源NO对重金属Cd2+胁迫下农作物的影响的研究工作更少。
基于以上分析,本文研究了外源NO处理对Cd2+胁迫下绿豆幼苗DNA及光合作用的影响,旨在探讨NO是否能有效缓解重金属胁迫对植物的毒害效应及其作用机制,同时为有效防护重金属污染对农作物的影响提供理论基础。
1 材料与方法
1.1 材料培养及处理
绿豆(Phaseolus raditus L. cv. Qindou-20)种子购于陕西省西安市雁塔区种子公司。种子经0.1%HgCl2溶液消毒5 min后立即用流水冲洗干净,再用去离子水冲洗3次,然后于暗中、25℃温箱内预萌发60 h。选择萌发一致的种子培养于盛有去离子水的塑料管中,置于光照培养箱(昼/夜温度(25 ± 2)℃ /(20 ± 2)℃,相对湿度75%,每日光照14 h,光强为 300 — 350 μmol ∙ m−2∙ s−1)中培养。
培养33 h后,保持上述条件不变,进行以下四种处理:①对照组(CK):用1/2 Hoagland营养液培养;②NO供体硝普钠(SNP)处理组(SNP):用含 50 μmol ∙ L−1SNP 的 1/2 Hoagland营养液培养;③重金属镉胁迫组(Cd):先用1/2 Hoagland 营养液培养 24 h 后,改用含 5 μmol ∙ L−1CdCl2的1/2 Hoagland营养液一直培养;④ 镉胁迫和SNP复合处理组(Cd+SNP):先用含50 μmol ∙ L−1SNP 的 1/2 Hoagland 营养液培养 24 h后,改用含 50 μmol ∙ L−1SNP 和 5 μmol ∙ L−1CdCl2的1/2 Hoagland营养液一直培养。
每处理组30株幼苗,每天更换一次处理液,在处理后的第3天(3 d)和第8天(8 d)取幼苗的叶片和根进行相关指标测定。
1.2 DNA的提取
采用CTAB法提取绿豆幼苗叶片DNA和根DNA:分别称取处理3 d和8 d的叶片各0.8 g,处理3 d和8 d的根各1.0 g,加入4℃冷藏的DNA提取液 (2 g ∙ L−1CTAB,1.4 mol ∙ L−1NaCl,20 mmol ∙ L−1EDTA,100 mmol ∙ L−1Tris-HCl 和 2 mL ∙ L−1巯 基乙醇)1.5 mL充分研磨至匀浆,装入2 mL离心管内,60℃水浴中保温40 min,期间不时轻轻摇动。冷却后 12000 r ∙ min−1离心 20 min,取上清液加RNA酶10 μL,摇匀于37℃水浴中保温40 min,加等体积氯仿-异戊醇(氯仿和异戊醇按体积比24∶1 配 制 氯 仿 -异 戊 醇) 于 12000 r ∙ min−1离 心15 min,取上清液再加等体积氯仿-异戊醇(氯仿和异戊醇按体积比24∶1配制氯仿-异戊醇)再次抽提蛋白质(12000 r ∙ min−1,15 min)。异丙醇沉淀DNA,70%乙醇洗涤两次。将洗涤后的DNA沉淀于通风柜中风干,溶于80 mL TE缓冲液(10 mmol ∙ L−1Tris-HCl,1 mmol ∙ L−1EDTA,pH 8.0)中,−20℃保存备用。
1.3 DNA含量测定
分别取上述叶片和根系DNA提取液20 μL,用TE缓冲液稀释至3 mL,在TU-1800S型紫外 — 可见分光光度计上测定A260和A280,以A260值估算DNA得率,以A260/ A280比值判断DNA样品的纯度。DNA 含量以 μg ∙ g−1DW 表示。
1.4 DNA增色效应测定
分别取两份上述各处理叶片和根系DNA样品各 20 μL,溶于 3 mL 0.08 mol ∙ L−1NaCl溶液中,一份在70℃水浴中加热,另一份置于室温(25℃)下。30 min后分别在TU-1800S型紫外 — 可见分光光度计上测定 A260,以 [(A260,70℃− A260,25℃) /A260,25℃]×100%作为DNA增色效应指标。
1.5 光合指标的测定
净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)均用便携式CIRAS-2型光合测定仪(PP Systems公司制造)测定。每项光合指标的测定均选取绿豆幼苗第一对真叶。测定过程叶室温度 25℃,CO2浓度 390 µmol ∙ mol−1,光强1000 µmol ∙ m−2∙ s−1。测定时间为每日 13:30 — 16:00。试验重复3次以上。
气孔限制值(Ls)根据Farquhar and Sharkey(1982)的理论由Pn/ Ci和Pn/ Ca两条响应曲线计算得出。Ls= (Ao− Ai)/Ao×100%,式中 Ao为 Ci等于大气CO2浓度时幼苗叶片的Pn,Ai为大气CO2浓度下幼苗叶片的Pn。
2 试验结果
2.1 NO对Cd2+胁迫下绿豆幼苗DNA的影响
2.1.1 NO对Cd2+胁迫下绿豆幼苗DNA含量的影响图1和图2表明,NO供体SNP单独处理对绿豆幼苗叶片和根系的DNA含量基本没有影响;单独Cd2+胁迫3 d和8 d均极显著地降低了绿豆幼苗叶片和根系的DNA含量(p < 0.01);而在Cd2+胁迫下增加SNP复合处理时,Cd2+胁迫引起的幼苗叶片和根系的DNA含量降低均得到极显著的抑制(p < 0.01),但仍低于对照组幼苗叶片和根系的DNA含量。与Cd2+单独处理相比,Cd+SNP处理3 d使绿豆幼苗叶片和根系的DNA含量分别增加了51.48%和31.46%,处理8 d使绿豆幼苗叶片和根系DNA含量分别增加31.85%和44.62%,这表明NO处理显著减缓了Cd2+单独处理对绿豆幼苗叶片和根系DNA含量的影响。
2.1.2 NO对Cd2+胁迫下绿豆幼苗DNA链间交联的影响
由图3和图4可知,与对照相比,NO供体SNP单独处理对绿豆幼苗叶片和根系的DNA增色效应均无显著影响;单独Cd2+胁迫3 d和8 d时绿豆幼苗叶片和根系的DNA增色效应较对照相比均极显著降低(p < 0.01);SNP和Cd2+复合处理时极显著地缓解了Cd2+单独处理(3 d和8 d )造成的绿豆幼苗叶片和根系DNA增色效应的降低(p < 0.01)。与Cd2+单独处理相比,Cd+SNP处理3 d使绿豆幼苗叶片和根系DNA增色效应分别增加了52.37%和59.85%,处理8 d使绿豆幼苗叶片和根系DNA增色效应分别增加214.60%和77.24%。

图1 NO对Cd2+胁迫3 d绿豆幼苗叶片和根系DNA含量的影响Fig.1 Effects of NO on the contents of DNA in the leaves and roots of mung bean seedlings treated with Cd2+ for three days

图2 NO对Cd2+胁迫8 d绿豆幼苗叶片和根系DNA含量的影响Fig.2 Effects of NO on the contents of DNA in the leaves and roots of mung bean seedlings treated with Cd2+ for eight days
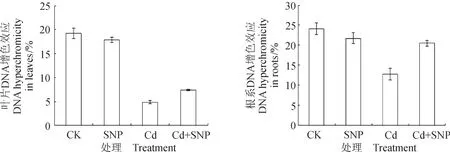
图3 NO对Cd2+胁迫3 d绿豆幼苗叶片和根系DNA增色效应的影响Fig.3 Effects of NO on DNA hyperchromicity in the leaves and roots of mung bean seedlings treated with Cd2+ for three days

图4 NO对Cd2+胁迫8 d绿豆幼苗叶片和根系DNA增色效应的影响Fig.4 Effects of NO on DNA hyperchromicity in the leaves and roots of mung bean seedlings treated with Cd2+ for eight days
DNA增色效应反映了DNA链间的交联程度。增色效应越低,说明DNA两条链间交联程度越大。由试验结果可知,Cd2+胁迫引起绿豆幼苗叶片和根系DNA链间交联程度增高;NO对正常生长条件下幼苗DNA链间交联程度无明显影响,但能显著抑制Cd2+胁迫造成的DNA链间交联。
2.2 NO对Cd2+胁迫下绿豆幼苗叶片光合作用的影响
2.2.1 NO对Cd2+胁迫下绿豆幼苗叶片Pn的影响
由图5可见,与对照相比, Cd2+胁迫3 d和8 d均极显著降低了绿豆幼苗叶片Pn(p < 0.01);NO供体SNP单独处理3 d对绿豆幼苗Pn无明显影响,但处理8 d时有一定的抑制;与Cd2+单独处理相比,SNP和Cd2+复合处理3 d和8 d时绿豆幼苗叶片Pn均极显著升高(p < 0.01),复合处理3 d和8 d时绿豆幼苗Pn分别升高了38.63%和63.03%。说明NO缓解了Cd2+胁迫对绿豆幼苗光合作用的抑制。
2.2.2 NO对Cd2+胁迫下绿豆幼苗Gs的影响
光合作用固定的CO2主要是通过气孔进入植物体内,因而气孔的开放和关闭必然影响植物的光合作用。图6表明,与对照相比,SNP单独处理、Cd2+胁迫单独处理、SNP和Cd2+复合处理3 d和8 d的绿豆幼苗Gs均极显著下降(p < 0.01),其中以Cd2+单独处理最为严重,而复合处理下的Gs明显高于Cd2+单独处理。可见,各处理下气孔导度的变化趋势与光合速率的变化趋势基本相同。
2.2.3 NO对Cd2+胁迫下绿豆幼苗叶片Ci和Ls的影响
虽然各处理下光合速率的变化和气孔导度的变化趋势基本相同(图5 、 图6),但这并不能说明导致光合速率变化主要是气孔因素。由图7和图8可知,单独Cd2+胁迫下,伴随着Pn和Gs显著低于对照(图5 、图6),Ci也明显低于对照,而Ls则显著高于对照,说明单独Cd2+胁迫造成光合速率下降主要是气孔因素。Cd+SNP复合处理下,虽然Pn和Gs均显著高于单独Cd2+胁迫处理,但Ci略低于单独Cd2+胁迫(图7),Ls明显低于Cd2+胁迫(图8),说明复合处理下幼苗Pn高于单独Cd2+胁迫主要是叶肉细胞光合活性的提高所导致。
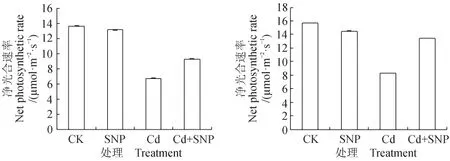
图5 NO对Cd2+胁迫3 d(左)和8 d(右)绿豆幼苗Pn的影响Fig.5 Effects of NO on Pn of mung bean leaves treated with Cd2+ for three days (left) and eight days (right)

图6 NO对Cd2+胁迫3 d(左)和8 d(右)绿豆幼苗Gs的影响Fig.6 Effects of NO on Gs of mung bean leaves treated with Cd2+ for three days (left) and eight

图7 NO对Cd2+胁迫3 d(左)和8 d(右)绿豆幼苗叶片Ci的影响Fig.7 Effects of NO on Ci of mung bean leaves treated with Cd2+ for three days (left) and eight days (right)

图8 NO对Cd2+胁迫3 d(左)和8 d(右)绿豆幼苗叶片Ls的影响Fig.8 Effects of NO on Ls of mung bean leaves treated with Cd2+ for three days (left) and eight days (right)
3 讨论及结论
3.1 NO对Cd2+胁迫下绿豆幼苗DNA含量和链间交联的影响
生物的生命活动与DNA表达密不可分,重金属胁迫常导致DNA结构和含量的变化而影响其正常表达,这不仅影响生物遗传的稳定性,而且影响其本身的正常生长发育(Tuteja et al,2001)。陈霞等(2001)以鲑鱼精子DNA为试验样品,通过紫外测量、圆二色谱及喇曼光谱测量,结果表明Cd2+可与DNA发生作用,并且使DNA构象发生变化。在植物中,前人研究也表明Cd2+不仅影响DNA的代谢,而且导致DNA链断裂、交联和碱基错误配对等结构的变化(刘宛等,2006;郭燕梅等,2008;李慧等,2010;林单等,2010;张芬琴等,2012)。Koch and Giandomenico(1994)指出,DNA增色效应可反映DNA的解链程度,而DNA解链程度与其链长及链间交联程度有关,DNA断裂会使链长变短因而增色效应提高,DNA链间交联则使增色效应下降,因此前人常用DNA增色效应的结果判断DNA是否断裂以及是否发生了链间交联等损伤效应(马引利和佘小平,2006;李慧等,2010)。与前人研究结果相一致,本文试验结果表明,Cd2+胁迫3 d和8 d导致绿豆幼苗叶片和根系DNA含量和DNA增色效应均极显著降低(p < 0.01)(图1 — 4),说明Cd2+导致绿豆幼苗叶片和根系DNA代谢受到抑制,DNA链间交联程度加剧。DNA链间交联抑制转录过程,DNA含量的大幅度降低也影响功能mRNA的形成,因而不管是DNA交联还是DNA含量降低均对植物的正常生长发育是有害的,它们势必导致植物的生理伤害和生长受阻,这与Cd2+胁迫抑制绿豆幼苗生长的研究结果是一致的(李艳艳等,2012)。
陈明等(2004)发现NO供体SNP能明显减轻NaCl胁迫对小麦幼苗根生长的抑制效应,这与其阻断盐胁迫诱导的根尖细胞DNA的片段化有关。李艳艳等(2012)的研究发现外源NO处理能明显缓解Cd2+胁迫对绿豆幼苗生长的抑制效应,但该缓解效应是否与外源NO处理抑制了Cd2+胁迫下绿豆幼苗DNA含量降低和DNA链间交联的发生有关却并不清楚。本文试验结果显示,NO供体SNP和重金属Cd2+复合处理显著提高了Cd2+胁迫3 d和8 d的绿豆幼苗叶片和根系的DNA含量(图1 、图2)和DNA增色效应(图3 、 图4)(p < 0.05),说明NO能缓解重金属Cd2+胁迫对绿豆幼苗DNA结构及其代谢的影响,这可能是NO缓解Cd2+胁迫对植物生长抑制效应的原因之一。
3.2 NO对Cd2+胁迫下绿豆幼苗光合作用的影响
目前,普遍认为Cd2+胁迫对植物光合作用的毒性主要与其干扰光合链的电子传递和导致光合酶失活等有关(郭燕梅等,2008;李慧等,2010),如:研究显示植物受Cd2+胁迫时,光合作用暗反应过程中许多酶的活性降低(Sheoran et al,1990;Malik et al,1992);Cd2+影响光合膜和光系统Ⅱ的结构等(Weigel,1985;Ghoshroy and Nadakavukaren,1990;Padmaja et al,1990;陈国祥等,1999);光合作用的顺利进行与光合底物CO2的供应密切相关,而目前关于Cd2+胁迫抑制光合作用是否也与其影响光合底物CO2的供应有关却并不清楚。Farquhar and Sharkey(1982)将限制光合作用的因素归纳为两大类:一是与CO2供应有关的因素,主要包括界面层及气孔对CO2的扩散阻力,其中以气孔阻力影响最大,可简称为气孔因素;二是与光能转化和碳同化有关的叶肉因素,统称为非气孔因素。根据Farquhar and Sharkey(1982)的理论,Gs和Ci降低而Ls增加时,Pn降低的主要原因为气孔因素,而Pn降低伴随着Ci升高时,Pn降低的主要原因一定是非气孔因素(许大全,1997)。本文结果显示,与对照相比,Cd2+胁迫3 d和8 d时绿豆幼苗的Pn、Gs和Ci均显著降低,而Ls却显著升高(p < 0.01)(图5 — 8),说明Cd2+胁迫3 d和8 d时导致绿豆幼苗Pn降低的主要原因是气孔因素,而不是非气孔因素。本文试验中Cd2+胁迫处理时间较短,结合前人较长时间的Cd2+胁迫处理或高强度的Cd2+胁迫处理对植物叶肉因素影响的测定结果(Ghoshroy and Nadakavukaren,1990;Padmaja et al,1990;Sheoran et al,1990;Malik et al,1992;陈国祥等,1999),本文认为Cd2+胁迫前期限制植物光合作用的主要原因是气孔因素,而胁迫后期限制植物光合作用的主要原因是非气孔因素。
李蕾蕾(2016)发现,外源NO处理能够增加干旱胁迫下玉米幼苗叶绿体结构稳定性,减轻PSⅡ反应中心的受损程度,提高光合碳同化过程相关基因的表达及酶活性,进而缓解了干旱对玉米幼苗光合作用的抑制;王松等(2016)研究表明,外源NO通过诱导上调NaCl胁迫下番茄幼苗光合色素含量、PSⅡ的光化学反应活性以及降低光抑制,从而缓解了NaCl胁迫对番茄幼苗生长的抑制;孙德智等(2014)也表明外施SNP能有效抑制NaCl胁迫下番茄幼苗叶片光合色素含量、Pn和Gs的下降以及Ci的升高。外源NO对干旱和盐等逆境条件下植物光合作用的影响已有较多研究,但关于外源NO对重金属Cd2+胁迫下植物光合作用影响的研究却较少。本文结果显示,外源NO供体SNP使Cd2+胁迫3 d和8 d时绿豆幼苗的Pn和Gs均显著升高(图5 、 图6),Ls显著降低(图8),但使Ci有一定程度的下降(图7),说明外源NO缓解Cd2+胁迫抑制绿豆幼苗光合作用主要是由非气孔因素导致,这与前人表明的NO缓解干旱和盐胁迫等逆境抑制植物光合作用的机制是一致的(孙德智等,2014;李蕾蕾,2016;王松等,2016)。
综上所述,短时间的Cd2+胁迫处理导致了绿豆幼苗DNA代谢及其结构的损伤,并主要通过气孔限制抑制了绿豆幼苗叶片的光合作用。而外源NO处理能明显缓解Cd2+胁迫对绿豆幼苗DNA代谢及其结构的损伤,并通过提高幼苗叶肉细胞的光合活性,缓解了Cd2+胁迫对幼苗光合作用的抑制,进而增强了植物对重金属Cd2+胁迫的抵抗力。
