采用双水相萃取技术提取ε-聚赖氨酸
2018-09-06马玉张龙陈旭升毛忠贵
马玉,张龙,陈旭升,毛忠贵
(江南大学 生物工程学院,江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由放线菌生产的氨基酸同型聚合物,由25~35个L-赖氨酸残基通过α-羧基与ε-氨基形成的ε-酰胺键连接而成[1]。ε-聚赖氨酸的水溶性好、热稳定性高,在中性和偏酸性条件下对革兰氏阳性菌和革兰氏阴性菌、酵母及其他真菌、病毒都有抑制作用,抗菌谱广,为绿色生物防腐剂[2]。ε-聚赖氨酸由白色链霉菌(Streptomycesalbulus)发酵生产。关于ε-PL的提取,目前主要是采用离子交换技术和膜技术进行分离,之前所有提取工艺的核心步骤均是离子交换树脂,膜技术只是在固液分离方面有所应用。最具借鉴意义的是2003年美国FDA公布的ε-PL提取工艺[3]。采用0.10 μm的微滤膜过滤作为固液分离方式,收集透过液经过一道色谱层析(文件中未提及该色谱类型),随后使用三道离子交换柱进行分离和精制,三道离子交换的顺序依次为弱酸树脂、强碱树脂和强酸树脂,将经过三道离子交换的料液进行活性炭除杂,最后经过浓缩干燥得到ε-PL样品。该工艺采用微滤膜进行过滤,降低了离子交换树脂污染的风险,最终可获得高纯度样品,但该提取工艺关键的色谱、树脂类型及使用条件没有详细的阐明,而且ε-PL的发酵液黏度大,几乎不可能采用微滤膜直接过滤,推测该固液分离方式可能是针对固定化发酵模式,同时整个工艺操作程序繁琐,收率不高。
国内最近的关于ε-PL提取工艺是2015年甄斌提出的ε-PL絮凝剂提取工艺[4]。调节发酵液pH至1.5后加入絮凝剂,充分絮凝后使用板框过滤,收集过滤液依次进行微滤和超滤,收集透过液,调节pH至8.5后使用弱酸阳离子树脂吸附和洗脱,洗脱液调节pH至7.0进行大孔树脂SX-8脱色,脱色液使用1 kDa超滤脱盐并收集截留液,最后使用冷冻干燥获得样品。过滤依次采用板框过滤、微滤和超滤,最终获得十分澄清的料液,消除了树脂污染的风险,采用大孔树脂脱色大幅度降低了该步骤的ε-PL损失率,但最终获得产品纯度不高,并且同样出现操作程序繁琐的问题。考虑到ε-聚赖氨酸提取投资大、成本高、价格昂贵,限制了ε-PL的广泛应用。因此,对ε-PL分离提取方法进一步的探索研究是有重要意义的。
查阅相关资料,目前还没有关于利用双水相技术来初步萃取ε-PL的详细研究。双水相萃取技术是指一种或几种物质以适当的质量分数溶解在水中,在一定的条件下形成互不相溶的水溶液体系,如聚合物/聚合物/水、聚合物/无机盐/水、聚合物/有机盐/水、表面活性剂/表面活性剂/水、小分子有机溶剂/无机盐/水等体系[5]。双水相萃取技术具有萃取条件温和、处理量大、萃取率高、两相分离快、能耗低、设备投资少等优点,有望在生物化工、细胞生物学和生物化学等领域得到应用[6]。本文深入研究了乙醇/硫酸铵双水相体系对提取ε-PL的影响,杂质的去除情况,并探究了多次萃取效果,尝试研究出一条简便高效的ε-PL提取工艺路径。
1 材料与方法
1.1 材料、试剂与仪器
发酵液由本实验室自己提供,制备方法见文献[7];聚赖氨酸标准品,郑州拜纳佛生物工程有限公司;无水乙醇,分析纯级,甲基橙,考马斯亮蓝G250以及其他一些药品皆为分析纯级别。
紫外可见分光光度计,尤尼柯仪器有限公司;高效液相色谱仪,美国Agilent公司;高速冷冻离心机,上海卢湘仪离心机仪器有限公司;切向超滤系统,美国Millipore公司;AR224CN分析天平,奥豪斯仪器有限公司;FE20 pH计,瑞士 Mettler Toledo公司。
1.2 方法
1.2.1 ε-PL在双水相体系中的分配系数筛选
发酵液先经过14 000×g离心,除去菌体,保留上清液在4 ℃保存备用。取6 g无机盐,18 g离心清液体和6 g有机溶剂,漩涡振荡5 min混匀,室温静置2 h。使用该方法比较不同双水相体系对ε-PL的分离效果。其中ε-PL在上相浓度Ct和下相浓度Cb之比为ε-PL的分配系数(K)。
1.2.2 乙醇/硫酸铵双水相相图
采用浊度滴定法来获得乙醇/硫酸铵双水相相图。将小三角瓶置于分析天平上,调零;加入一定量的50%浓度的硫酸铵溶液,记录重量后调零;接着加入一定量的无水乙醇,边振荡边滴加,直到混合物出现浑浊状态,显示溶液中已经形成不相容的两相,记录重量后调零;接着向混合物中加入去离子水直到溶液变澄清,表明水溶液已经变成单相,记录水重量后调零;接着再一次滴加无水乙醇,重复上述步骤。累计到一定数目的点后,分别以硫酸铵质量分数和无水乙醇质量分数为横坐标和纵坐标,得到乙醇/硫酸铵双水相相图[8]。
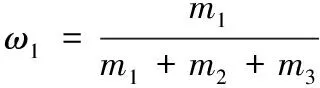
(1)

(2)
式中:ω1和ω2分别表示无水乙醇质量分数和硫酸铵质量分数;m1、m2和m3分别表示无水乙醇、硫酸铵和水的质量。
考虑到ε-PL对相分离的影响作用,硫酸铵直接加入到ε-PL标准品溶液中,按照上面提到的浊度滴定法获得相图。
1.2.3 乙醇和硫酸铵浓度对ε-PL分配系数的影响
取硫酸铵6 g加入到经过离心后的发酵液中(pH 9.50),硫酸铵最终质量分数为20%。接着,加入无水乙醇构建双水相萃取ε-PL,乙醇质量分数范围20%~26.7%(该范围外的浓度无法形成双水相体系),使用该方法来考察不同的乙醇浓度对ε-PL分配系数的影响。同样的,在体系中维持20%的乙醇质量分数,向体系中加入不同量的硫酸铵,使硫酸铵最终质量分数在20%~26.7%(该范围外的浓度无法形成双水相体系),考察不同硫酸铵浓度对分配系数的影响。
计算色素的去除率和蛋白质的去除率,发酵液中原来总的色素量减去上相中的色素含量除以总的色素量为色素去除率,蛋白质去除率的定义与之相同[9]。
1.2.4 乙醇和硫酸铵浓度的测定
硫酸铵浓度的测定依据文献[10]的方法进行测定。乙醇浓度依据文献[12]的方法进行测定。
1.2.5 pH对ε-PL的分配系数的影响
以20%的硫酸铵和20%的无水乙醇构建双水相体系,考虑到调节pH时,无水乙醇会产生一定干扰[12],所以硫酸铵溶于发酵液清液后,即用NaOH溶液调节该溶液pH值,溶液pH值依次为5.0、6.0、7.0、8.0、8.5、9.0、9.5、10.0。考察不同的pH对ε-PL在双水相体系中分配系数的影响。同时计算色素和蛋白质去除率,以及ε-PL的回收率。
1.2.6 多次萃取的比较
在最佳的萃取条件下(硫酸铵和乙醇质量分数分别为20%和20%,pH 9.5,25 ℃),进行第1次萃取。之后,向第1次萃取的上相加入相同体积并且组成成分相同的新鲜下相进行第2次萃取,混合物振荡5 min,静置2 h待两相分离。下面几次萃取按照相同的方法进行[13]。
1.2.7 分析方法
ε-PL浓度测定参照文献[14]方法。HPLC检测纯度采用文献[14]的方法,TSK gel ODS-120T 色谱柱(φ 6 mm×25 cm),紫外检测器,检测波长215 nm,柱温40 ℃,流动相为K2HPO41.7 g和Na2SO41.42 g溶于800 mL水中,用磷酸调节pH值至3.4后,用水定容至1 000 mL,取920 mL加入80 mL乙腈,进样量为20 μL。蛋白质浓度测定采用考马斯亮蓝法[16],色素测定参照文献方法[17]。分配系数(K),ε-PL收率(Y),Vr体积比按公式(3)、(4)和(5)计算:

乙醇/硫酸铵(质量分数20%/20%)萃取ε-PL形成的双水相图1 ε-PL在乙醇/硫酸铵双水相体系中的分配()Fig.1 Partitioning of ε-PL in aqueous two-phase system

(3)
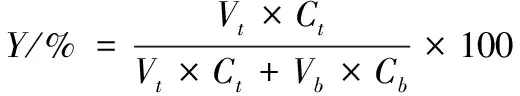
(4)

(5)
式中:Ct和Cb分别代表的是上、下相中ε-PL的浓度;Vt和Vb分别代表上、下相的体积。
2 结果与分析
2.1 ε-PL在双水相体系中的分配情况
表1表示的是ε-PL在双水相体系有机相/无机盐中的分配系数。
由表1可以知道,在乙醇/硫酸铵双水相体系中ε-PL的分配系数要高于其他双水相体系,达到18.27,收率为97.89。大部分的双水相体系中,ε-PL的分配系数值的范围为0.40~1.60之间。结果表明,相比较其他双水相体系,在乙醇/硫酸铵双水相体系中,ε-PL主要分配于上相,更容易回收。

表1 ε-PL在不同的双水相体系中的分配系数(25℃,有机溶剂/无机盐质量分数20%/20%)Table 1 Partitions coefficients of ε-PL in different organic solvent/salt system
注:“-”表示体系不形成双水相。
目前,相关资料文献报道,对于有机溶剂/无机盐双水相体系形成主要影响因素为有机溶剂和无机盐性质,其次体系的温度、pH值等外界因素也有一定的影响[18]。初步判断,在溶液中,无机盐会和有机溶剂竞争水分子[18]。因此,水化能力较强的无机盐更易争夺水分,形成较强的相分离能力,即形成双水相体系。在ε-PL的萃取实验中,可以基本得出双水相形成能力的大小依次为:(NH4)2SO4、NaH2PO4、KCl、NaCl、Na3PO4,这与文献中得到的结果相一致[19]。而相同的,极性较强的有机溶剂会竞争性聚集更多的水分子。这也就能理解为什么乙醇/无机盐双水相体系更易形成双水相的状态。而对于甲醇和其他一些无机盐形成双水相一般是比较困难的,这主要是因为甲醇和水分子之间有很强的亲和力,互溶能力强,不能形成双水相。这也是其他有机溶剂/无机盐无法形成双水相体系的原因,当然,无机盐的离子形式也有一定的影响。目的物ε-PL是一种亲水性的聚合物,乙醇/无机盐形成的双水相中,乙醇相比较与其他有机溶剂有着更强的竞争水分子的能力,所以该类体系中上相的水分子更多,所以ε-PL更易分配于上相,从表1数据结果也可以看到,乙醇/硫酸铵,乙醇/磷酸二氢钠形成的双水相体系,ε-PL的分配系数和收率都比其他形成的双水相体系结果要高,尤其是乙醇/硫酸铵双水相体系的萃取能力与效果更强。
考虑到硫酸铵价格便宜,而乙醇的安全性能相对高等综合因素,因而选择乙醇/硫酸铵双水相体系作为下一步实验的萃取ε-PL体系研究对象。
2.2 乙醇/硫酸铵双水相相图
为了研究合适的相组成比例,分别以ε-PL溶液和去离子水作为溶剂得出了乙醇/硫酸铵双水相相图。如图2所示,在ε-PL溶液中得到的双水相相图,在相同的硫酸铵浓度条件下,乙醇浓度要比在去离子水中得到的双水相相图略微低一些,主要因为ε-PL的存在加强了两相的形成。双水相的形成不仅与成相有机溶剂和无机盐性质有关,还与体系的pH值、温度等外界条件有关。目前对于这一体系的相分离解释主要是无机盐,有机溶剂与水分子缔合竞争的结果[18],在这里ε-PL的存在可能加强了这种缔合竞争的作用。由于相分离影响因素很多,所以这类体系的具体形成机理还有待进一步探索。

图2 乙醇/硫酸铵双水相相图Fig.2 Effect of ε-PL on phase diagram of ethanol/ammonium sulfate
图3表示的是在乙醇/硫酸铵双水相体系中成相位置,M为成相点,乙醇/硫酸铵质量分数为20%/20%,pH9.5。静置分层形成两相后,两相中的乙醇和硫酸铵含量出现较大的变化。T代表上相中的乙醇和硫酸铵质量组成,B代表下相中乙醇和硫酸铵的质量组成情况,上相中乙醇和硫酸铵的含量分别为38.78%和8.12%。而下相中乙醇和硫酸铵含量分别为8.82%和27.31%。此时,ε-PL主要分配在上相。这可能主要是因为下相中由于无机盐浓度较高,产生盐析作用使ε-PL溶解度降低,所以不易分配于下相。其次ε-PL等电点为9.0[14],在pH9.5时,ε-PL大都以电中性和少量负电状态存在,而体系中由于电离作用,无机盐产生的阴、阳离子在两相中进行分配最终达到平衡时,会在上下相之间产生电位差,会驱使ε-PL分配于上相。点M为整个系统的组成,当M点向下移动时,系线长度TB缩短,两相差别减小,当系线为零时,两相差别消失而成为一相,即不分相。对于双水相体系的形成,根本原因可能是因为两相极性大小产生差异,所以体系发生分离产生两相,没有互溶。介电常数通常用来预测溶液的极性性质[20],在实验中上相主要为38.87%的乙醇,其介电常数大约为60 F/m,而对于下相主要为27.31%的无机盐溶液,其介电常数大约为78 F/m。可以看出上下相之间极性出现差异,产生两相。对于双水相的成相原因还有其他文献给出一些解释[7]。同时,根据“相似相溶”的原理,目的物极性大小可能更接近于上相,所以更易分配于上相。

M-成相点;T-上相组成;B-下相组成图3 乙醇/硫酸铵双水相相图和成相点Fig.3 The phase diagram and phase point of the aqueous phase carbonate ATPS
2.3 乙醇和硫酸铵浓度对ε-PL分配系数的影响
在固定乙醇质量分数20%的条件下,探究硫酸铵浓度对ε-PL分配系数和收率的影响。如图4所示,随着硫酸铵浓度的增加,ε-PL的分配系数(K)先减小后增大。这主要是因为随着体系硫酸铵浓度的增加,硫酸铵和乙醇竞争水分子,上相中水的含量递减,下相中水的含量增加,而ε-PL是亲水性的物质,更易趋向于水含量较大的相,因此分配系数K出现降低趋势。但随着硫酸铵浓度继续增加,由于盐析作用影响越来越大,所以分配系数K会出现回升的现象。

图4 硫酸铵对ε-PL分配系数和收率的影响Fig.4 Effect of ammonium sulfate on partition coefficients and recovery of ε-PL
同时,检测了在不同硫酸铵浓度条件下,蛋白和色素的去除情况。如图5所示,随着硫酸铵浓度的增加,蛋白和色素的去除率在增加,但硫酸铵浓度的变化对它们的影响不明显。在ε-PL的生产提取中,色素主要来源于两个方面,一是有机氮源、灭菌过程中的美拉德反应产物,另外就是产生菌自身分泌的色素物质[21],发酵液中的色素可能多以水溶性带负电荷的非极性大分子色素为主,与ε-PL结合较为紧密[22]。推测随着硫酸铵浓度增加导致下相竞争的水分子含量增加,而色素和蛋白质都具有一定的亲水性,所以二者易趋向于下相,去除率有所提升。ε-PL的回收率(Y)先减小后增大与分配系数K呈现相同变化趋势,这主要是因为在整个实验过程中,双水相两相的相体积比变化很小。
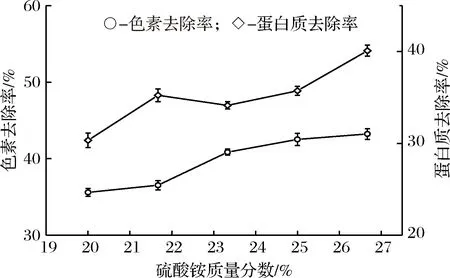
图5 硫酸铵对色素和蛋白质去除的影响Fig.5 Effect of ammonium sulfate on the removal rate of protein and pigment
同理,在硫酸铵质量分数为20%条件下,探究乙醇浓度对ε-PL分配系数和收率的影响。如图6所示,随着乙醇浓度的增加,ε-PL的分配系数和收率均呈现减少的趋势。这主要是因为,随着乙醇含量的增加,上相的乙醇含量占的比重增加,相对应的在上相中的水分子含量在减少,这就会导致亲水性的ε-PL在上相中的含量减少,所以出现分配系数减少的情况。又由于,整个实验过程中,两相体积的相体积比率变化很小,所以ε-PL收率基本是随着ε-PL分配系数的变化而变化。同时,可以看出随着乙醇浓度的增加,蛋白质和色素的去除率变化呈现相反的趋势,如图7所示,随着乙醇浓度的增加,蛋白的去除率在减少,而色素的去除率略微增大。当然,二者的去除率大约都在35%~40%之间,变化不大。

图6 乙醇对ε-PL分配系数和收率的影响Fig.6 Effect of ethanol on partition coefficients and recoveries of ε-PL
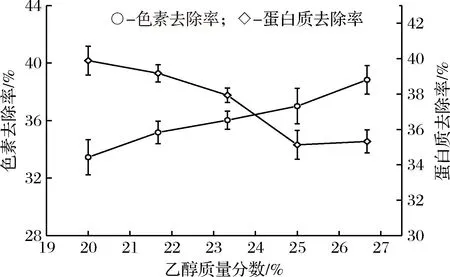
图7 乙醇对色素和蛋白质去除的影响Fig.7 Effect of ethanol on the removal rate of protein and ε-PL
综上所述,可以得出在乙醇/硫酸铵双水相体系质量分数浓度为20%/20%条件下,可以获得最大的ε-PL分配系数和收率,而对于继续降低乙醇/硫酸铵体系浓度无法形成双水相。因此,选择乙醇/硫酸铵体系质量分数为20%/20%进行接下来的实验。
2.4 pH值对ε-PL分配系数的影响

图8-b表示的是不同pH条件下,蛋白和色素去除率的变化情况。可以看到pH的变化对色素的去除率影响不大,而对蛋白的去除作用影响较大。前文中已提到,发酵液中的色素可能多以水溶性带负电荷的非极性大分子色素为主,与ε-PL结合较为紧密[22]。ε-PL的等电点为9.0左右[14],随着pH的增加,ε-PL的带电状态也在变化,但整体而言还是多以电中性居多,少量带有负电荷,所以色素和ε-PL的结合量仍然较多,所以pH的变化对色素的去除影响不大。对于发酵液中的杂蛋白,推测多为碱性蛋白质,分子质量分布在6.64万以下,1.43万以下分子质量约占1/4,最后基本通过后续的膜技术去除掉[22]。所以蛋白质去除率在增加,这应该是由于pH的逐步增加,改变了许多碱性蛋白质的带电状态,使得蛋白质分布发生变化,最终导致了蛋白质去除率的改变。
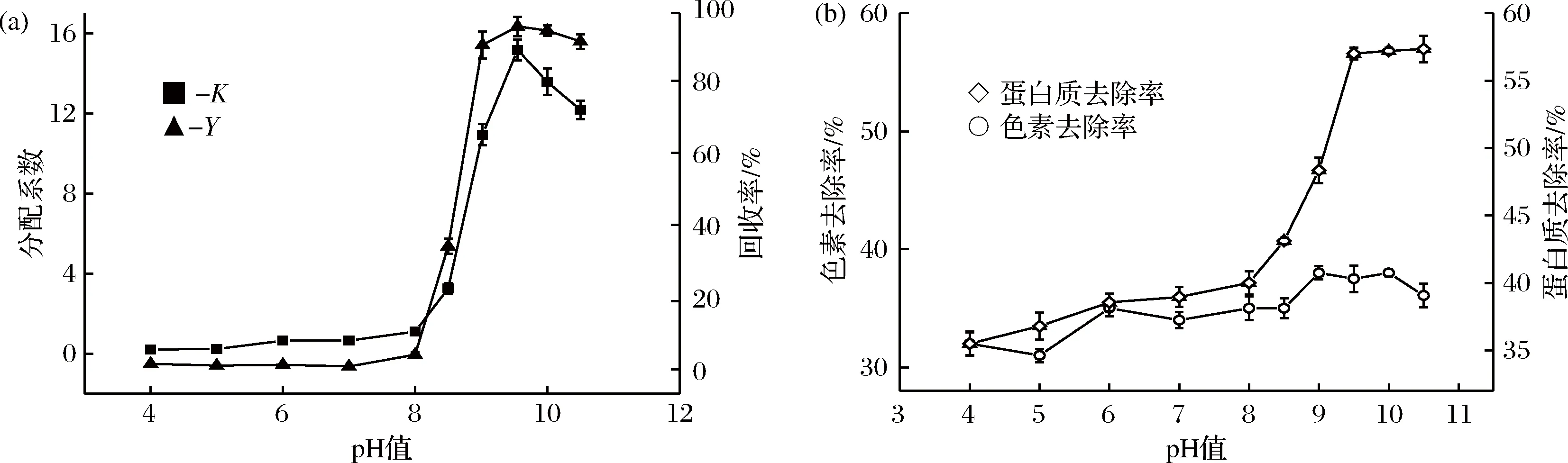
图8 不同pH条件下ε-PL分配系数和收率的变化情况Fig.8 (a) Effect of pH on partition coefficients and recovery of ε-PL and on the removal rate of protein and pigment
综上可得,最佳的ε-PL双水相萃取条件,乙醇/硫酸铵体系,质量分数浓度分别为20%/20%,在pH为9.5条件下进行实验操作。
2.5 多级萃取
为了考察对蛋白和色素等杂质的进一步去除效果,在前面实验优化出来的最佳条件下进行了多级萃取,乙醇质量分数为20%,硫酸铵质量分数为20%,pH 9.5条件下,进行萃取。已知经过一步萃取,蛋白去除率达到57.23%,色素去除率37.68%。分离出经过第1次萃取的上相,在保持萃取的最优双水相体系乙醇/硫酸铵(质量分数20%/20%)条件下,加入新的构成相同的下相,进行第2次萃取。收集第2次萃取的上相,加入新鲜构成相同的下相,进行第3次萃取,同样的,依次进行下面的萃取。
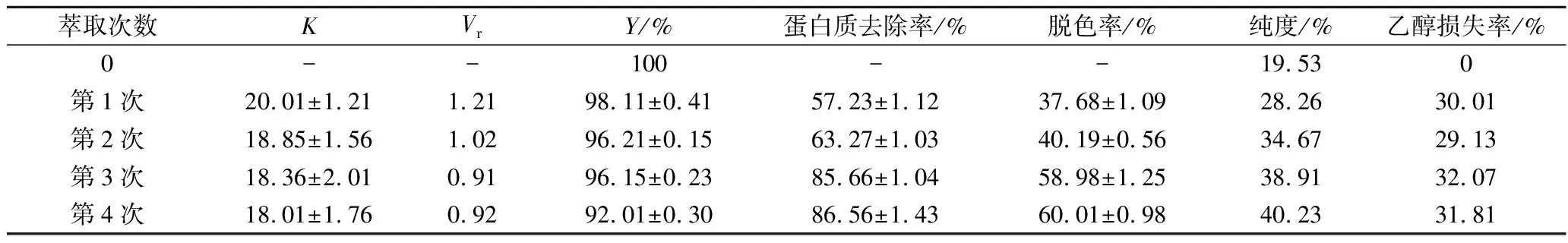
表2 利用双水相对ε-PL多级萃取结果(25 ℃)Table 2 Multi-stage extraction of sodium carbonate/ethanol ATPS(25 ℃)
注:表中萃取0次,即起始的发酵液上清。
由表2可知,随着萃取次数的增加,ε-PL的分配系数在减小,另外由于两相体积比也在略微减少,可以看出ε-PL的收率也在减小,当进行第4次萃取时,收率减少到92.01%。可以看出,当进行完第4次萃取时,损失率明显加大,然而蛋白和色素去除率并没有明显的增加。发酵液中杂蛋白多以碱性蛋白为主[22],经过3次最优条件下萃取,可以说基本被去除掉,所以进行第4次萃取时蛋白的去除率变化很小了。而对于其中的色素,前文也已提到,色素多以水溶性带负电荷的非极性大分子色素为主,一般与目的物ε-PL结合的较为紧密,所以可以看出,在每一次的萃取过程中色素的去除率都不高[22]。但是,每一次构建新的双水相体系时,都会引入新鲜的去离子水,而色素又具有一定的亲水性,所以随着萃取次数增加,色素也得到一定的去除,在进行3次萃取后,与ε-PL结合不是很紧密的色素基本得到了去除,当再进行第4次萃取时,与ε-PL结合很紧密的色素去除基本很少了。因此,鉴于以上原因,采用该双水相体系萃取ε-PL的最佳次数为3次。而对于每次萃取乙醇的损失率大约在31%,损失较大,后期可以通过蒸馏等方法进行回收。
2.6 HPLC分析
通过液相分析可以得知,经过3次萃取可以去除大部分杂质。图9-c表示的是起始发酵液液相图,通过对比可以得出,杂质主要分配于下相被去除(图9-a所示),最后ε-PL主要被分配在上相,占主要成分被收集(图9-b所示),杂质的含量在逐渐减少。通过液相图9-a可以看出,在第3次萃取时,ε-PL在下相中的含量要明显高于第1次和第2次萃取的下相,说明ε-PL的损失率在持续增加,根据表2中实验结果数据也可以得到证明,最后在进行第4次萃取时的ε-PL损失接近9%,损失率进一步增大。因此,进行3次萃取是获得ε-PL的较好方案。

a-每次萃取下相的液相图(215 nm);b-每次萃取上相的液相图(215 nm);c-发酵液的液相图(215 nm)虚线表示ε-PL的出峰时间点图9 3次萃取Fig.9 HPLC graphs of ε-PL from ATPE
收集经过3次萃取之后的上相,利用前期工作筛选出的超滤膜进一步脱盐除杂,获得超滤液可以进行活性炭脱色并真空干燥最后获得产品,如图10-a所示。最后,ε-PL的收率和纯度分别可以达到68.28%和92.39%。纯度92.39%距国家标准95%还有一点差距,主要杂质是色素和杂蛋白,可以再通过去除色素和去蛋白的工作纯化,需后续继续研究。

a-本实验最后提取的干燥成品;b-符合国家标准的ε-PL合格样品图10 最后干燥成品Fig.10 The dry sample of the extracted ε-PL
3 总结
利用双水相萃取技术可以很好的从发酵液中萃取回收ε-PL,本文中探究了多个有机溶剂/无机盐的双水相萃取体系,经过实验得到乙醇/硫酸铵双水相体系要优于其他双水相体系,并优化了萃取条件,在pH 9.5,乙醇/硫酸铵质量浓度分别为20%/20%条件下,1次萃取收率可以达到98%左右,分配系数达到18.33左右。在此基础上探究了多次萃取的效果,并最终确定进行3次萃取作为最佳方案,发酵液经过3次萃取后,杂质被大量的去除,ε-PL被浓缩收集,收率达到96%左右,纯度由最初的19.53%提升到40%左右。为了进一步除杂脱盐,收集3次萃取后的上相成分,利用超滤膜进行脱盐处理,最后的收率和纯度分别达到68.28%和92.39%,蛋白质和色素的去除率分别可以达到86.56%和60.01%。可见,双水相萃取技术对于ε-PL的分离提取是个有价值的思路。
