苹果果胶-多酚复合膜液制备、流变特性及抗氧化性研究
2018-09-06梁迪杨曦侯燕杰郭玉蓉
梁迪,杨曦,侯燕杰,郭玉蓉
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)
果胶属于天然高分子多糖,广泛存在于天然植物中,是植物细胞壁的主要组成成分之一。果胶分子主链是指由若干个半乳糖醛酸单元以α-1,4-糖苷键连接而形成的线性长链[1]。除主链外,果胶分子还含有多个侧链,这些侧链随机分布在主链上,称之为“毛发区”。这些侧链主要由中性糖组成,包括D-半乳糖、L-鼠李糖和L-阿拉伯糖[2]。果胶无毒无害且具有显著的保健作用,因此不仅在食品工业应用广泛,而且在化妆品工业及生物医药领域也逐渐受到青睐。有研究表明,长期摄入果胶可减少人体肠道结肠癌的发病率,并降低糖尿病、高血压、高血脂症的患病风险[2-4]。
近年来,为满足人们日益增长的消费需求,大量果蔬不断在市场上流通。然而,在运输过程中,相当一部分果蔬因不耐贮藏而腐败变质,造成了大量浪费。化学保鲜剂虽然对果蔬具有一定的保鲜效果,然而存在着化学物质残留等安全性问题。为解决这一问题,孙立军等[5]将壳聚糖和苹果幼果多酚混合制备出一种可食薄膜,该膜具有一定的机械强度和抗氧化性。进一步研究表明[6],该膜对草鱼等水产品具有良好的保鲜效果。国外方面,对可食膜的研究较多。例如,JOSLIN等[7]以海藻酸钠和果胶为原料,通过添加少量CaCl2制备出一种复合膜液,并对人心果进行涂膜处理,结果表明,在该膜液中浸泡2 min,能有效保持人心果的感官性状。MAYRA等[8]分别以果胶和壳聚糖作为原料,通过添加少量苯甲酸钠和山梨酸钾制备出液体涂膜,并对草莓进行涂膜处理,研究发现,该可食膜可有效延缓草莓果实软化及褐变,能将草莓货架期从6 d延长至15 d。此外,FILHO等[9]用果胶溶液对南瓜片进行涂膜处理,研究发现,与新鲜南瓜片相比,果胶涂膜对南瓜片具有明显的保水作用。此外,为改善可食薄膜的感官性状,TANZEELA等[10]以柑橘皮果胶和丁香油为原料,混合制备出一种外观色泽近乎半透明的可食薄膜。这些研究表明,涂膜处理在果蔬保鲜方面具有一定应用前景。因此,本文在前人研究的基础上,以市售苹果果胶及苹果多酚为原料,制备出不同多酚质量浓度的果胶复合膜液,并研究了不同膜液的流变学特性和抗氧化性,以期为果胶-多酚复合膜液在果蔬保鲜方面的应用提供理论依据和参考。
1 材料和方法
1.1 试验原料与试剂
苹果果胶购自安得利苹果果胶公司,酯化度为65%,平均分子质量为(100±2.5) kDa, 半乳糖醛酸含量为70%;苹果多酚购自上海源叶生物科技有限公司,纯度≧65%;无水乙醇、DPPH为分析纯,由西安晶博生物试剂公司提供;甲醇为色谱纯,由美国Fisher公司提供。
1.2 主要仪器
MS7-H550-S型磁力搅拌器,美国SCILOGEX公司;NS800分光测色仪,深圳市三恩驰科技有限公司;FE20 Plus pH计,上海梅特勒-托利多仪器有限公司;LGJ-18C真空冷冻干燥机,北京四环科学仪器厂;7200可见分光光度计,龙尼柯(上海)仪器有限公司;Tensor27红外光谱仪,德国布鲁克公司;AR-G2流变仪,美国TA公司。
1.3 试验方法
1.3.1 苹果果胶-多酚复合膜液制备
配制质量浓度为50 g/L的苹果果胶溶液,将果胶溶液置于磁力搅拌器上搅拌均匀。精确称量不同质量的苹果幼果多酚,加入少量蒸馏水将多酚溶解后,将多酚溶液分别加入至果胶溶液中,继续搅拌至体系完全混合均匀。以不加入多酚的苹果果胶溶液做对照。最终得到苹果多酚浓度分别为0 、0.5 、1.0和1.5%的果胶-多酚复合膜液。
1.3.2 复合膜液色差测定
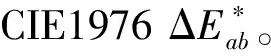
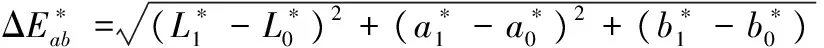
(1)
1.3.3 复合膜液pH测定
复合膜液pH采用FE20 Plus pH计进行测量,每个样品平行测量3次,取平均值。
1.3.4 复合膜液剪切流变特性测定
复合膜液剪切流变学特性采用AR-G2流变仪测定。取适量膜液(约2 mL)置于流变仪样品台上,采用直径为30 mm 的平板进行测试。测试温度为25 ℃,平板与样品台间距为1 mm,在剪切速率范围0~800 s-1记录复合膜液黏度变化值。
1.3.5 复合膜液频率振荡扫描测定
进行复合膜液频率振荡扫描之前,首先对复合膜液进行应力扫描,以确定复合膜液的线性黏弹区。取适量复合膜液(约2 mL)置于流变仪样品台上,在0~100% 应变范围内进行扫描,记录各膜液的线性黏弹区。随后,在0.01%应变条件下,采用直径为40 mm 的平板对各复合膜液进行频率振荡扫描测试。测试温度为25 ℃,平板与样品台间距为1 mm,在频率范围0.1~100 rad/s内记录复合膜液弹性模量G′和损失模量G″。
1.3.6 红外光谱测定
将上述复合膜液采用真空冷冻干燥48 h后,称取少量样品(约5 mg)和100 mg KBr颗粒混合研磨、压片。采用红外光谱仪对冻干的膜液样品进行红外光谱分析,扫描范围为4 000~400 cm-1,以扫描波数为横坐标,以样品透光率为纵坐标绘图。每个样品至少扫描32次[12]。
1.3.7 不同多酚添加浓度的复合膜液抗氧化性的测定
1.3.7.1 复合膜液抑制脂质氧化能力的测定
复合膜液抑制脂质氧化能力的测定参照TSUDA[13]的方法。脂质体的制备:准确称取40 mg卵磷脂于离心管中,加入10 mL 0.1 mol/L磷酸缓冲液(PBS,pH 7.4),充氮封口膜封口,超声30 min,于4 ℃保存备用。80 g/L TBA(2-硫代巴比妥酸)溶液制备:将24 mL 10% NaOH溶液与0.8 g TBA溶液混合均匀,用280 g/L TCA(三氯乙酸)溶液调节pH至5~7,用超纯水定容至100 mL,备用。100 g/L TCA溶液配制:准确称取5 g TCA,加50 mL超纯水溶解。50 mmol/L FeSO4制备:准确称取0.380 g FeSO4,加50 mL超纯水溶解。
试验方法:离心管中依次加入1 mL脂质体和200 μL含不同多酚浓度的复合膜液,充分混匀后,加入1 mL 50 mmol/L FeSO4,用PBS定容至总体积为5 mL,之后置于37 ℃水浴40 min,每隔5 min振摇一次。向各离心管中分别加入2 mL 100 g/L TCA和1.0 mL 8 g/L TBA,充分混合均匀后100 ℃沸水浴15 min,然后迅速冷却至室温并在4 000×g条件下离心10 min,取上清液,于532 nm波长下测定其吸光度值A1。用磷酸缓冲液代替样品溶液设置空白组A0,用磷酸缓冲液代替FeSO4溶液设置对照组A2。用BHT(2,6-二叔丁基-4-甲基苯酚)作为对照参比。按以下公式计算对脂质过氧化的抑制率:

(2)
式中:C指对脂质氧化的抑制率,A1为实验组吸光度值,A2表示对照组吸光度值,A0是空白组吸光度值。
1.3.7.2 DPPH自由基清除能力
复合膜液DPPH自由基清除能力参照HYUN[12]的方法进行测定。移取10 μL不同多酚质量浓度的果胶复合膜液于10 mL离心管中,分别加入9 mL的DPPH-甲醇溶液(0.05 mg/mL),涡旋振荡后避光30 min,在517 nm波长下测定其吸光度值,记为A1。用超纯水代替样品作为空白组,记为A0,用甲醇代替DPPH-甲醇溶液设置对照组,记为A2。按下列公式计算样品对DPPH自由基的清除率:

(3)
式中:C,DPPH自由基的清除率;A1,实验组吸光度值;A2,对照组吸光度值;A0,空白组吸光度值。此外,以BHT作为对照参比。
1.3.7.3 总还原能力试验
取0.2 mL不同多酚浓度的复合膜液,加入0.2 mol/L的磷酸缓冲溶液(pH=6.7)0.4 mL和1% 的K3Fe(CN)6溶液0.4 mL于10 mL离心管中,充分振荡混匀后,50 ℃水浴20 min。加入0.4 mL浓度为10%的三氯乙酸溶液并混匀后,5 000×g条件下离心10 min。取上清液0.1 mL,并加入1.0 mL蒸馏水和0.5% 三氯化铁溶液0.2 mL,混匀后室温静置反应10 min,在700 nm处测定其吸光度值。同时使用BHT作为对照参比。
1.4 数据分析处理
上述指标均测定3次,测试结果表示为平均值±标准差。显著性分析采用DPS软件,图形绘制采用Origin 8.0 软件。
2 结果与分析
2.1 不同多酚浓度对复合膜液色值的影响
复合膜液色泽显著影响其成膜后的薄膜色泽。如图1所示,随着多酚质量浓度增加,膜液的色泽也逐渐加深。此外,由表1所示,多酚浓度显著影响不同膜液的L*、a*、b*值及总色差ΔE*。随着膜液中多酚浓度不断增大,膜液L*值和ho值逐渐减小,而a*值、b*值、c*值及总色差ΔE*不断增大。当膜液中多酚浓度为0时,膜液外观色泽表现为淡黄色,随着膜液中多酚质量浓度不断增加,膜液外观色泽逐渐加深,当多酚质量浓度增加至1.5 g/L时,膜液色泽变为深棕色。这可能是由于苹果多酚中主要呈色物质是原花青素B2,花青素在酸性溶液中呈红色,随着多酚质量浓度增大,花青素的质量浓度也逐渐增加,导致膜液的a*和c*增大。

表1 不同多酚质量浓度的复合膜液色差测定Table 1 color measurements of complex membrane liquid with different polyphenol contents
注:表中不同小写字母之间表示显著性差异(p<0.05)。

图1 不同多酚质量浓度复合膜液外观图Fig.1 Appearance of complex membrane liquid with different polyphenol contents
2.2 不同多酚质量浓度对膜液pH值的影响
果胶分子含有65%以上的半乳糖醛酸,因此当果胶溶于水后,果胶水溶液显弱酸性[14]。不同果胶其半乳糖醛酸质量浓度不同,导致其水溶液pH值也不同,但大多数果胶水溶液的pH值大都在3.0~4.0(1%的浓度条件下)。多酚水溶液一般显弱酸性,其pH值大都在4~7之间,高于同等浓度条件下果胶水溶液的pH。由图2可知,当果胶溶液不含多酚时,其pH值约为3.30,显著低于其他膜液(p<0.05);随着多酚浓度增加,膜液的pH 值也呈现略微升高趋势。当多酚浓度增加至10 g/L时,膜液的pH值为3.74,与多酚浓度为15 g/L的膜液无显著差异(p>0.05)。加入多酚时,由于多酚水溶液的pH值高于果胶溶液,因此部分中和了果胶溶液的pH值,引起膜液pH值显著升高。然而,当多酚质量浓度继续增加时,多酚和果胶分子之间形成氢键,导致膜液黏度迅速增加,部分限制了果胶分子羧基中H+的释放,因此,当多酚浓度增加至15 g/L时,膜液pH值与多酚浓度为10 g/L的膜液无显著差异。
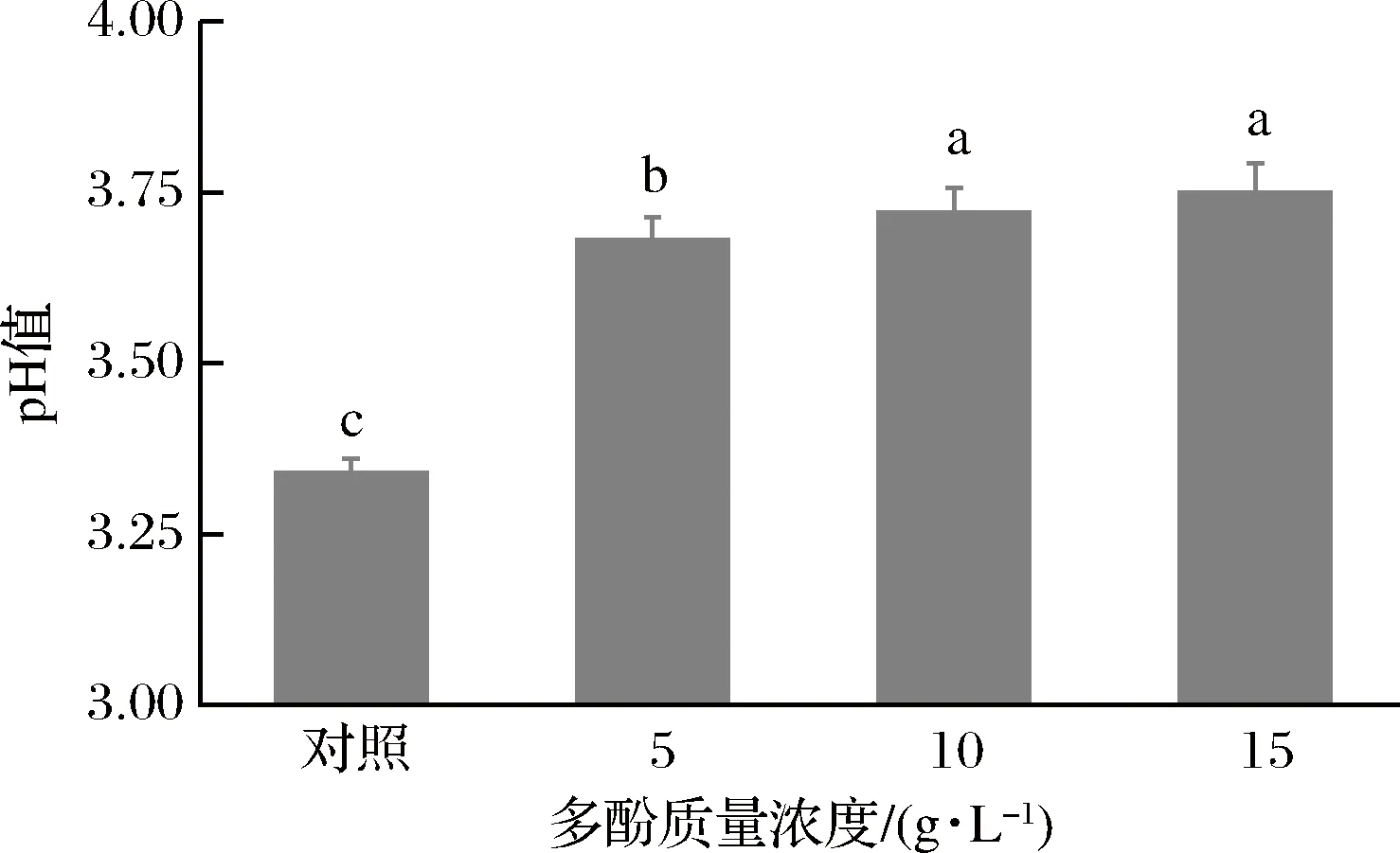
图2 不同多酚质量浓度对膜液pH值的影响Fig.2 Effect of polyphenol concentrations on the pH values of the complex membrane liquids
2.3 不同多酚质量浓度对复合膜液剪切流变学性质的影响
多酚和果胶溶液均一混合后可形成黏稠状的液体,该液体同时表现出黏性和弹性的特征[15-17]。因此,本文首先研究了不同多酚浓度对复合膜液剪切流变学性质的影响。由图3可知,不同多酚质量浓度的复合膜液均表现出剪切变稀效应,即膜液的表观黏度随剪切速率的增加而降低。这可能是由于剪切速率增加使得果胶大分子发生定向有序的排列,因此减少了果胶分子之间的摩擦力[18],这一结果与曾瑞琪等[19]的研究结果一致。在剪切速率为0 s-1的条件下,对照组膜液的表观黏度为110 Pa·s,当多酚质量浓度为0.5%时,膜液初始表观黏度增加至200 Pa·s;随着多酚质量浓度继续增加,膜液初始表观黏度继续上升。这可能是由于果胶分子和多酚之间形成了氢键,随着多酚添加量增加,果胶分子和多酚之间形成的氢键也逐渐增多,引起膜液初始表观黏度显著增加[19](p<0.05)。当剪切速率由0增加至200 s-1时,不同膜液的表观黏度均呈快速降低趋势,这可能是由于当剪切速率增加时,果胶分子在剪切力的作用下发生有序排列,使得果胶分子之间的摩擦降低,因此导致膜液黏度显著降低。然而随着剪切速率由200 s-1增加至800 s-1时,不同膜液的表观黏度呈现缓慢降低趋势,最终均趋近于5 Pa·s,表明高速剪切对膜液的黏度影响较小。此外,由图3还可看出,随着剪切速率增加,不同膜液的剪切应力均呈现先迅速增加再逐渐减缓的趋势,当剪切速率增加至800 s-1时,对照组膜液的剪切应力约为3 750 Pa,然而,多酚质量浓度为15 g/L的膜液剪切应力达到4 000 Pa以上,说明随着多酚质量浓度增加,膜液越黏稠。
此外,本文对不同复合膜液的静态流变特性进行了模型拟合[20]。由表2可知,各拟合方程的R2均大于0.96,表明该模型拟合程度较高。各膜液的n值均在0~1之间,表明各膜液均属于假塑性流体[21]。随着多酚质量浓度增加,膜液的n值减小,K值增大,说明复合膜液的假塑性特性更加明显[22]
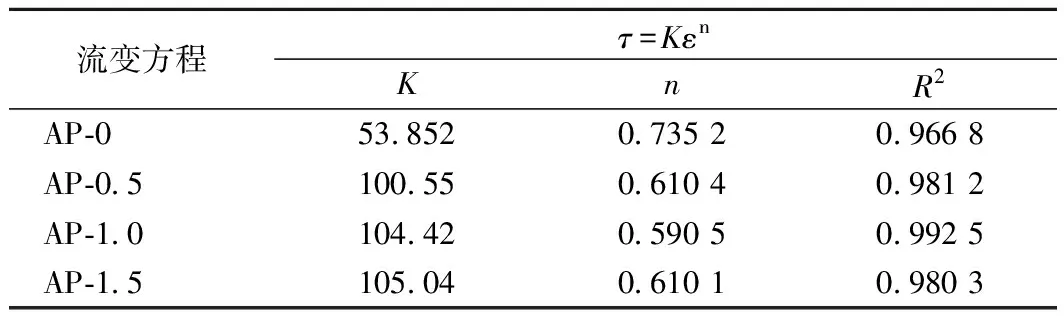
表2 不同多酚浓度-果胶复合膜液的流变特性参数Table 2 Rheological parameters of complex membrane liquids with different polyphenol contents
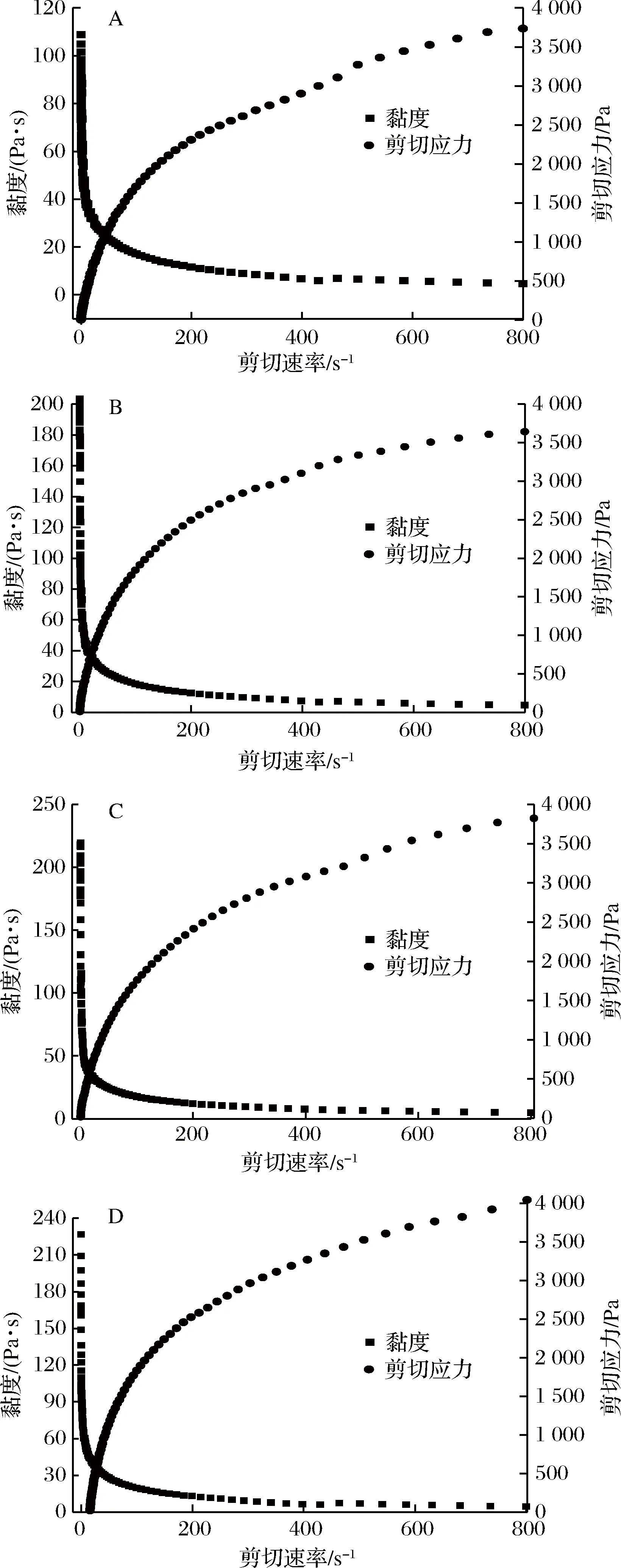
A-对照(果胶溶液);B-5 g/L多酚;C-10 g/L多酚;D-15 g/L多酚图3 不同多酚质量浓度对复合膜液静态流变特性的影响Fig.3 Effect of polyphenol concentrations on the static rheological properties of the complex membrane liquids
2.4 不同多酚浓度对复合膜液动态剪切流变学性质的影响
为探究不同多酚质量浓度对复合膜液稳定性的影响,本文进一步研究了复合膜液在频率扫描0.1~100 rad/s 范围内弹性模量G′和粘性模量G″的变化。由图4所示,随着扫描频率增加,不同膜液的G′和G″均呈现增加趋势。当多酚质量浓度为0~10 g/L时,在整个频率范围内膜液的G′总高于G″,表明该膜液表现出偏弹性的特征[23]。然而,当多酚浓度增加至15 g/L时,在频率范围0.1~9 rad/s内,膜液的G″高于G′,表明在此范围内,膜液表现出偏黏性的特征。随着扫描频率继续增加,膜液的G′逐渐超过G″,出现G′和G″的交点。这可能是由于扫描频率增加时,果胶分子不断地重新排列,导致果胶分子和多酚接触更为频繁,因此形成了更多的氢键,所以在多酚浓度0~10 g/L范围内,膜液G′和G″随扫描频率增加而呈增加趋势;然而,当多酚浓度增加至15 g/L时,多酚和果胶分子之间形成足够的氢键,使得膜液具有较高的黏度,随着扫描频率增加,这些氢键不断遭到破坏,但另一方面快速的振荡使得果胶分子和多酚不断发生碰撞,导致新的氢键的生成,所以当扫描频率增加至9 rad/s时,膜液G′高于G″。
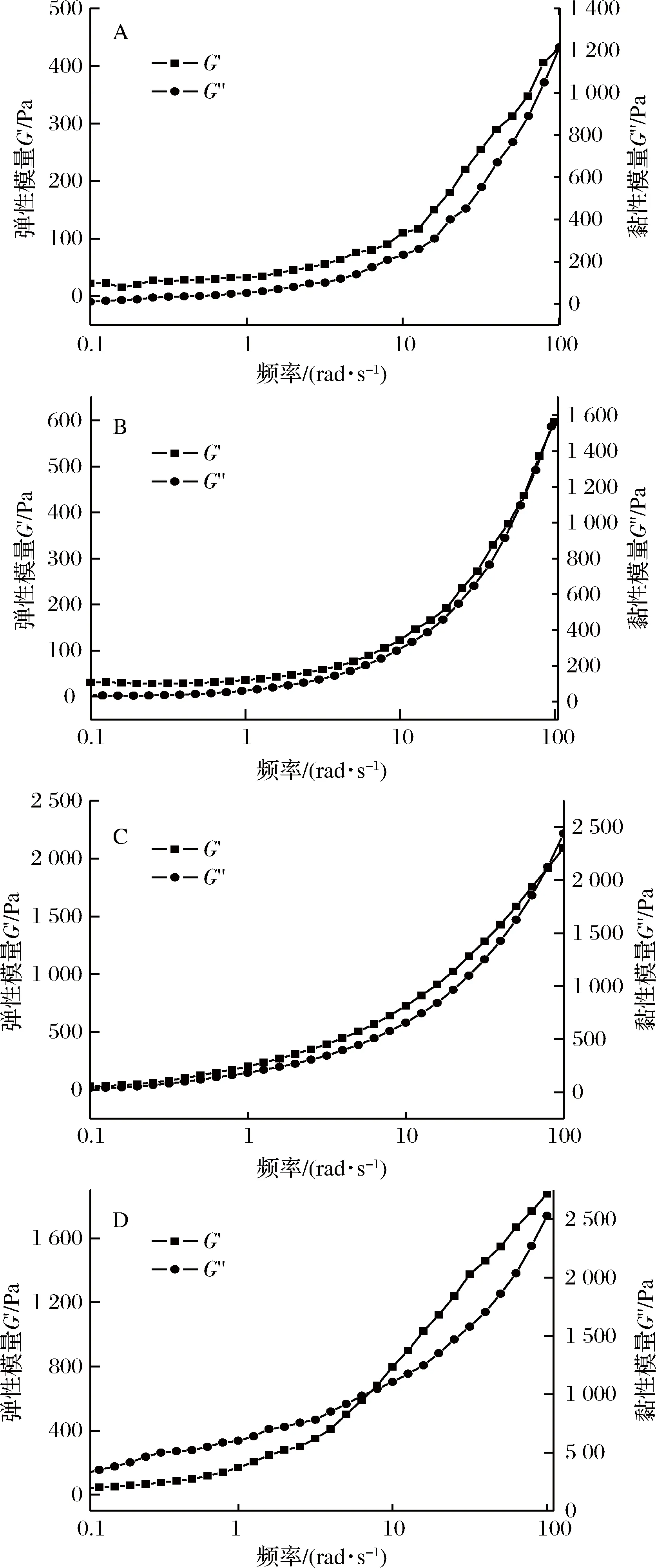
A-苹果果胶;B-5 g/L多酚复合膜液;C-10 g/L多酚复合膜液;D-15 g/L多酚复合膜液图4 不同多酚添加量对膜液动态流变特性的影响Fig.4 Effect of polyphenol concentrations on the dynamic rheological properties of the complex membrane liquids
2.5 复合膜液红外光谱分析
为研究复合膜液中多酚和果胶分子之间的相互作用力及存在形式,本文采用红外光谱法分析果胶和多酚分子间作用力。由图5看出,多酚、果胶及不同膜液红外光谱曲线均在3 400 cm-1处出现显著的吸收峰,可能是由果胶和多酚分子内的O—H伸缩振动引起。此外,苹果果胶红外光谱显示,1 744 cm-1处的吸收峰高于1 635 cm-1处的吸收峰,表明该苹果果胶属于高脂果胶[24]。苹果多酚的红外光谱曲线在2 930 cm-1处没有出现吸收峰,而果胶和不同膜液的红外光谱中在此处有明显的吸收峰,这可能是由于果胶分子中—CH2基团的C—H伸缩振动引起。苹果多酚在1 521 cm-1处具有明显的吸收峰,可能是由于多酚中C—N或N—H伸缩振动引起。当膜液中多酚质量浓度为5 g/L时,膜液在1 520 cm-1处没有明显的吸收峰,随着多酚质量浓度增加至10 g/L,该吸收峰逐渐凸显。这可能是由于,当膜液中含有少量多酚时,这些多酚几乎全部和果胶分子形成分子间氢键,从而影响了多酚的C—H或N—H键振动;然而,当多酚浓度继续增加时,部分多酚可能未和果胶分子形成氢键,因此这些多酚仍然在1 520 cm-1处有明显的吸收峰。此外,由图5还可看出,随着多酚浓度增加,膜液在3 400 cm-1处和1 630 cm-1处的吸收峰出现轻微的红移,可能是由于多酚浓度增加导致膜液体系内形成了更多的氢键。
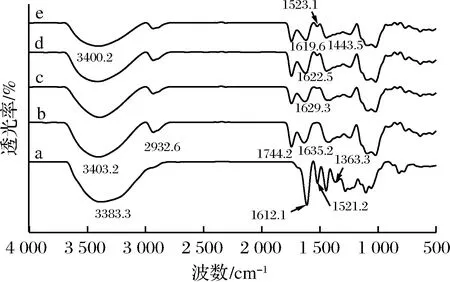
a-苹果多酚;b-苹果果胶;c-5 g/L多酚复合膜液;d-10 g/L多酚复合膜液;e-15 g/L多酚复合膜液图5 不同多酚添加量对膜液红外光谱的影响Fig.5 Effect of polyphenol concentrations on the infrared spectroscopy of the complex membrane liquids
2.7 不同多酚添加浓度对复合膜液抗氧化性的影响
多酚具有较好的抗氧化性,因此可以抑制微生物生长并有效延缓含油食品的腐败[25]。如图6-A可知,随着多酚质量浓度的增加,膜液的脂质氧化抑制率呈显著增加趋势,当多酚质量浓度为15 g/L时,膜液的脂质氧化抑制率达80%以上,表现出良好的抑制脂质氧化的能力。由图6-B可知,随着多酚质量浓度的增加,膜液的DPPH自由基清除率也呈明显升高趋势。当多酚质量浓度为10 g/L时,DPPH自由基清除率为84%,显著(p<0.05)高于对照处理;当多酚质量浓度增加至15 g/L时,膜液的DPPH自由基清除率为88%,但与多酚质量浓度为10 g/L的膜液差异不显著(p>0.05)。此外,由图6-C可知,随多酚质量浓度的增加,膜液的总还原力呈显著增加趋势,然而多酚含量为1.0%和1.5%的膜液总还原力之间无显著差异(p>0.05)。
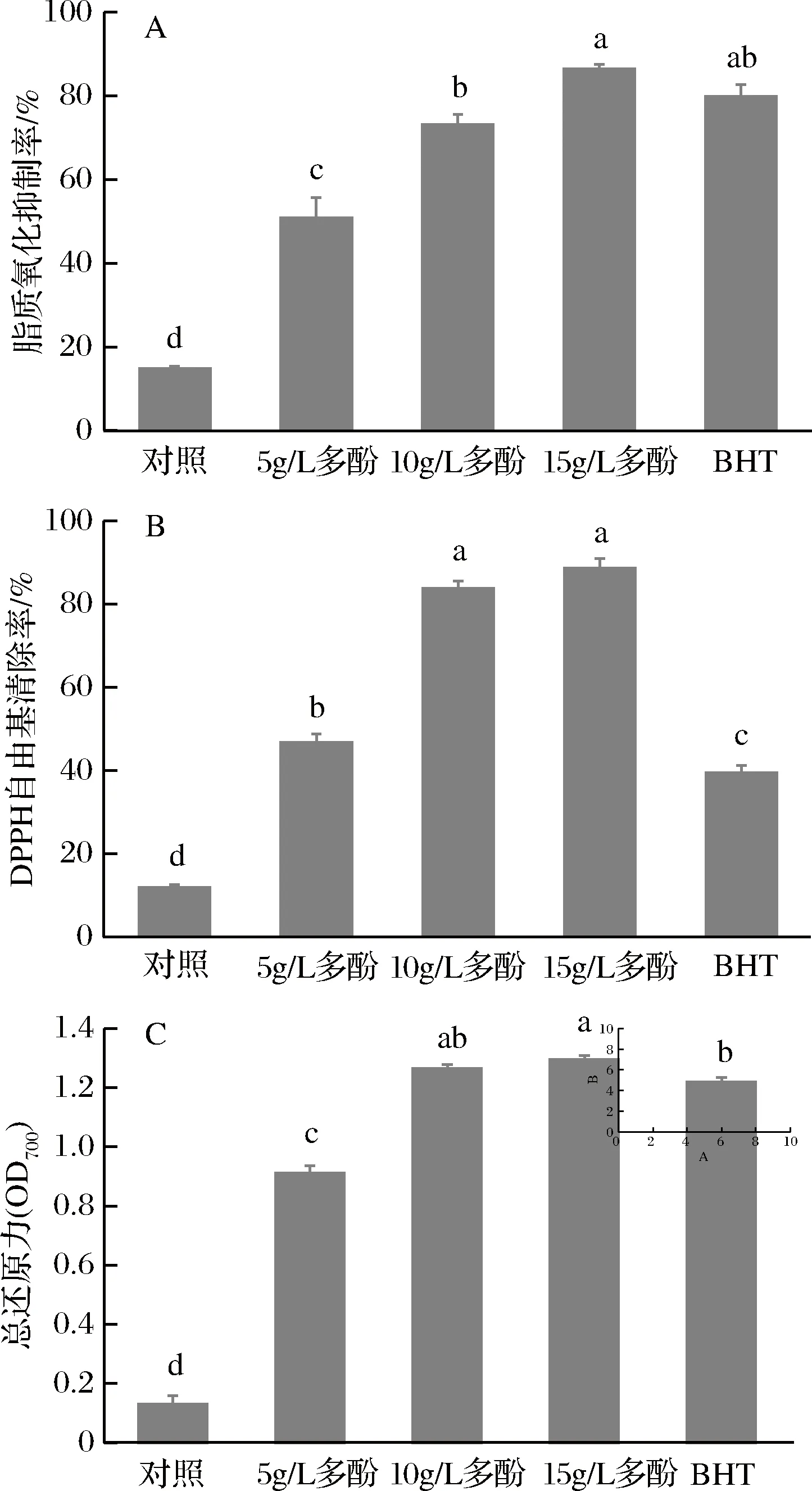
A-脂质氧化抑制率;B-DPPH自由基清除率;C-总还原力图6 不同多酚添加量对膜液抗氧化性的影响Fig.6 Effect of polyphenol concentrations on the antioxidant capacity of the complex membrane liquids
3 讨论
本文以苹果果胶和苹果多酚为原料制备出一种复合膜液,并对该膜液的流变学性质和抗氧化性进行了研究。本文所使用的苹果果胶酯化程度为65%,属于高脂果胶,加入苹果多酚后,膜液的黏度迅速增加,这可能是由于多酚中含有大量的酚羟基,可以和果胶分子形成分子间氢键,加强了果胶分子的桥连作用[19,26]。ILLSE[27]研究表明,在果胶多糖溶液中加入钙离子后也会引起果胶溶液黏度显著增加,其原因是钙离子和果胶分子的羧基之间形成了离子键。当果胶分子中超过50%的半乳糖醛酸未被甲酯化时,该果胶为低脂果胶,加入适当的钙离子可以和果胶分子形成足够的交联,甚至形成凝胶。本文发现,随着多酚添加量增加,膜液黏度也呈显著增加趋势,当多酚质量浓度增加至10 g/L时,膜液黏度达到220 Pa·s左右,显著高于果胶溶液(p<0.05)。随着多酚含量继续增加,膜液黏度增加不显著,这可能是由于当多酚质量浓度为10 g/L时,多酚和果胶分子之间形成的氢键数达到最大值,继续添加多酚并未引起膜液体系分子间氢键的增加。频率扫描试验表明,膜液在频率范围0.1~100 rad/s内,随着扫描频率增加,其弹性模量G′和损失模量G″也呈增加趋势,说明膜液的机械强度也有所增加[28]。这可能是由于扫描频率加快时,增加了果胶分子和多酚之间的碰撞几率,进而有利于分子间氢键的形成[19]。
除增加膜液机械强度外,将多酚加入果胶溶液还可以提高膜液的抗氧化性,有利于增加膜液成膜后的保鲜效果。ZHUA等[29]研究表明,虽然果胶多糖具有一定的抗氧化能力,但果胶的抗氧化能力一般低于多酚。本文研究发现,将多酚加入果胶膜液后,膜液脂质氧化抑制率显著增加,此外,DPPH自由基清除率和铁总还原力也明显增加。这些结果表明,果胶-多酚复合膜液具备良好的抗氧化性,在食品保鲜方面具有一定应用前景。然而,本文发现,当多酚质量浓度为10 g/L时,复合膜液已经具备较好的抗氧化能力,随着多酚质量浓度继续增加至15 g/L,虽然膜液的抗氧化能力有所增加,但与多酚质量浓度为10 g/L的复合膜液相比无显著差异(p>0.05)。此外,值得一提的是,为了突出多酚质量浓度对果胶-多酚复合膜液的影响,本文采用的果胶溶液质量浓度为50 g/L,几乎达到了该果胶的饱和溶解度,因此在实际应用中,为满足不同果蔬涂膜的需求,可以适当调整果胶溶液的初始浓度。
4 结论
将苹果多酚加入果胶溶液可显著提高膜液的表观黏度,且膜液黏度随多酚质量浓度的增加而呈升高趋势,这是因为多酚质量浓度增加引起膜液体系内果胶分子和多酚形成了更多的分子间氢键。此外,膜液脂质氧化抑制率、DPPH自由基清除率及总还原力也随多酚质量浓度增加而增加,当多酚质量浓度增加至10 g/L时,膜液具备较好的机械强度和抗氧化能力。然而,随多酚质量浓度继续增加,膜液黏度和抗氧化能力虽有缓慢增加,但与多酚质量浓度为10 g/L的膜液无显著差异。综合而言,果胶-多酚复合膜液可以作为液体涂膜应用于食品保鲜方面,具有一定应用前景。
