黄瓜品种抗疫病鉴定及其防御相关酶系研究
2018-09-05柴喜荣康云艳
柴喜荣,林 洁,杨 暹,康云艳
(华南农业大学园艺学院,广东 广州 510642)
疫病是危害黄瓜生产的毁灭性土传病害,由疫霉菌侵染引起,苗期至成株期均可发病,潜育期短,传播速度快,侵染力强,广东省每年春植或夏、秋植黄瓜由疫病引起的死株率轻则10%,重则高达80%[1-2]。由于疫霉菌抗性来源的复杂性和疫霉菌发生遗传变异的速度非常快,瓜类疫病抗性育种进展缓慢。目前,黄瓜品种中尚未发现对该病具有完全免疫或高抗的类型。一些农业措施如轮作、嫁接、清洁田园等,均有一定的减轻病害的效果,但均不能从根本上控制病害[3]。植物诱导抗病性产生常常伴随着病程相关蛋白(Pathogenesis related protein,PRs)的大量积累。在这些PRs中,几丁质酶(Chitinase,CHT)和葡聚糖酶(Glucanase,GLU)具有直接杀伤或抵抗病原物的活性与作用[4-5];过氧化物酶(Peroxidase,POD)则参与细胞木质化过程,使细胞壁加强、抗病性增加;苯丙氨酸解氨酶(Phenylalnine ammonialyase,PAL)是植物保卫素、木质素和酚类化合物合成的关键酶和限速酶;多酚氧化酶(Polyphenoloxidase,PPO)可以在植物受病原菌侵染时氧化酚生成醌,对病菌产生抑制和毒害作用[6]。
本试验通过灌根接种约5×103个/mL甜瓜疫霉菌游动孢子悬浮液,对不同来源的7个黄瓜品种进行抗病性筛选,并以筛选出的中农20号和正源油绿花青大吊瓜分别为感/抗品种,进一步探讨疫霉菌对黄瓜叶片内病程相关蛋白POD、PPO、PAL、GLU、CHT活性的影响,研究结果可为揭示黄瓜疫霉菌抗性生理机制提供理论依据。
1 材料与方法
1.1 试验材料
供试黄瓜品种:中农20号由中国农业科学院蔬菜花卉研究所提供,正源油绿花青大吊瓜由汕头市利农蔬菜良种研究所提供,长春密刺由哈尔滨金龙农业有限公司提供,津优1号由天津市黄瓜研究所提供,抗病二号、粤秀3号和早青二号由广东省农业科学院蔬菜研究所提供。
供试菌种:甜瓜疫霉菌(Phytophthora melonis)由华南农业大学资源环境学院提供。将病原菌接种在胡萝卜培养基上,置于26℃的人工气候箱黑暗培养,7 d后加入适量土壤浸出液,26℃、全光照诱导游动孢子1~2 d,经血球计数板计数,配成终浓度约为5×103个/mL的游动孢子悬浮液。
胡萝卜培养基:胡萝卜200 g切片榨汁,加入蒸馏水浸泡5 min后过滤、定容至1 L,摇匀,然后按100 mL分装,每瓶加入1.3 g琼脂糖,121℃高压蒸汽灭菌备用。
土壤浸出液:肥沃菜园土50 g,蒸馏水200 mL,搅拌,过滤,所得滤液即土壤浸出液。
1.2 试验方法
试验在华南农业大学蔬菜试验基地进行。2013年7月1日,将7个黄瓜品种种子浸种催芽,发芽后播于装有草炭∶珍珠岩∶蛭石=1∶1∶1混合基质的32孔育苗盘中,基质经134℃高温蒸汽灭菌1 h,常规管理。7月14日黄瓜幼苗两叶一心期,灌根接种约5×103个/mL疫霉菌游动孢子悬浮液,以清水作对照。接种前浇透水,取10 mL游动孢子悬浮液加至距植株茎基部2~3 cm处的基质内,接种后将植株置于鉴定室内保湿(RH为100%)24 h,以后保持土壤湿度近饱和,接种期间温度控制在24~28℃。接种后2 d统计病情指数,并取各处理植株的第2片真叶,用于PPO、POD、PAL、CHT、GLU活性的测定。每个处理3次重复,每个重复32株。
1.3 测定项目及方法
1.3.1 黄瓜疫病抗性鉴定 根据NY/T 1857-2010 《黄瓜主要病害抗病性鉴定技术规程》稍作修改,游动孢子悬浮液接种量由2 mL/株改为10 mL/株,病情调查时间由接种后7 d 改为接种后3 d,计算病情指数,并评价黄瓜品种的抗病性。
(1)病情分级。室内病情分级及其症状描述见表1。

表1 黄瓜疫病病情分级标准
(2)病情指数。病情指数计算公式为:
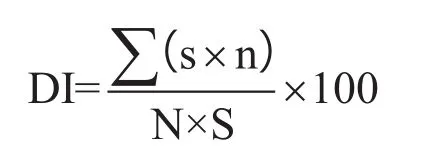
式中,DI为病情指数,s为各病情级别代表数值,n为各病情级别病株数,N为调查总株数,S为最高病情级别代表值。
(3)抗性评价标准。根据发病材料的病情指数,确定其对疫病的抗性水平,划分标准见表2。

表2 黄瓜对疫病抗性评价标准
1.3.2 酶活性测定 POD、PAL、PPO活性测定参照Chen等[7]的方法,CHT、GLU活性测定参照Ge等[8]的方法。
试验数据采用Excel 2010和SPSS Statistics 17.0软件进行统计分析。
2 结果与分析
2.1 不同黄瓜品种抗病性鉴定
如图1所示,本试验7个黄瓜品种接种5×103个/mL甜瓜疫霉菌游动孢子后,各品种对疫霉菌的抗性表现不同,由强到弱依次为花青大吊瓜>长春密刺>粤秀3号>抗病2号>津优1号>中农20号>早青2号。其中,长春密刺、正源油绿花青大吊瓜、抗病二号和粤秀3号 等4个品种病情指数范围均表现出中抗,品种间抗性无显著差异;中农20号、早青二号和津优1号3个品种病情指数范围均表现出感病,品种间抗性亦无显著差异。本试验选定中抗品种花青大吊瓜、感病品种中农20号进一步探讨叶片中病程相关蛋白的变化规律。
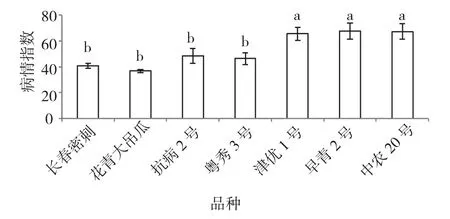
图1 不同黄瓜品种接种甜瓜疫霉菌后的病情指数
2.2 接种疫霉菌对不同抗性黄瓜品种叶片POD活性的影响
从图2可以看出,未接种疫霉菌条件下,中抗品种叶片POD活性显著高于感病品种;接种疫霉菌显著诱导提高了抗感品种叶片POD活性,与对照相比,感病品种中农20号POD活性提高150%,中抗品种花青大吊瓜提高91%,但中抗品种的POD活性仍然高于感病品种。

图2 接种疫霉菌对黄瓜叶片POD活性的影响
2.3 接种疫霉菌对不同抗性黄瓜品种PPO活性的影响
从图3可以看出,未接种疫霉菌条件下,中抗品种叶片PPO 活性显著高于感病品种;接种疫霉菌显著诱导提高了感病品种中农20号叶片PPO活性,与对照相比,叶片PPO活性提高211%,而对中抗品种花青大吊瓜叶片PPO活性无显著诱导作用。接种病原菌后,感病品种中农20号叶片PPO活性显著高于中抗品种花青大吊瓜。
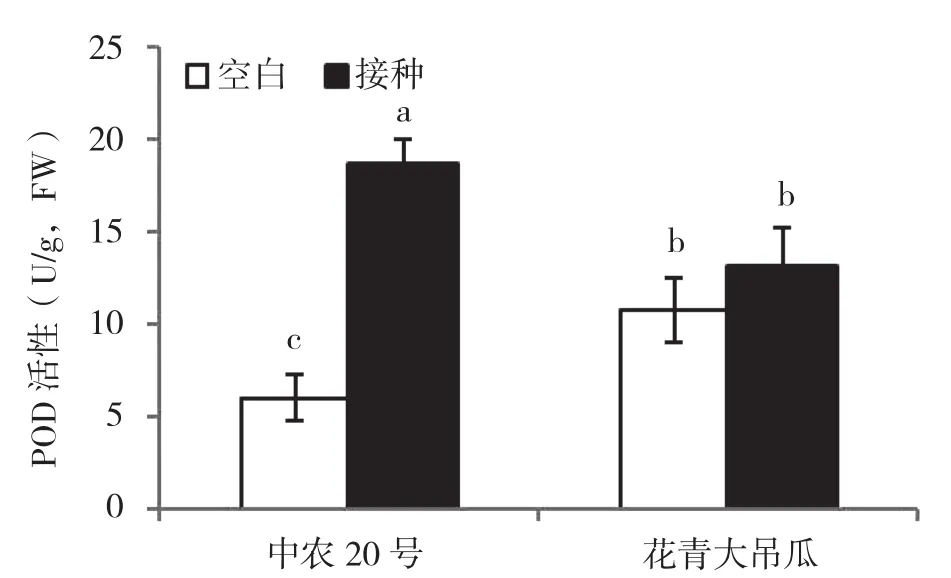
图3 接种疫霉菌对黄瓜叶片PPO活性的影响
2.4 接种疫霉菌对不同抗性黄瓜品种PAL活性的影响
由图4可知,未接种疫霉菌条件下,中抗品种叶片PAL活性显著高于感病品种;接种疫霉菌显著诱导提高抗感品种叶片PAL活性,与对照相比,感病品种中农20号PAL活性提高321%,中抗品种花青大吊瓜提高93%,但中抗品种的PAL活性仍然高于感病品种。
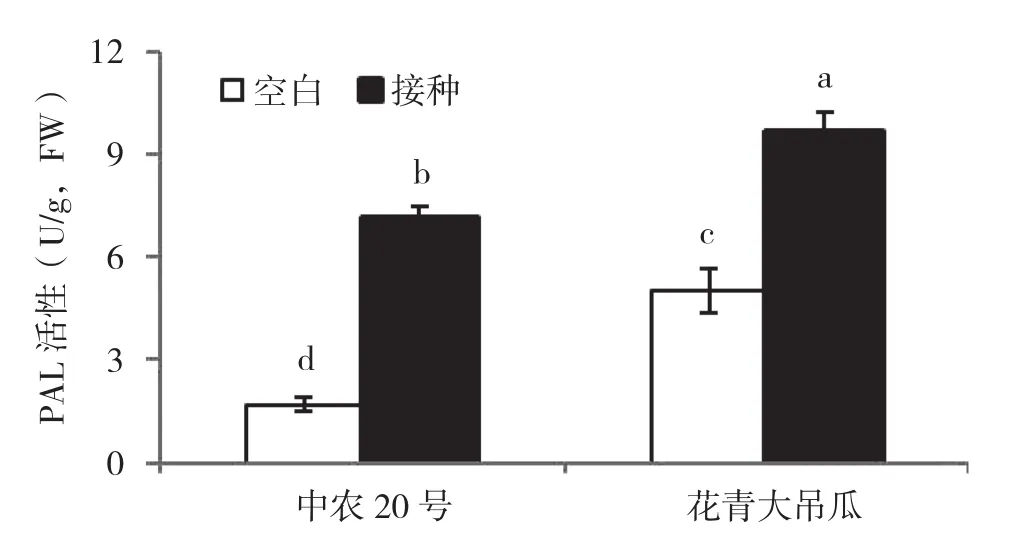
图4 接种疫霉菌对黄瓜叶片PAL活性的影响
2.5 接种疫霉菌对不同抗性黄瓜品种CHT活性的影响
从图5可以看出,未接种疫霉菌条件下,感病品种中农20号叶片CHT活性显著高于中抗品种花青大吊瓜;接种疫霉菌对抗/感品种叶片CHT活性均无显著影响。

图5 接种疫霉菌对黄瓜叶片CHT活性的影响
2.6 接种疫霉菌对不同抗性黄瓜品种GLU活性的影响
从图6可以看出,未接种疫霉菌条件下,中抗品种叶片GLU 活性显著高于感病品种;接种疫霉菌显著诱导提高感病品种中农20号叶片GLU活性,与对照相比,叶片GLU活性提高144%,而接种疫霉菌对中抗品种花青大吊瓜叶片GLU活性无显著诱导作用。接种病原菌后,感病品种中农20号叶片GLU活性显著高于中抗品种花青大吊瓜。
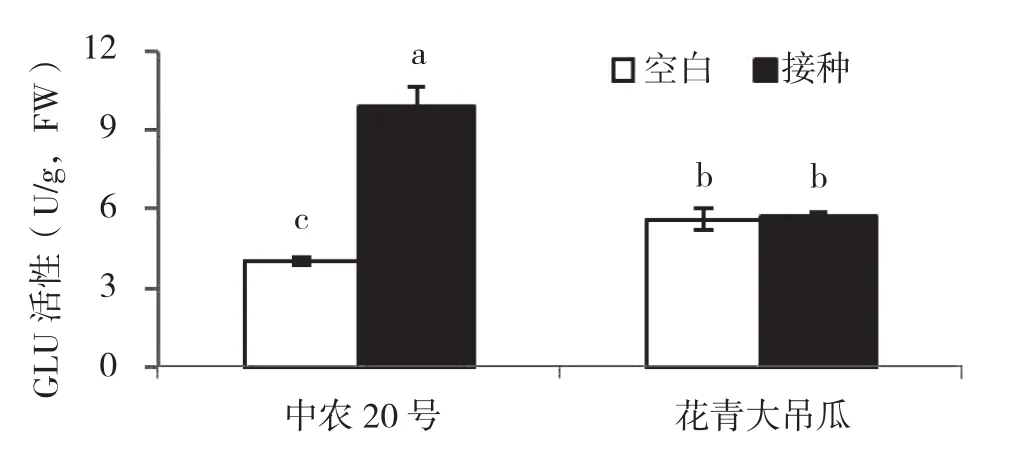
图6 接种疫霉菌对黄瓜叶片GLU活性的影响
3 结论与讨论
本试验以7个不同黄瓜品种进行疫病的抗病性筛选,其中长春密刺、正源油绿花青大吊瓜、抗病二号和粤秀3号4个品种抗性较强,为中抗品种;中农20号、早青二号和津优1号3个品种抗性较弱,为感病品种,没有发现高抗或免疫品种。进一步的试验以中农20号和花青大吊瓜分别为感/抗材料,用于测定防御相关酶活性,结果表明,未接种疫霉菌条件下,正源油绿花青大吊瓜黄瓜叶片的POD、PPO、PAL、GLU活性均显著高于感病品种中农20号。接种疫霉菌游动孢子悬浮液后,中抗品种花青大吊瓜叶片的POD、PAL活性显著升高,其余相关酶活性无显著变化;感病品种中农20号叶片POD、PPO、PAL、GLU活性显著增强,且增幅均大于中抗品种花青大吊瓜;接种前后两个品种的CHT活性均无明显变化。由此可以推测,未接种疫霉菌条件下,中抗品种植株叶片内含有更高的防御相关酶活性,病原菌侵染后,植株能迅速提高POD、PAL活性,增强细胞壁,来抵御病原菌的侵染;相反,未接种疫霉菌条件下,感病品种中农20号叶片内防御相关酶活性水平低,植株被疫霉菌侵染后,叶片内除了POD、PPO、PAL细胞壁相关酶活性上升外,GLU活性也迅速升高,原因可能是病菌侵染细胞后,感病黄瓜品种的膜系统受损、透性增加,酶与底物无控制地接触,从而表现为酶促反应加速、酶活性提高,GLU的合成与积累显著被诱导,参与了植株对病原菌的防御;接种前后感/抗品种CHT活性均无明显变化,原因可能是甜瓜疫霉菌细胞壁中没有几丁质,因此几丁质酶活性没有受诱导。
POD、PPO、PAL是植物次生代谢过程中的3个关键酶,不仅是重要的内源活性氧清除剂,而且主要负责催化细胞壁中的大分子物质交联以加强细胞壁的结构或修复受损的细胞壁,属于植物防卫系统相关酶,因此可作为植物抗病的生化指标[9-11]。在植物抗病防御系统中,CHT和GLU的作用也受到普遍关注,如CHT和GLU能直接攻击病原物,特别是病原真菌;GLU和CHT可以直接酶解病原真菌的细胞壁使致病病原物瓦解,失去致病能力;酶解后病原物的细胞壁破碎物又可以作为激发子再次刺激植物产生抗病防卫反应,从而达到抗病的目的[12]。
POD、PPO、PAL、GLU、CHT与植物抗病性的关系在不同植物、多种病害的研究结论不甚一致。侯茜等[13]研究表明,POD、PPO、PAL、CHT的活性与抗病性呈正相关,可用西瓜幼苗根部POD、PPO、PAL、CHT的活性作为反映苗期西瓜材料枯萎病抗性的生理生化指标;李新等[14]对黄瓜不同品种苗期感染枯萎病菌后几种酶活性变化的研究发现,接种枯萎病菌后,抗/感品种3种酶活性均增高,但抗病品种的酶活性增加幅度高于感病品种;相反,刘守伟等[15]对黄瓜与枯萎病菌的研究指出,不同抗性黄瓜品种接种枯萎病菌后抗/感品种POD、PPO活性都升高,但感病品种上升速度快、幅度大;张少英等[16]对甜菜与丛根病的研究发现,供试4个甜菜品种的CHT和GLU活性均表现为抗病品种高于感病品种;左豫虎等[17]对大豆与疫霉根腐病的研究指出,大豆对大豆疫霉根腐病的抗性与CHT、GLU活性呈正相关关系;Liang等[18]对黄瓜与白粉病的研究指出,接种白粉病菌能够诱导黄瓜叶片CHT活性升高,且CHT活性与黄瓜抗病性呈正相关;而莫熙礼等[19]对辣椒与白粉病菌的研究指出,CHT活性与辣椒的抗病性无相关性,该结果与许多学者研究结果不一致。
