紫茎泽兰杀螨喷剂的制备及其临床效果评价
2018-09-04翁嘉华胡延春胡力文左之才彭广能邓俊良
翁嘉华,石 真,胡延春,胡力文,符 杰,左之才,彭广能,邓俊良
(四川农业大学动物医学院/动物疫病与人类健康四川省重点实验室,成都 611130)
紫茎泽兰(Eupatorium adenophorum)作为被我国环保总局确定为最重要的16种外来入侵生物之一的植物[1],自20世纪40年代入侵中国以来,其每年能造成巨大的生态灾难以及经济损失[2],现在仍以每年60 km的速度向北和向东蔓延。然而研究表明紫茎泽兰具有很好的杀螨作用[3-5],对牛螨[6]、兔螨[7-8]以及动物疥螨都具有很明显的控制作用。
螨虫病作为一种表皮寄生虫病,具有接触传染性,其一般先在嘴、鼻孔、眼周以及脚爪部发生病变,然后向四肢、头腹部等其他部位扩展[9],使动物产生表皮瘙痒、抓挠、长痂皮等特征,感染严重者会导致营养不良,机体功能下降,更有甚者会出现死亡。目前常用的治疗螨虫的药物有伊维菌素、双甲脒、天然除虫菊酯等。董艳芳等[10]利用伊维菌素治疗兔螨虫病,取得显著的效果。近年研究表明长期使用此类药物会造成动物中毒,产生耐药性,并可能造成药物残留以及环境污染[11-12]。所以低毒高效无残留的杀螨剂对于螨虫的防治以及环境保护具有深刻的意义。本试验将具有杀螨活性的紫茎泽兰提取物制备成杀螨喷剂,并对其临床杀螨效果进行评价,为紫茎泽兰的功能开发以及市场应用提供试验依据。
1 材料和方法
1.1 材料
本试验所用紫茎泽兰均于2016年7月采自四川省凉山州。采集生长健康茂盛的植株,放置于室内或者没有太阳的地方阴干,并在干燥环境下保存备用。
1.2 主要仪器与试剂
主要仪器:HC-280T2型中药粉碎机(永康市绿可食品机械有限公司)、DZKW-4型电子恒温水浴锅(上海宜宣仪器纱筛厂)、1260型高效液相色谱仪(Agilent Technologies)、JJ-1型增力电动搅拌器(北京市永光明医疗仪器有限公司)、R201D型旋转蒸发仪(巩义市英裕高科技仪器厂),CP2245型电子分析天平(Sariorius)。
主要试剂:乙醇(分析纯,成都市科龙化工试剂厂)、聚山梨酯-80(分析纯,四川西陇化工有限公司)、月桂氮酮(分析纯,郑州津北化工有限公司)、甲醇(分析纯,天津市光复科技有限公司)、乙酸乙酯(分析纯,成都市科龙化工试剂厂)。
1.3 紫茎泽兰浸膏的制备
将风干的紫茎泽兰用中药粉碎机粉碎为粉末,然后过40目筛去除大颗粒残渣。加入甲醇浸泡过夜,重复浸泡3次,合并滤液,过滤,减压蒸干。将得到的浸膏用萃取液(甲醇∶乙酸乙酯∶水=1∶5∶4)萃取,收集上层有机相,减压蒸干。称取一定量的浸膏,乙醇溶解,在40℃条件下加入粉末状活性炭吸附脱色,过滤,再次减压蒸干,-20℃条件下保存浸膏。
1.4 正交设计
紫茎泽兰喷剂的制备过程主要是将紫茎泽兰浸膏用一定比例的乳化剂、助溶剂以及透皮剂等溶解,并稀释即可。经过预试验筛选,本试验主要选择的乳化剂为聚山梨酯-80,助溶剂为乙醇,透皮剂为月桂氮酮。本试验主要考察以上3个因素,各取3个水平(见表1)进行L9(34)正交试验,并以9-羰基-10,11-去氢泽兰酮的透皮释放率作为考察指标,筛选出最佳配方比例。

表1 因素水平表Table1 Factor level table
1.5 透皮释放试验
参考金伟等[13]的方法。将透析袋剪成小段,在2%碳酸氢钠和1 mmol/L EDTA混合液(体积比1∶1,pH=8)中煮沸10 min,用蒸馏水彻底洗净,并将其剪成单层,放入1 mmol/L的EDTA(pH=8)中煮沸10 min。冷却后,存放于4℃冰箱中。将处理好的透析膜固定于改良的Franz扩散池上,加入制备好的喷剂,接收池内加入生理盐水作为扩散介质。透皮试验装置设置为恒温37℃[14]、转速200 r/min,分别于2、4、8、12、24 h 取样 3 mL,同时补足同等温度的生理盐水。将取出的接收液保存,并用HPLC法测定其中9-羰基-10,11-去氢泽兰酮的浓度。根据公式Q=(VCn+∑ViCi)/A,24 h 内累积透过率=(Q24×A/样品总量)×100%。其中Q为第n次取样时的累积透皮释放量,V为接受池的体积(mL),Cn为第n次取样点的浓度(μg/mL),Vi为第 i次取样的体积(mL),Ci为第i次取样点的浓度(μg/mL),A为扩散释放面积(cm2)。
1.6 紫茎泽兰杀螨喷剂的临床杀螨效果评价
30只疥螨感染情况相近的新西兰白兔,体重(2.35±0.13)kg,公母各半,随机分为 5组,即空白对照组Ⅰ(蒸馏水)、阳性对照组Ⅱ(伊维菌素)以及高中低剂量组(Ⅲ、Ⅳ、Ⅴ:8 mg/mL、4 mg/mL、2 mg/mL),每组6只,分笼饲养,自由采食,饮水。阳性对照组每周肌肉注射1次,持续两周;空白对照与试验组每两天对患病部位喷洒药液1次,用药两周。每周对其临床症状进行评分,症状评分表见表2。同时每周对每只兔子进行体重、呼吸、心率以及体温等进行测定。并对精神状态,粪便进行观察,为期4周。

表2 症状评分表Table2 Symptom score
1.7 数据分析
将所得的数据用SPSS 20.0软件进行统计分析,各组数据间采用单因素(One-Way ANOVA)分析,以P<0.05作为差异显著性标准,试验所测得数据用平均值±标准差表示。
2 结果与分析
2.1 正交设计结果
由表3、表4 可知,RA>RC>RB,即聚山梨酯-80的用量对透皮结果影响效果最大,乙醇的用量次之,最后是月桂氮酮的用量。由表4可知聚山梨酯-80对透皮结果的影响具有统计学意义(P<0.05),其他因素则无显著影响,说明聚山梨酯-80是关键因素。综合预试验以及从节约成本考虑,最终确定最佳处方为 A2B2C1,即 3%的聚山梨酯-80(V/V)、2%的月桂氮酮(V/V)、20%的乙醇(V/V)。

表3 正交试验结果Table3 The results of orthogonal test
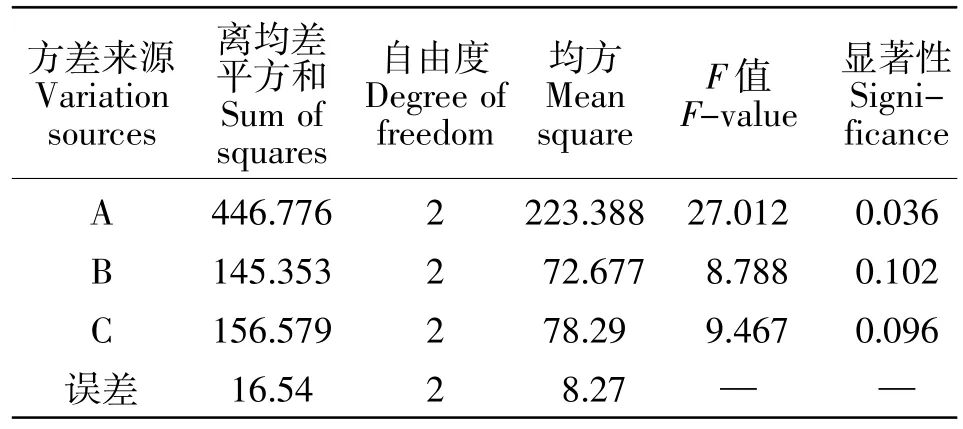
表4 方差分析表Table4 ANOVA table
2.2 临床效果评价
2.2.1 评分变化
由表5可知,试验期间,Ⅰ组的症状基本没有好转,随着时间的迁移,评分愈加严重,第28天对照组新西兰白兔症状达到最严重的状态。Ⅱ组在第7天开始,症状明显减退,评分与Ⅰ组差异显著(P<0.05),自第14天起,症状几乎消失,评分接近为0;Ⅲ~V 组在第 7天开始,症状显著降低(P<0.05),第21天各紫茎泽兰喷剂组症状评分已几乎为0。
2.2.2 体重变化
由表6可知,Ⅱ组新西兰白兔体重随时间的延长而逐渐增长,维持正常生长发育,整个试验期间平均增重0.37 kg;Ⅰ组新西兰白兔体重随时间的延长而逐渐降低,并在第21天显著低于Ⅱ组平均体重(P<0.05),整个试验期间呈负增重(-0.34±0.13)kg;Ⅲ组新西兰白兔体重整体变化趋势为先降低后增加,自第21天起,Ⅲ组新西兰白兔体重出现缓慢增加的现象,整个试验期间平均增重0.07 kg;Ⅳ组以及Ⅴ组新西兰白兔体重整体变化趋势为缓慢增加,与Ⅱ组相比无差异性(P>0.05),最终平均增重分别为 0.38 kg和 0.32 kg。

表5 用药后症状评分Table5 Symptom score after treatment
2.2.3 呼吸频率变化
由表7可知,试验期间,Ⅱ组新西兰白兔呼吸频率基本维持在正常范围。与Ⅱ组相比,Ⅰ组新西兰白兔呼吸频率在第21天出现降低的趋势(P<0.1),在第28天,呼吸频率显著降低(P<0.05);与Ⅱ组相比,除了Ⅴ组在第21天呼吸频率有增加的趋势(P<0.1)外,Ⅲ组、Ⅳ组以及Ⅴ组新西兰白兔呼吸频率均不存在显著性差异,维持在正常范围内。
2.2.4 心率变化
由表8可知,与其他各组相比,Ⅰ组新西兰白兔心率在第28天出现显著升高(P<0.05)。Ⅱ组与试验组新西兰白兔心率基本维持在正常范围,无变化。
2.2.5 体温变化
由表9可知,试验期间,Ⅱ组与试验组新西兰白兔体温无显著性变化,均在正常范围内;Ⅰ组新西兰白兔体温在第21天出现升高趋势(P<0.1),并于第28天出现显著性差异(P<0.05)。
2.2.6 精神状态以及粪便变化
试验期间,所有新西兰白兔的粪便皆为成型颗粒状,无任何坨状与糊状等不规则状态。试验初期,所有患病新西兰白兔除身上有瘙痒,不时抓挠自己外,精神状态饱满,无异常。第14天开始,Ⅰ组出现精神不振,食欲减退现象,身上瘙痒加剧,而Ⅱ组与试验组瘙痒明显减轻,且精神状态依旧正常。从第21天开始起,Ⅰ组出现伏地不愿走动现象,而Ⅱ组与试验组症状精神饱满,瘙痒症状消失。
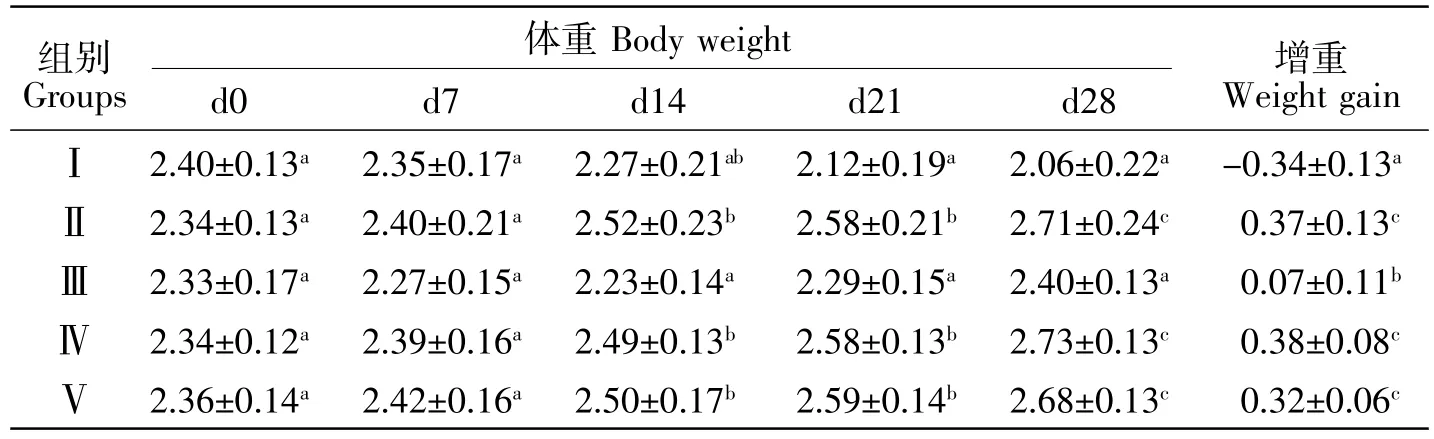
表6 用药前后体重变化Table6 Weight changes after treatment kg

表7 用药后呼吸频率变化Table7 Changes of respiratory amplitude after treatmenttimes·min-1

表8 用药后心率变化Table8 Changes of heart rate after treatment times·min-1
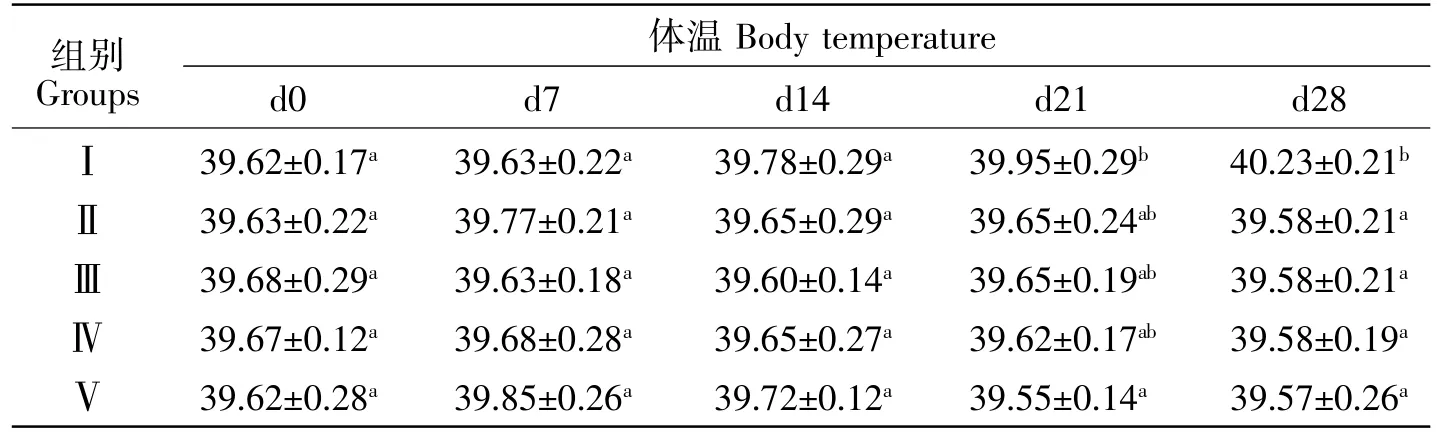
表9 用药后体温变化Table9 Temperature changes after treatment℃
3 讨论
喷雾剂直接作用于患病部位,药物吸收快,吸收率高,药效迅速。较内服给药或者注射用药更加有效且安全,可避免药物对胃肠道的不良刺激,同时也能避免肝、胃、肠道对于药物的代谢降解作用,对机体的伤害更小。对于皮肤性疾患,喷雾剂是首要的给药方式。
透皮释放试验中选择透析膜而非常见的离体鼠皮,主要是考虑到鼠皮制作中存在杂质排除不干净且制作不统一的因素,以及离体鼠皮长时间与接收液接触后,其皮肤中的蛋白质会出现脱落溶解等现象,这会导致接受液浑浊并干扰含量测定,而喷剂中主要活性成分含量较低,因此本试验选择规格统一的透析膜[15]。这与实验结果中仅聚山梨酯-80的用量对透皮吸收结果影响显著或许有关系。
在第14天之前,Ⅲ组的体重呈现下降趋势,并自第14天开始与Ⅱ组呈现显著差异,可能是Ⅲ组浓度偏高,在杀灭螨虫的同时,过多的药物残留对动物产生了不利影响,阻止了新西兰白兔体重的增加,这可能与第21天Ⅲ组依然表现出轻微症状有关。第21天开始,Ⅲ组体重呈现升高趋势,说明Ⅲ组患病新西兰白兔正逐渐恢复健康。然而尚不明确Ⅲ组高浓度紫茎泽兰喷剂是否引起新西兰白兔中毒,下一步有必要进行紫茎泽兰杀螨喷剂的毒性试验研究。Ⅴ组的患病新西兰白兔的呼吸频率在第21天出现加快的趋势,同时有体温降低的趋势,或许这与剂量偏低有关系。陈伟红等[16]研究发现,山羊食用不同剂量的紫茎泽兰,在精神状态,粪便以及体重与体温等方面会出现显著变化,而本试验中试验组新西兰白兔未出现以上报道现象,可能与给药途径、浓度与试验时间不同有关。
研究表明疥螨病能够造成家兔体重下降[17],这与本试验结果相符。Nong X.等[18]研究表明,0.5 g/mL的紫茎泽兰乙醇提取物对兔疥螨与兔痒螨具有明显的控制作用,本试验中紫茎泽兰杀螨喷剂的主要提取物浓度远低于此浓度,同样达到了显著的临床杀螨效果,原因在于本试验用药频次更高,同时加入透皮剂能够更大效率提高活性物质的利用率。郭于瑜等[19]研究发现家兔食用紫茎泽兰,会导致慢性中毒,考虑到紫茎泽兰的毒副作用,试验建议临床用药浓度为4 mg/mL。He Y.J.等[20-21]研究表明紫茎泽兰对山羊具有肝肾毒性,本试验未涉及此内容,所以下一步有必要对于紫茎泽兰杀螨喷剂的肝肾毒性,以及临床应用的安全性作出系统评价。
紫茎泽兰作为入侵植物,其在防治方面的研究进展并不太顺利,目前越来越多的转向紫茎泽兰的利用方向开始研究[22-25]。我国自古就有开发有毒植物药用价值的传统,如利用砒霜、蛇毒以及雷公藤等。紫茎泽兰被视为有毒植物[26],同样研究证明其具有显著的杀螨作用。本试验依照此事实依据,将紫茎泽兰提取物制备成了杀螨喷剂,为紫茎泽兰的利用提供了新的思路。此方法仅在新西兰白兔身上做出初步尝试,效果显著,但要应用于宠物行业市场,还需要多次的临床试验。此方法为紫茎泽兰杀螨喷剂的工业化生产提供了试验依据,同时可为植物源喷剂的研究提供一定的可行性参考。
4 结论
紫茎泽兰杀螨喷剂最佳配方为:紫茎泽兰甲醇提取物4 mg/mL、3%聚山梨酯-80、2%月桂氮酮、20%乙醇。该配方临床杀螨效果显著,可以作为紫茎泽兰开发利用的重要途径之一。
