烟草ERF基因NtRAP2-7的表达载体构建及表达模式分析
2018-09-04杨尚谕鲁黎明李立芹
陈 倩,卓 维,罗 静,杨尚谕,鲁黎明,李立芹
(1.四川农业大学 农学院,四川 成都 611130;2.作物科学国家级实验教学示范中心,四川 成都 611130)
乙烯响应因子(ERF,ethylene response factor)基因是广泛存在于植物中的一类 AP2/ERF超家族基因。AP2/ERF基因编码在植物生长和发育中具有多种功能的转录调节因子,并且响应生物和非生物胁迫。该类转录因子在激活或抑制防御反应基因的过程中也起着关键的信号转导作用,例如当植物面临干旱或高盐胁迫时[1]。在植物中AP2/ERF转录因子超家族含有转录因子的种类最多,但它们全部包含至少一个由60~70个保守氨基酸残基构成的APETALA2(AP2)结构域。每个结构域均主要由YRG和RADY元件构成,其中YRG元件通常由19~22个保守的氨基酸组成,RADY元件则通常包含33~43个氨基酸[2]。
AP2/ERF超家族根据AP2结构域的数量分为4个亚家族,具体包括AP2(APETALA 2)、ERF(Ethylene-responsive element binding factors)、DREB(de-hydration-responsive element binding protein)和RAV(related to ABI3/VP1)[3]。其中,AP2家族包含2个AP2/ERF结构域,在调节植物生长发育方面有着重要作用[4];ERF和DREB家族只含有一个典型的AP2/ERF保守结构域,主要功能是调节植物对激素(乙烯和ABA等)、病原和胁迫(低温、干旱及高盐)等的应答反应;而RAV家族除了包含一个AP2/ERF结构域,还含有一个B3结构域,主要功能为调节植物的生长发育,并对环境胁迫做出响应[5-6]。
近年来,ERF转录因子作为调节乙烯信号通路的关键蛋白得到了广泛的关注[7]。ERF亚族转录因子可以特异性地识别并结合下游基因启动子区域的GCC-box,以调控下游功能基因的表达,具体表现为转录激活或转录抑制,从而提高植物抗逆性[8]。ERF转录因子通过结合不同的顺式作用元件,来参与不同类型的非生物胁迫应答,如干旱胁迫、NaCl胁迫以及低温胁迫等逆境应答反应,并在植物的生长发育和信号转导中起到了重要作用[9]。已有报道表明,在水稻中过表达番茄ERF基因TSRF1,能提高ABA生物合成相关基因SDR的表达,从而增加转基因水稻体内的ABA含量,同时提高了转基因水稻的干旱胁迫耐受性[10]。在拟南芥中过表达AtERF1 能够提高转基因植株对干旱、盐和高温胁迫的耐受性[11]。并另有研究发现,拟南芥ERF基因能通过参与ROS信号通路,维持H2O2的平衡及响应非生物胁迫[12]。
在拟南芥中,总共65个ERF基因已被成功鉴定[13]。在杨树中,共鉴定了ERF亚家族中的91个成员[14]。随着更广泛的基因组序列研究, ERF家族已经在各种植物如葡萄[15]、黄瓜[16]、番茄[17]、高粱[18]、白菜[19]中被分离和鉴定。然而,目前关于烟草ERF基因的鉴定和研究较少。
本研究根据同源克隆的方法,从普通烟草K326中克隆到1个ERF基因NtRAP2-7,并运用生物信息学方法,对该基因编码蛋白的结构和功能进行预测,同时,运用qRT-PCR技术,分析其在烟草各组织中的表达水平以及在低钾、高盐、干旱、ABA、H2O2和低温胁迫下基因的表达模式,旨在为研究NtRAP2-7基因在烟草抗性机制中的功能奠定基础。
1 材料和方法
1.1 试验材料及试剂
供试烟草品种为普通烟草品种 K326。采用漂浮育苗的方法进行育种,生长60 d后,分别对烟株的根、茎、叶进行取样。待其生长至盛花期,再对花进行取样。所有采集的样品均需在液氮中速冻1 min后,放置-80 ℃冰箱中以供后续使用。
将烟草品种K326种子进行表面消毒,均匀地播种到MS培养基上,15 d后进行胁迫处理。低钾、高盐、干旱、ABA、H2O2处理是挑选生长状况一致的幼苗,分别移到相应培养基上。低钾培养基是用NH4H2PO4和NH4NO3来替代MS培养基中原有的KH2PO4以及KNO3,其余成分相同,此时培养基中的K+浓度约为10 μmol/L。高盐、干旱、ABA处理培养基是在MS培养基的基础上,加入相应成分,使培养基分别含有NaCl(200 mmol/L)、PEG6000(5%)、ABA(1 μmol/L)、H2O2(10 mmol/L)。低温处理是将15 d龄的幼苗置于 4 ℃光照培养箱中。上述处理,均在处理时间为0,3,6,12,24 h对烟草幼苗进行整株取样。
TRIzol试剂、高保真酶、限制性内切酶、PrimeScript RT reagent Kit、SYBR Green Master mix等试剂购自宝生物工程(大连)有限公司,cDNA合成试剂盒购于赛默飞世尔科技公司,通用型DNA纯化回收试剂盒购自天根生化科技(北京)有限公司,DH5α大肠杆菌菌株购于南京诺唯赞生物科技有限公司,由上海生工生物工程有限公司完成引物合成与测序。
1.2 试验方法
1.2.1 烟草NtRAP2-7基因的克隆及过表达载体构建 参考GenBank收录的林烟草ERF序列(XP_009772737.1),根据同源物种的保守区域,利用Primer 5.0软件设计引物NtRAP2-7-F:5′-TCTAGAATGTTGGATCTGAATGTATC-3′(划线部分为XbaⅠ酶切位点)和NtRAP2-7-R:5′-CCCGGGTTAACTAATGTTAAGGGTGA-3′(划线部分为SmaⅠ酶切位点)。具体方法按文献[20]进行,对目的基因进行克隆。
PCR扩增目的片段经纯化后与过表达载体pBI121用XbaⅠ和SmaⅠ进行双酶切,在16 ℃下连接过夜,将连接产物通过热激法转入大肠杆菌DH5α感受态,随后在含有卡那霉素的LB平板上进行抗性筛选,挑取阳性单克隆,提取质粒进行双酶切验证,并将酶切产物送至上海生工生物工程有限公司进行测序。
1.2.2 烟草NtRAP2-7基因生物信息学分析 利用网站上ExPASy ProtParam在线工具,分析NtRAP2-7基因编码蛋白的理化性质;运用DNAMAN软件进行蛋白同源性比对以及疏水性分析;应用IBCP的在线工具SOPMA,对NtRAP2-7的二级结构进行预测;SWISS-MODEL在线预测NtRAP2-7的三级结构特性,预测结果在Ras Top软件中查看;利用Prot Fun 2.2 Server软件对蛋白功能进行预测;利用NLS Mapper软件在线预测该基因的核定位信号;应用在线程序PSORT预测NtRAP2-7的亚细胞定位;运用MEGA 5软件,采用邻近法模式构建系统进化树,具体参数设置见参考文献[21]。
1.2.3 烟草NtRAP2-7基因的表达分析 根据NtRAP2-7基因序列,设计qRT-PCR引物NtRAP2-7-qF:5′-TCTTGAGCCAAAGCATCTA-3′和NtRAP2-7-qR:5′-GTCGTGGAAACACTTGAACC-3′,采用烟草组成型表达基因18SrRNA作为内参,以烟草不同组织和不同处理下的幼苗cDNA为模板,进行基因表达模式分析,引物序列参照文献[22]。PCR扩增程序:50 ℃反应2 min,95 ℃预变性3 min;95 ℃变性10 s,65 ℃延伸45 s,共39次循环。所有的样品均设置3次生物学重复,用2-ΔΔCt方法计算目的基因的相对表达水平,运用Excel 2013进行统计学分析。
2 结果与分析
2.1 NtRAP2-7基因的克隆及过表达载体的构建
以烟草总RNA反转录合成的cDNA为模板进行PCR扩增,琼脂糖凝胶电泳结果显示,在1 500 bp左右的位置上有清晰明亮的条带(图1-A),经测序结果显示,该目的片段长度为1 398 bp,与预期的目的片段大小相符。
将PCR扩增产物纯化后和pBI121载体分别进行双酶切,将连接产物通过热激法转入大肠杆菌DH5α感受态。挑取阳性克隆,对连接产物进行酶切验证,结果显示,在1 500 bp左右的位置上有清晰的条带(图1-B)。将酶切成功的单菌落质粒,送至上海生工生物工程有限公司进行测序,测序结果显示,目的片段大小为1 398 bp,表明pBI121-NtRAP2-7过表达载体构建成功。
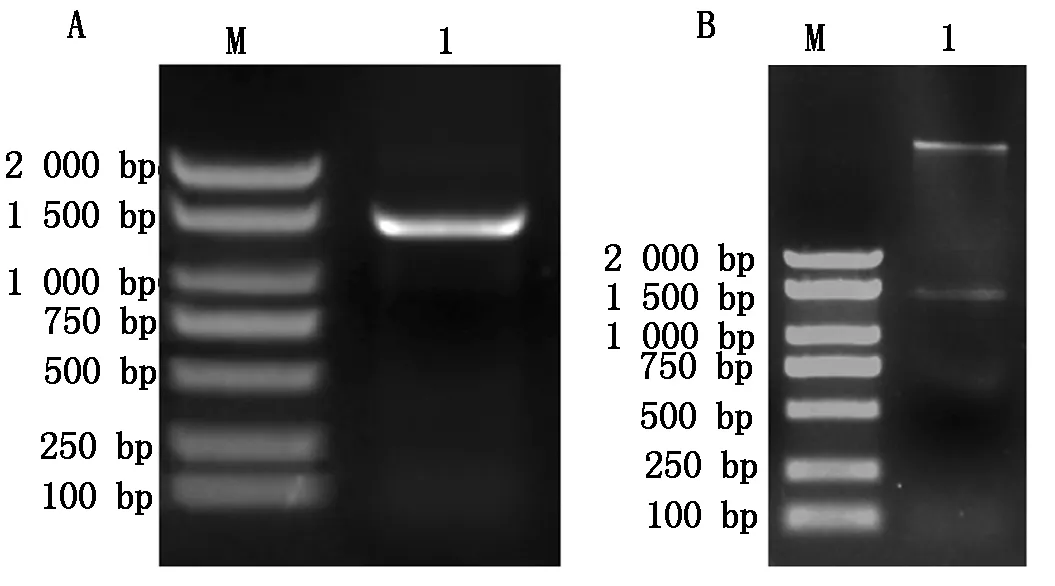
A.NtRAP2-7基因PCR产物电泳图;B.NtRAP2-7基因酶切电泳图;1.NtRAP2-7基因;M.Marker。A.NtRAP2-7 PCR product electrophoresis;B.NtRAP2-7 gene digested electrophoresis;1.NtRAP2-7 gene;M.Marker.
2.2 目的基因的生物信息学分析
2.2.1NtRAP2-7编码蛋白的理化性质及疏水性预测分析 运用ExPASy ProtParamtool软件,对目的蛋白的理化性质进行在线分析。结果显示,NtRAP2-7蛋白由20种氨基酸组成,共包含465个氨基酸残基,其中,Ser数量最多,为10.8%,而Cys数量最少,为1.1%;该蛋白的分子式为C2229H3479N651O707S14,预测分子量为51.16 ku;等电点PI为8.16,属碱性蛋白。带负电荷的氨基酸残基(Asp+Glu)数为50个,带正电荷的氨基酸残基(Arg+Lys)数为52个,NtRAP2-7的脂肪系数为63.78,总的疏水性平均系数为-0.628。运用DNAMAN软件对NtRAP2-7蛋白进行疏水性/亲水性预测分析,结果如图2所示,与之前疏水系数预测结果相一致,平均疏水系数小于0,可以预测该蛋白是亲水性蛋白。
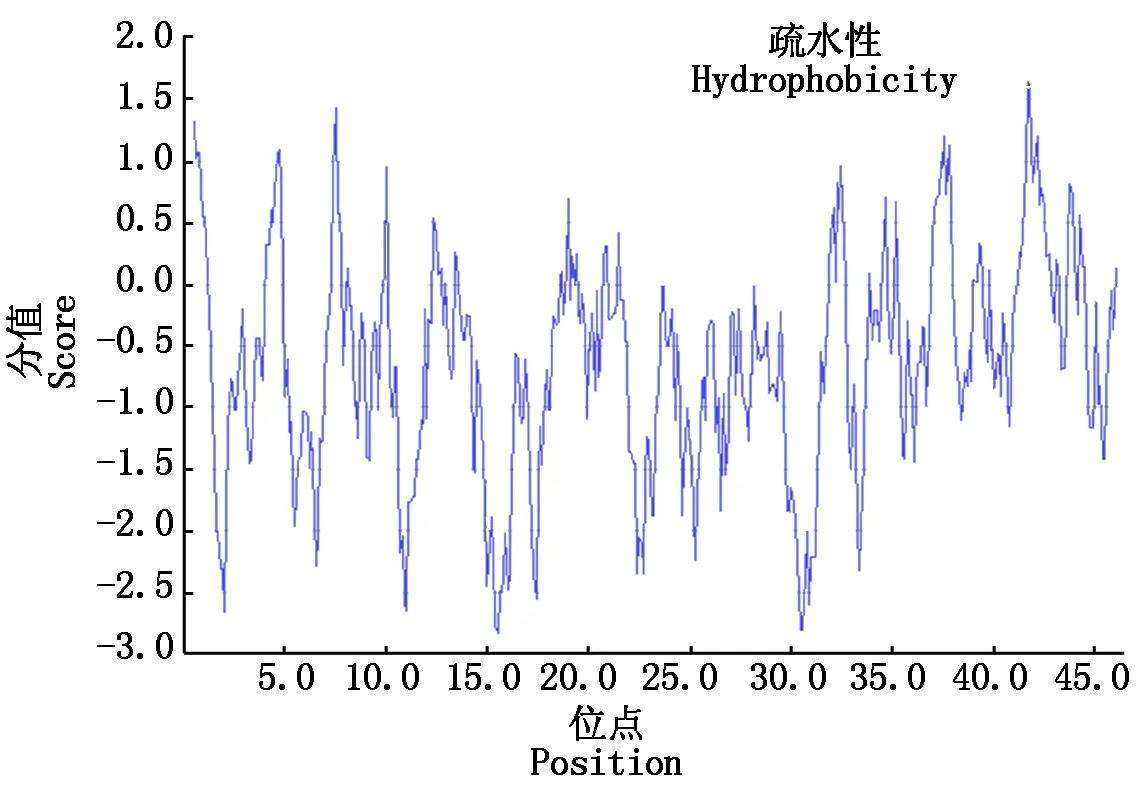
图2 NtRAP2-7蛋白疏水性预测Fig.2 The hydrophobicity and transmembraneprediction of NtRAP2-7
2.2.2 NtRAP2-7蛋白的亚细胞定位、核定位信号及磷酸化位点分析 通过在线PSORT工具,对NtRAP2-7蛋白的亚细胞定位进行预测。结果显示,定位在细胞核中的概率为65.2%,在细胞质中的概率为21.7%,分别有4.3%的概率定位于细胞骨架、线粒体及过氧化物酶体。表明NtRAP2-7定位于细胞核的可能性最大。所以,利用NLS Mapper软件在线预测该基因的核定位信号,在第60~71个氨基酸有单分型的NLS序列VHHGSKRAHHS,初步说明该蛋白是核蛋白。利用NetPhos 3.1 Server在线工具对NtRAP2-7蛋白中存在的Ser、Thr和Tyr残基的磷酸化位点进行预测分析,结果显示(图3),NtRAP2-7中包含58个磷酸化位点(37个Ser磷酸化位点、18个Thr磷酸化位点和3个Tyr磷酸化位点)。表明蛋白激酶可能使该蛋白的这些氨基酸位点磷酸化,从而参与一系列生理生化过程的调控。

图3 NtRAP2-7中的磷酸化位点分析Fig.3 Predicted phosphorylation site in NtRAP2-7
2.2.3 NtRAP2-7蛋白结构及生物功能预测分析 运用IBCP的在线工具SOPMA,对NtRAP2-7蛋白二级结构进行预测,结果表明(图4-A):该蛋白分别含有无规则卷曲51.61%,延伸链23.23%,α-螺旋17.85%,β-折叠所占比例最低,为7.31%。由此推测,无规则卷曲、延伸链以及α-螺旋是构成NtRAP2-7蛋白的主要结构,β-折叠含量较少。
利用SWISS-MODEL和RasTop在线软件对NtRAP2-7的三级结构进行预测,结果显示(图4-B),NtRAP2-7蛋白包含1个α-螺旋及3个β-折叠的保守结构。利用ProtFun 2.2 Server软件对ERF蛋白的功能进行预测,结果表明(表1),NtRAP2-7蛋白具有生物合成的辅因子功能的可能性为2.917、转运结合的可能性为1.885、行使翻译功能的可能性为1.614。其中,在生物合成中行使辅因子功能的可能性最大。

A.NtRAP2-7蛋白二级结构预测;B.NtRAP2-7蛋白三维结构预测。A.NtRAP2-7 protein secondary structure prediction;B.NtRAP2-7 protein three-dimensional structure prediction.
2.2.4 NtRAP2-7同源性分析及保守结构域分析 将NtRAP2-7氨基酸序列与其他植物中RAP2-7蛋白序列进行同源性进化分析,结果表明(图5-A),NtRAP2-7与林烟草RAP2-7、野生烟草RAP2-7、绒毛状烟草RAP2-7等氨基酸序列同源性较高,分别为98%,96%,94%,与葡萄RAP2-7的同源性最低,为54%。由图5可知,烟草与马铃薯、番茄等聚成一类,而葡萄等单独一组,NtRAP2-7与茄科植物的亲缘关系较近且进化同步,表明该基因在物种进化中可能较为保守。通过多重序列比对及保守结构域分析,结果显示(图5-B),NtRAP2-7蛋白序列中包含一段典型的AP2/ERF结构域,并含有保守的YRG元件和RAYD元件。
2.3 NtRAP2-7的组织表达分析
通过qRT-PCR技术,研究该基因在烟草K326品种不同组织中的表达情况。结果显示(图6),NtRAP2-7的表达量大小依次为根>茎>叶>花,在根中的表达量为花中表达量的23.85倍,为叶中表达量的6.36倍,为茎中表达量的2.02倍。结果表明,NtRAP2-7基因在叶和花中的表达差异不显著(P>0.05),但在烟草其他组织中的表达具有显著差异(P<0.05),推测该基因主要在根中起调控作用。

表1 NtRAP2-7蛋白功能预测Tab.1 The function prediction of NtRAP2-7
2.4 逆境胁迫下NtRAP2-7的表达分析
采用qRT-PCR对NtRAP2-7在低钾(10 μmol/LK+)、5%PEG、ABA(1 μmol/L)、NaCl(200 mmol/L)、H2O2(10 mmol/L)及低温(4 ℃)处理下的表达动态进行实时检测。该基因在高盐、5%PEG及低钾处理下,6 h表达量上升至最大,分别为对照(0 h)的1.23倍(图7-A)、8.36倍(图7-B)和7.37倍(图7-C)。在ABA和H2O2处理下,都是24 h时表达量达到最大,分别为对照(0 h)的1.49倍(图7-D)和11.42倍(图7-E)。NtRAP2-7在低温处理下表达受到抑制,在处理24 h时表达量降至最低(图7-F)。结果表明,该基因的表达水平在低钾、PEG、ABA、NaCl、H2O2处理下受到显著诱导(P<0.05),在低温处理下受到显著抑制(P<0.05)。

图7 非生物逆境胁迫下NtRAP2-7的表达分析Fig.7 Expression of NtRAP 2-7 under abiotic stress
3 讨论与结论
植物的非生物胁迫应答是一个复杂的过程,往往需要多个功能基因共同参与。而功能基因的表达受到转录因子的调控,一个转录因子可以同时调节几个功能基因,在抗逆反应过程中具有重要作用。国内外学者对ERF转录因子家族鉴定及功能方面开展了较多的研究,发现其主要参与植物生长发育、生物和非生物胁迫等过程[23],但在烟草中该基因的研究较少。基于二级结构和三级结构的分析发现,NtRAP2-7蛋白包含1个α-螺旋及3个β-折叠结构。这在大豆ERF蛋白的研究中也有相同发现[24],这对于DNA序列识别和结合是非常重要的[25]。亚细胞定位分析发现,NtRAP2-7转录因子主要定位于细胞核,这在马铃薯和拟南芥中也有相同发现[26-27]。基于进化树分析结果表明,NtRAP2-7与烟草RAP2-7成员关系较近,与7个茄科RAP2-7转录因子聚为一类,这说明RAP2-7转录因子在茄科植物的进化中比较保守。
组织表达分析结果表明,NtRAP2-7基因在选取的各个组织中均有表达,但各组织间的表达水平不同,在根中表达量最高,茎和叶次之,在花中的表达量最低。茄子中有7个ERF基因的组织表达情况与之相似[28]。推测在烟草生长过程中,根和叶是最重要的用于营养吸收和光合作用的器官,NtRAP2-7基因的高表达可能有助于植物快速的营养生长以及响应环境胁迫。
qRT-PCR分析结果表明,在各种非生物逆境胁迫下,NtRAP2-7基因相对表达水平均出现显著变化,表明该基因的表达受各种非生物胁迫因子的影响,推测NtRAP2-7基因可能参与植物各种非生物逆境胁迫的应答反应。在200 mmol/LNaCl和5% PEG处理6 h,该基因的表达受到显著诱导,这与大豆ERF基因在高盐和PEG胁迫处理后,表达受到显著诱导的情况相似[29]。也有研究表明,华北驼绒藜ERF基因在盐和干旱胁迫条件下发挥正调控的作用[30]。在1 μmol/L ABA处理下,该基因的表达在24 h时显著升高,这与麻风树和拟南芥ERF基因在ABA处理后的表达模式相同[31-32]。在4 ℃处理的24 h内的各时间点,NtRAP2-7基因的表达受到抑制,这在大豆ERF基因的研究中也有类似发现[33],由此推测,NtRAP2-7基因对某些低温胁迫基因的表达起负调控作用。这与在拟南芥中的研究不同,在低温胁迫后1 h,4个拟南芥ERF基因的表达水平均受到显著诱导,随后降低,24 h降至初始水平以下[34]。这可能是由于取材时间点不同所造成的。以上研究为进一步探索NtRAP2-7转录因子基因的功能及机制提供了重要的依据。
根据同源物种基因的保守性,参考林烟草RAP2-7序列设计引物,从普通烟草K326中克隆到1个ERF蛋白基因NtRAP2-7,序列长度为1 398 bp。生物信息学研究表明,NtRAP2-7为碱性亲水性蛋白,主要定位于细胞核。含有一个典型的AP2/ERF蛋白结构域,且具有多个Ser、Thr和Tyr磷酸化位点。qPT-PCR分析结果表明,NtRAP2-7基因在烟草根、茎、叶、花中均有表达,但在根中表达量最高。NtRAP2-7基因在不同时间点的表达,分别受到低钾、PEG、ABA、NaCl、H2O2及低温胁迫的显著诱导或抑制,表明NtRAP2-7基因可能在植物多种非生物胁迫应答中行使功能。
