脑电双频指数辅助监测的静脉镇静用于胃食管反流病射频治疗的研究*
2018-08-31初阳张灏李冠华隋波卢燕
初阳,张灏,李冠华,隋波,卢燕
(北京市西城区火箭军总医院 1.麻醉科;2.神经内科,北京 100088)
内镜下射频治疗对于缓解胃食管反流病(gastroesophageal reflux disease,GERD)患者症状、减少服药等具有较好疗效[1]。治疗时需将射频电极针刺入到多个平面的食管肌层内,并予以高温(80~90℃)烧灼,治疗时间长,疼痛刺激明显,常出现呛咳、体动等不良反应,并可诱发迷走神经反射,需要在深度镇静或全身麻醉下进行[2-3]。但镇静过度又可能导致呼吸循环抑制、延缓患者苏醒等并发症[4]。因此,保持合理深度的镇静十分必要[5-6]。
脑电双频指数(bispectral index,BIS)通过采集患者大脑额叶脑电图表现并加以量化,能一定程度上客观反映患者的麻醉和镇静深度,被广泛用于麻醉深度监测和重症患者镇静[7]。相较于听觉诱发电位指数(auditory evoked potential,AEP)监测意识的有无,BIS能够反应意识状态的变化过程,应用于内镜检查能够减少不必要的干预,并保证足够的镇静深度,具有较好的临床指导价值[8-9]。在持续时间较长的内镜操作,如经内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)[8]、内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)[9]等,BIS辅助的镇静监测被发现可减少镇静药物用量或促进患者苏醒,但目前尚无内镜下射频治疗的相关研究。本课题拟观察BIS监测辅助的丙泊酚平衡镇静,在GERD内镜射频治疗应用中的有效性。
1 资料与方法
1.1 一般资料
本研究已获本院伦理委员会批准,所有患者均签署了知情同意书。研究对象为2017年3月-2017年9月因GERD拟行射频治疗的患者,纳入标准如下:GERD诊断明确,既往未行射频治疗或手术治疗;年龄20~60岁;美国麻醉医师协会分级(American Society of Anesthesiologists,ASA)Ⅰ或Ⅱ级;体重45~80 kg;无心肺功能异常、无肝肾功能不全和无精神病史等。排除标准:既往接受食管或胃部手术者;拟接受射频治疗合并其他内镜下治疗者;哮喘发作急性期者;心律失常患者;丙泊酚、舒芬太尼或右美托咪定过敏者;BIS电极黏胶过敏者;精神分裂症、痴呆和认知损害患者。
1.2 样本量估算
本研究主要观察指标为患者治疗过程中体动反应发生率。根据此前观察,常规监测过程中体动反应的发生率约为40%[5]。本研究假设BIS辅助的镇静监测60%的体动反应,即BIS辅助组体动反应发生率为16%。失访率设定为0%,α=0.05(单侧),β=0.2。按上述指标估计,每组需要样本42例,本研究每组纳入45例患者,共90例患者。
1.3 分组
采用随机数字表法分组,将90例患者等分入常规镇静(control)组和BIS辅助镇静(BIS)组。两组患者术中均进行BIS监测,但仅BIS组参照BIS值进行镇静。两组患者不知晓分组情况。所有90例患者都完成了射频治疗。两组患者在性别、年龄、体重、肥胖患者比例、ASA分级和GERD病程方面差异无统计学意义(P>0.05),具有可比性。见表1。
1.4 干预
两组患者入室后均开放外周静脉通路;有创血压、心电图和血氧饱和度(oxygen saturation,SpO2)监测,并乳酸林格氏液6 ml/kg静滴。分别给予地塞米松5.0 mg和昂丹司琼4.0 mg预防恶心呕吐、东莨菪碱0.3 mg减少分泌物、咪达唑仑0.02 mg/kg镇静、舒芬太尼5μg镇痛、均为静脉推注。患者取左侧卧、轻微头高脚低位,鼻导管吸氧4 L/min。
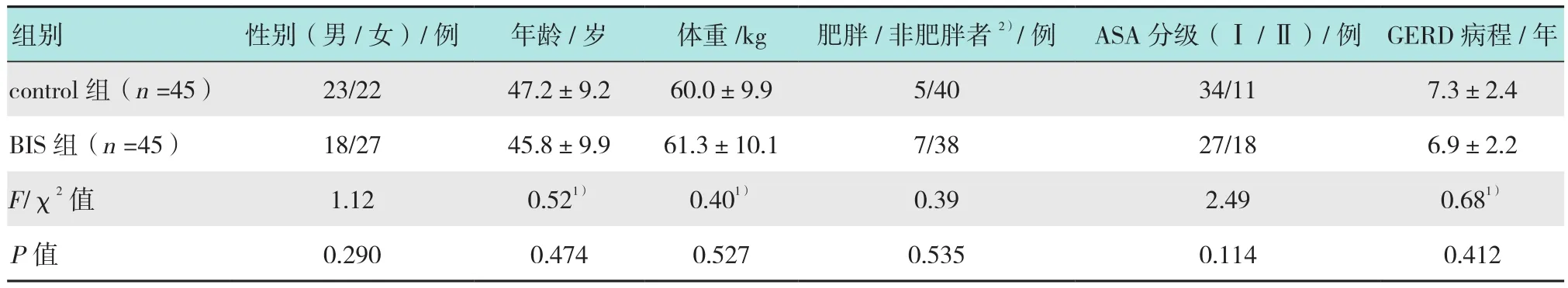
表1 两组患者一般情况的比较Table 1 Comparison of general information between the two groups
镇静诱导前,两组患者均预先静脉泵注浓度为4μg/ml的右美托咪啶0.2μg/kg,泵注时间至少持续5 min,诱导开始给予舒芬太尼0.1μg/kg,以后30 min追加舒芬太尼0.1μg/kg。两组均采用丙泊酚镇静。
control组根据常规镇静监测流程给予丙泊酚,镇静深度采用改良的警觉/镇静评分(modified observer’s assessment of alertness/sedation,MOAA/S)评定,标准如下:5分指对正常声音呼名反应迅速;4分指对正常声音呼名反应迟钝;3分指仅在大声和/或反复呼唤后有反应;2分指仅对轻度的推摇肩膀或头部有反应;1分指仅对挤压三角肌有反应;0分指对挤压三角肌无反应[10]。术中维持MOAA/S在0或1分,并且视患者有无体动反应、呼吸和血压变化补充追加药物,每次追加剂量不超过30.0 mg。
BIS辅助组除上述流程外,还实时根据BIS值调整丙泊酚用量,维持BIS值在55~70间。两组均采用心血管活性药物(阿托品、麻黄碱、艾司洛尔和尼卡地平)处理血压或心率(heart rate,HR)异常。其中术中需要处理的低血压定义为收缩压降低超过基础值30%或低于90 mmHg;高血压定义为收缩压升高超过基础值30%或大于160 mmHg。心动过缓定义为HR低于55次/min,HR>100次/min为心动过速。若上述药物治疗后无缓解或出现严重心律失常(频发室早、停搏或严重心动过缓<40次/min),则嘱手术者停止操作,直至恢复正常。以SpO2低于90%为缺氧,干预包括及时解除可能的气道梗阻,给予辅助或机械通气维持患者SpO2在90%以上。
1.5 观察指标
主要观察指标为射频治疗操作中体动反应和其他镇静相关不良事件(血压异常、HR节律异常、缺氧)的发生率;其他观察指标还包括血流动力学变化、心血管活性药物使用率、镇静深度(BIS和MOAA/S值)、丙泊酚用量、苏醒时间、并发症发生率、内镜医生和患者满意度。采集麻醉前(T0)、进镜即刻(T1)、射频时(T2)、复查进镜即刻(T3)、治疗结束时(T4)的 HR、SpO2、平均动脉压(mean arterial pressure,MAP)、BIS和MOAA/S值进行分析。苏醒时间为治疗结束至患者完全苏醒的时间(min)。患者、医生满意度采取1~10分的自评形式,1为非常不满意,10分为非常满意。医生满意度在射频治疗结束后即刻评定,患者满意度在患者完全苏醒后即刻评定。
1.6 统计学方法
采用SPSS 22.0统计软件进行统计分析,计量资料以均数±标准差(±s)表示,计数资料以发生数(率)表示。各时间点HR、SpO2、MAP、BIS及MOAA/S的比较以重复测量的方差分析联合事后Bonferroni检验进行分析,其余计量资料采用单因素方差分析。计数资料比较采用χ2检验。P<0.05(双侧)认为差异有统计学意义。
2 结果
2.1 两组术中不良反应发生情况的比较
在循环呼吸稳定性和不良事件方面,BIS组体动反应的发生率低于control组(7/45 vs 16/45,P=0.030),两组高血压、低血压、心动过速、心动过缓、心律失常以及低氧血症发生率差异均无统计学意义(P>0.05)。见表 2。
2.2 两组射频治疗、镇静及医患满意度情况
90例患者均无出血、穿孔等并发症,无静脉镇静改全麻插管病例。两组射频治疗时间(P=0.847)、麻醉时间(P=0.346)、苏醒时间(P=0.339)差异均无统计学意义。
丙泊酚用量(P=0.016)BIS组少于control组,两组患者满意度无差异(P=0.243),BIS组医生满意度高于control组(P=0.007)。见表3。
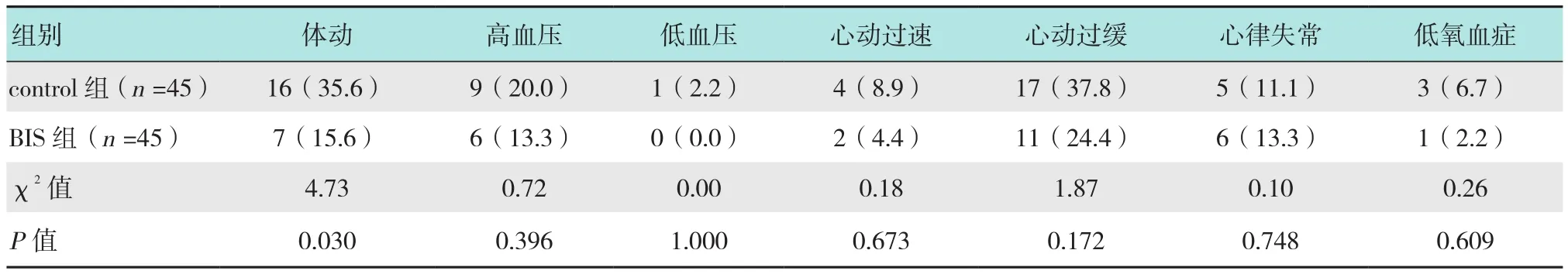
表2 两组术中不良反应发生情况的比较 例(%)Table 2 Comparison of incidences of intraprocedural adverse effects between the two groups n(%)
表3 两组镇静情况的比较 (±s)Table 3 Comparison of sedation profiles between the two groups (±s)
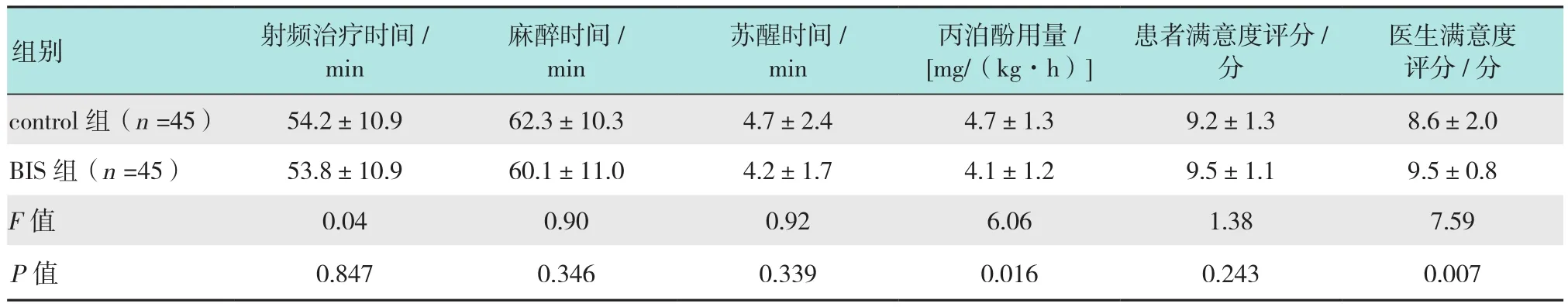
表3 两组镇静情况的比较 (±s)Table 3 Comparison of sedation profiles between the two groups (±s)
医生满意度评分/分control组(n=45) 54.2±10.9 62.3±10.3 4.7±2.4 4.7±1.3 9.2±1.3 8.6±2.0 BIS 组(n=45) 53.8±10.9 60.1±11.0 4.2±1.7 4.1±1.2 9.5±1.1 9.5±0.8 F值 0.04 0.90 0.92 6.06 1.38 7.59 P值 0.847 0.346 0.339 0.016 0.243 0.007组别 射频治疗时间/min麻醉时间/min苏醒时间/min丙泊酚用量/[mg/(kg·h)]患者满意度评分/分
2.3 两组镇静深度比较
重复测量的方差分析发现,BIS组的MOAA/S评分(F=5.84,P=0.018)和BIS值(F=37.17,P=0.000)均高于control组。事后Bonferroni检验发现,治疗结束时(T4)BIS组MOAA/S评分高于control组(P=0.000),其他时刻两组比较差异无统计学意义(P>0.05);进镜即刻(T1)、射频时(T2)、复查进镜即刻(T3)、治疗结束时(T4)BIS组BIS值均高于control组,两组比较差异有统计学意义(P<0.05)。见表4。
2.4 两组心血管药物使用情况的比较
血管活性药使用方面,如尼卡地平、麻黄碱、艾司洛尔和阿托品,两组比较差异无统计学意义(P>0.05)。见表 5。
2.5 两组患者不同时点HR、MAP和SpO2的比较
重复测量的方差分析发现,两组各时间的HR(F=0.12,P=0.370)、MAP(F=0.25,P=0.616)差异无统计学意义,BIS组 T1(P=0.028)、T2(P=0.021)时的SpO2高于control组,两组SpO2均在正常范围。见表6~8。
表4 两组不同时点MOAA/S评分和BIS值比较 (±s)Table 4 Comparison of MOAA/S and BIS profiles across different time points between the two groups (±s)
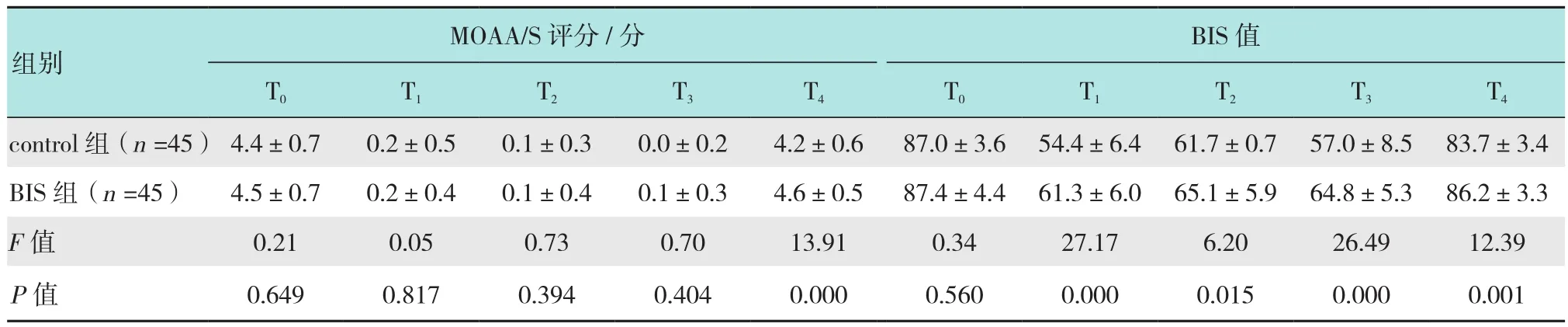
表4 两组不同时点MOAA/S评分和BIS值比较 (±s)Table 4 Comparison of MOAA/S and BIS profiles across different time points between the two groups (±s)
BIS值T0 T1 T2 T3 T4 T0 T1 T2 T3 T4 control组(n=45) 4.4±0.7 0.2±0.5 0.1±0.3 0.0±0.2 4.2±0.6 87.0±3.6 54.4±6.4 61.7±0.7 57.0±8.5 83.7±3.4 BIS 组(n=45) 4.5±0.7 0.2±0.4 0.1±0.4 0.1±0.3 4.6±0.5 87.4±4.4 61.3±6.0 65.1±5.9 64.8±5.3 86.2±3.3 F值 0.21 0.05 0.73 0.70 13.91 0.34 27.17 6.20 26.49 12.39 P值 0.649 0.817 0.394 0.404 0.000 0.560 0.000 0.015 0.000 0.001 MOAA/S评分/分组别
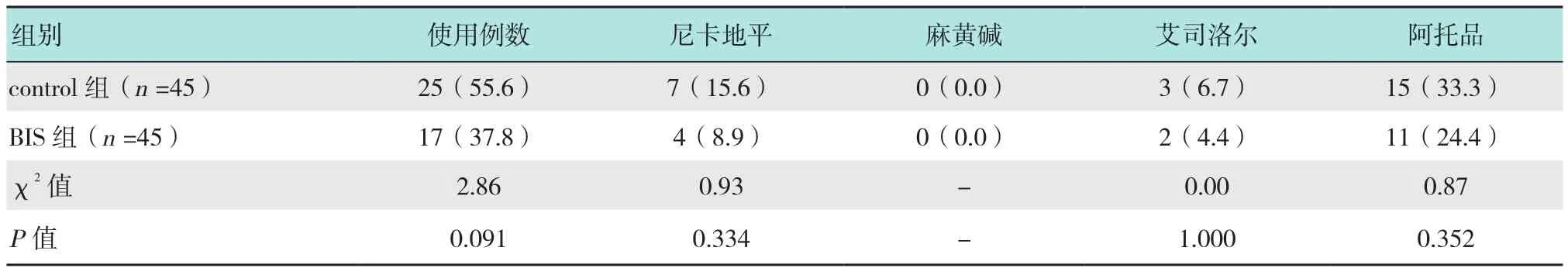
表5 两组心血管药物使用情况的比较 例(%)Table 5 Comparison of intraoperative use of vasoactives between the two groups n(%)
表6 两组患者不同时点HR的比较 (次/min,±s)Table 6 Comparison of HR profiles across different time points between the two groups (n/min,±s)
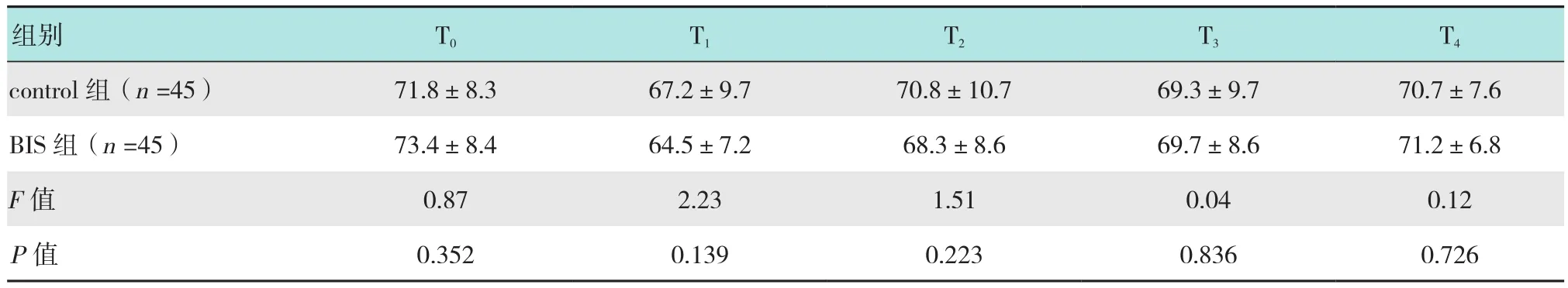
表6 两组患者不同时点HR的比较 (次/min,±s)Table 6 Comparison of HR profiles across different time points between the two groups (n/min,±s)
组别 T0 T1 T2 T3 T4 control组(n=45) 71.8±8.3 67.2±9.7 70.8±10.7 69.3±9.7 70.7±7.6 BIS 组(n=45) 73.4±8.4 64.5±7.2 68.3±8.6 69.7±8.6 71.2±6.8 F值 0.87 2.23 1.51 0.04 0.12 P值 0.352 0.139 0.223 0.836 0.726
表7 两组患者不同时点MAP的比较 (mmHg,±s)Table 7 Comparison of MAP profiles across different time points between the two groups (mmHg,±s)
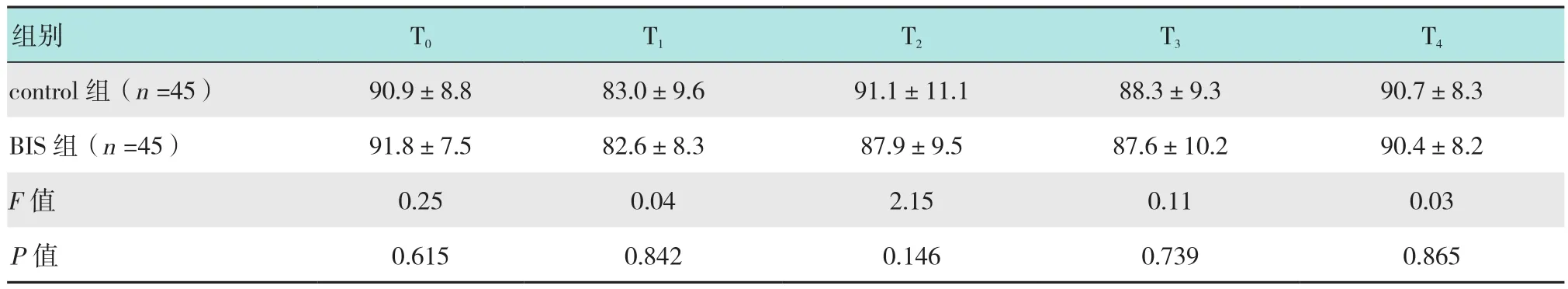
表7 两组患者不同时点MAP的比较 (mmHg,±s)Table 7 Comparison of MAP profiles across different time points between the two groups (mmHg,±s)
组别 T0 T1 T2 T3 T4 control组(n=45) 90.9±8.8 83.0±9.6 91.1±11.1 88.3±9.3 90.7±8.3 BIS组(n=45) 91.8±7.5 82.6±8.3 87.9±9.5 87.6±10.2 90.4±8.2 F值 0.25 0.04 2.15 0.11 0.03 P值 0.615 0.842 0.146 0.739 0.865
表8 两组患者不同时点SpO2的比较 (%,±s)Table 8 Comparison of SpO2 profiles across different time points between the two groups (%,±s)
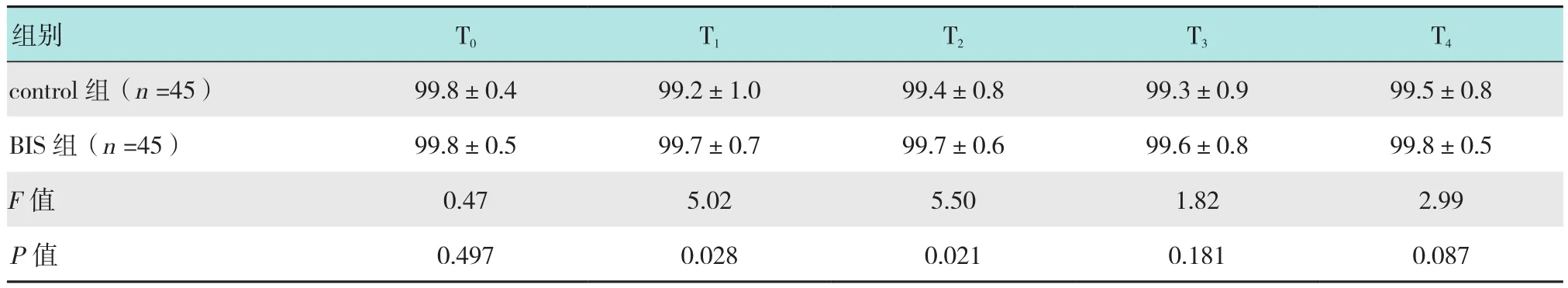
表8 两组患者不同时点SpO2的比较 (%,±s)Table 8 Comparison of SpO2 profiles across different time points between the two groups (%,±s)
组别 T0 T1 T2 T3 T4 control组(n=45) 99.8±0.4 99.2±1.0 99.4±0.8 99.3±0.9 99.5±0.8 BIS 组(n=45) 99.8±0.5 99.7±0.7 99.7±0.6 99.6±0.8 99.8±0.5 F值 0.47 5.02 5.50 1.82 2.99 P值 0.497 0.028 0.021 0.181 0.087
3 讨论
本研究发现,对于内镜下射频治疗的GERD成年患者,BIS辅助的镇静监测可减少体动反应发生率,提高内镜操作者满意度,并减少丙泊酚用量和减轻镇静的平均深度。
内镜下GERD射频治疗与ESD和ERCP相似,具有操作耗时、疼痛刺激及不良反射明显和需深度镇静等显著特点[11-13]。本研究将BIS值控制在55~70,MOAA/S控制在0到1之间后发现,BIS辅助的镇静监测可显著减少体动反应,提高操作者满意度。与本研究结果相似,IMAGAWA等[11]对156例ESD镇静的研究结果显示,将BIS控制在60~80间能够有效提高操作者满意度,并且体动反应发生率下降。PARK等[14]对于180例ESD镇静患者的研究发现,将BIS控制在68~75时,BIS组的体动反应发生率为20/90(22.2%),而对照组为28/90(31.1%)。这些结果提示,在类似内镜操作中应用BIS辅助可能有助于维持足够镇静深度,减少体动反应,以提高操作者满意度。
一项对196例GERD患者的研究中,肥胖患者占15.3%(30/196)[15],与本研究的肥胖比例(13.3%)类似。肥胖患者腹段下食管括约肌更短,更易形成反流[15],术中误吸风险加大;并且多合并呼吸问题,术中保持合理的氧合,避免过度镇静导致的呼吸抑制更为重要[16]。肥胖患者的丙泊酚代谢动力学不同于正常人群,与全麻手术相似,BIS监测的镇静可能更有助于维持合理的镇静深度,避免过度用药[17]。对于病态肥胖患者,全麻控制呼吸下的射频或手术治疗应更为安全[15,18]。
深度镇静下的内镜下射频治疗需要特别注意丙泊酚导致的呼吸抑制问题[19]。本研究采用了小剂量右美托咪定、舒芬太尼合用丙泊酚的用药方案,并采取BIS辅助检测手段,以减少丙泊酚用药,维持平稳的镇静深度,降低呼吸抑制率[20]。同时在气道管理方面,笔者采取了术前用药以减少分泌物;术中持续鼻导管吸氧以改善氧供;必要时嘱术者停止操作,给予手动辅助呼吸或面罩加压通气直至患者呼吸恢复,达到了较好的效果。研究发现,ASA分级Ⅲ级以上和高龄[21]是内镜镇静相关的呼吸不良事件的独立危险因素,本研究并没有纳入这两类患者,也可能是术中缺氧率发生较低的因素。
本研究发现,BIS辅助组和常规监测组患者的血流动力学指标相似,循环呼吸不良事件的发生率相似,提示两组安全性类似。在ESD患者镇静[11,14]中的结果与笔者的发现类似。FRUCHTER等[10]在纤维支气管镜检查中也发现,BIS辅助的镇静对于循环呼吸稳定性,包括低氧率、心血管活性药物使用率和手动给氧率等均无明显影响。KANG和PASPATIS等[22-23]在ERCP深度镇静的研究中也发现,BIS辅助的镇静较常规镇静不能减少术中镇静相关的不良事件的发生率。这些结果说明,BIS辅助的内镜镇静并不能进一步增强安全性。原因可能有以下两方面:一是现有的麻醉镇静药物和流程已能保证相当程度的呼吸循环稳定,副作用事件较少[19]。一项针对191 142次消化道内镜操作的多中心前瞻性研究发现,丙泊酚镇静相关的不良事件的发生率仅为0.42‰[24];二是各研究样本量均较小。根据本研究的低氧发生率估算,大约每组需要330例患者,才能得出统计学差异。
本研究心血管活性药物特别是阿托品和尼卡地平的使用率较高,原因可能包括:①内镜下射频治疗对咽喉部和食管迷走神经刺激强烈,导致术中HR下降;②术中牵拉胃底刺激迷走神经反射;③射频治疗时针刺和高温烧灼感均可引起血压增高。将来研究中可探讨事先予以咽喉部表面麻醉;术前30 min左右嘱患者服用丁卡因胶浆进行更充分的胃底表面麻醉以减少迷走相关的HR减慢。同时对于射频烧灼引起的血压升高,可能与镇痛不足相关,严格呼吸循环监测下的加大舒芬太尼用量或采用其他镇痛方案如氯胺酮-右美托咪定方案等,可能有助于改善镇痛和其引起的血压升高问题[25]。
PASPATIS等[23]将BIS应用于ERCP患者深度镇静监测的结果显示,在丙泊酚维持剂量以及镇静深度方面BIS组优于传统镇静组,这与本研究应用BIS能够减少丙泊酚用量相一致。VON DELIUS等[12]研究144例行ERCP患者的镇静评估结果显示,应用BIS能够缩短睁眼时间及出室时间,但本研究并没有观察到该结果,这可能与BIS取值范围及丙泊酚追加剂量不同相关。本研究发现,虽然两组苏醒时间差异无统计学意义,但治疗结束时的BIS组MOAA/S评分和BIS值均高于对照组,这与郑胜宇等[26]的研究结果一致,提示BIS可能有助于防止过度镇静。
本研究虽然观察到BIS辅助的GERD射频镇静有助于减少麻醉药物用量、减少体动反应和提高操作者满意度,但BIS组仍有7例患者发生了体动反应,且BIS不能减少苏醒时间和心血管活性药物使用量。这提示,BIS应用仍有一定的缺陷。内镜操作镇静需要精确、快速调节药物剂量和镇静深度,但BIS的延迟现象可能对此不利。有报道显示BIS延迟时间从14~155 s不等[27]。另外,BIS反应镇静深度的准确性方面也同样存在不足[28],在今后的研究中需要进一步比较BIS和其他镇静监测设备用于内镜镇静的准确性和优劣。
综上所述,BIS监测辅助的镇静有助于减少内镜下GERD射频治疗过程中的体动反应,提高操作者满意度和减少镇静药物丙泊酚用量,避免过度镇静。
