糖尿病大鼠心肌纤维化与心肌AGEs/RAGE水平的变化
2018-08-30侯改霞肖国强习雪峰刘倩倩
侯改霞,肖国强,习雪峰,刘倩倩
(1. 河南大学体育学院,河南 开封 475001; 2. 华南师范大学体育科学学院,广州 510006)
糖尿病心肌病(diabetic cardiomyopathy,DCM)与糖尿病心血管疾病的高发生率和高病死率密切相关。心肌纤维化是DCM最突出的病理组织学变化之一。临床药理研究[1]认为晚期糖基化终产物(advanced glycosylation end products,AGEs)与糖尿病心肌纤维化密切相关。AGEs除可与心肌间质成分发生直接交联打乱组织间质正常生理功能外,还可与其受体RAGE(receptor for advanced glycation end products,RAGE)结合进一步介导AGEs的主要致病作用[2]。糖尿病心肌纤维化是一种连续变化的过程[3],随着糖尿病的发展,心肌纤维化程度逐渐加重。鉴于心肌AGEs/RAGE与糖尿病心肌纤维化的密切关系,心肌AGEs/RAGE水平在心肌纤维化进程中是否存在渐进增加的变化?心肌AGEs/RAGE水平与心肌纤维化的程度是否存在有正相关关系?这方面的研究比较少见。本课题通过高脂饮食加小剂量链脲佐菌素(STZ)复制Ⅱ型糖尿病大鼠模型,并在造模成功后第4,8和12周时检测大鼠血液和心肌相关指标,探讨Ⅱ型糖尿病大鼠心肌纤维化和心肌AGEs/RAGE水平的变化规律及其相互关系。
1 材料与方法
1.1 实验动物
雄性SD大鼠(SPF级,6周龄,体重160 ~ 180 g),购自郑州大学医学院实验动物中心【SCXK(豫)2010-0002】,饲养于标准实验动物房【SYXK(豫)2010-0016】。大鼠分笼饲养,自然昼夜节律变化,自由饮食。室温23±2℃,相对湿度40% ~ 60%。普通饲料:购自郑州大学医学院实验动物中心。高糖高脂饲料:64.8%基础饲料、20%蔗糖、10%猪油、5%蛋黄粉、0.2%胆酸钠。由郑州大学医学院实验动物中心配制。
1.2 实验方法
1.2.1 STZ溶液的配制
0.4% STZ的配制:在避光、低温、干燥环境中快速称取1 g STZ溶于250 mL 4℃预冷的柠檬酸盐缓冲液(0.1 mol/L,pH 4.0)中,充分溶解后立即使用。
1.2.2 Ⅱ型糖尿病大鼠模型的构建
参照Reed等[4]、Srinivasan等[5]、上官若男等[6]方法并稍加改良建立Ⅱ型糖尿病大鼠模型。雄性SD大鼠普通饲料适应性喂养1周后,随机分成2组:正常对照组(18只)和高脂饮食组(76只),正常对照组继续饲喂普通饲料,高脂饮食组改为高脂饲料喂养。饲喂6周后,高脂饮食组大鼠过夜空腹12 h,腹腔注射小剂量链脲佐菌素(STZ,30 mg/kg),STZ溶液现配现用,30 min完成注射。注射后72 h检测大鼠随机血糖浓度,随机血糖≥16.7 mmol/L为糖尿病大鼠暂时成模标准。剔除血糖不达标大鼠。1周后复查暂时成模大鼠,随机血糖仍≥16.7 mmol/L为建模成功,剔除不达标大鼠。共有72只大鼠造模成功,成功率94.7%。
实验分组:4周正常对照组(4C)、4周糖尿病对照组(4D)、8周正常对照组(8C)、8周糖尿病对照组(8D)、12周正常对照组(12C)、12周糖尿病对照组(12D),每组动物6只。
1.2.3 动物取材
在造模成功后第4、8和12周周末,正常对照组(4C,8C,12C)和糖尿病对照组(4D,8D,12D)大鼠过夜禁食12 h后,称重后腹腔麻醉,剖腹,从腹主动脉取血,3000 r/min离心20 min,取血清置于-80℃冰箱保存检测FBG、insulin。取部分左心室置于4%多聚甲醛中固定以备Masson染色和RAGE免疫组化检测,另取部分左心室置于-80℃冰箱保存以做AGEs、Hyp含量检测。
1.2.4 指标测试
(1)测试指标及测试方法
空腹血糖(FBG)测试采用磷钼酸法,羟脯氨酸(Hyp)测定采用碱水解法,胰岛素(insulin)、AGEs采用酶联免疫法(ELISA法),操作检测流程严格按试剂盒说明书进行。
(2)Masson染色图像采集与分析处理
Masson染色后,在Olympus显微镜400倍光镜视野下,每张切片随机选出6个视野并获取图像,采用Image-Pro Plus Version 6.0图像分析系统分析。测量每个视野中蓝色胶原纤维染色的面积,计算胶原面积与心肌组织总面积的比值,取其均值即为每只大鼠胶原容积分数(CVF,%)。含胶原丰富的冠脉细小血管区域不纳入测量范围内[7]。
(3)免疫组化图像采集与分析处理
AGEs、RAGE:Olympus显微镜低倍选准位置,高倍观察并拍照。阳性细胞胞膜、胞浆显色为棕黄色。每张切片随机选出6个视野,在400倍光镜视野下获取图像,采用Image-Pro Plus Version 6.0图像分析系统分析,得出每个视野的平均光密度值(IOD/area)。
1.3 统计学方法
2 结果
2.1 Ⅱ型糖尿病大鼠在第4,8和12周时血液FBG、Insulin、体重水平的变化
造模成功后第4,8和12周,糖尿病对照组(4D,8D,12D)FBG均较正常对照组(4C,8C,12C)显著升高(P﹤0.01),糖尿病对照组(4D,8D,12D)体重均较正常对照组(4C,8C,12C)显著下降(P﹤0.05或P﹤0.01)。造模成功后第4,8周,糖尿病对照组(8D,4D)大鼠Insulin与正常对照组(4C,8C)相比无显著差异(P﹥0.05);在第12周时,糖尿病对照组(12D)大鼠insulin显著高于同周次正常对照组(12C)(P﹤0.05)和4周时糖尿病对照组(4D)(P﹤0.01)。见表1。
表1 Ⅱ型糖尿病大鼠在第4、8和12周时血液FBG、Insulin、体重水平的变化Table 1 Changes of FBG, insulin of the diabetic rats at 4th, 8th and 12th
注:*P﹤0.05,**P﹤0.01,表示与同周次正常对照组比较;#P﹤0.05,##P﹤0.01,表示与4周糖尿病对照组(4D)比较;△P﹤0.05,△△P﹤0.01,表示与8周糖尿病对照组(8D)比较。(下表/图同)
Note.*P﹤0.05,**P﹤0.01, compared with the group C at the same weeks;#P﹤0.05,##P﹤0.01, compared with the group 4D;△P﹤0.05,△△P﹤0.01, compared with the group 8D. (The same in the following Tables and Figures)
2.2 Ⅱ型糖尿病大鼠在第4、8和12周时心肌Hyp、AGEs含量的变化
第4周时,糖尿病对照组(4D)心肌Hyp、AGEs含量与正常对照组(4C)相比差异无显著性(P﹥0.05);但在第8周时,糖尿病对照组(8D)心肌Hyp、AGEs含量与正常对照组(8C)相比差异有显著性(P﹤0.05 或P﹤0.01),且8周糖尿病对照组(8D)心肌Hyp、AGEs含量高于4周糖尿病对照组(4D)(P﹤0.05或P﹤0.01);12周糖尿病对照组(12D)心肌Hyp、AGEs含量高于12周正常对照组(12C)和4周、8周糖尿病对照组(4D,8D)(P﹤0.01)。见表2。
2.3 Ⅱ型糖尿病大鼠在第4、8和12周时心肌胶原容积分数(CVF)变化
第4周时,糖尿病对照组(4D)心肌CVF与正常对照组(4C)相比差异无显著性(P﹥0.05);但在第8周时,糖尿病对照组(8D)心肌CVF与正常对照组(8C)相比差异有显著性(P﹤0.05),且8周糖尿病对照组(8D)心肌CVF显著高于4周糖尿病对照组(4D)(P﹤0.05);12周糖尿病对照组(12D)心肌CVF显著高于12周正常对照组(12C)和4周、8周糖尿病对照组(4D,8D)(P﹤0.01)。见图1、2。
表2 Ⅱ型糖尿病大鼠在第4、8和12周时心肌Hyp、AGEs含量的变化Table 2 Changes of Hyp, AGEs of the myocardium of diabetic rats at the 4th, 8th and 12th
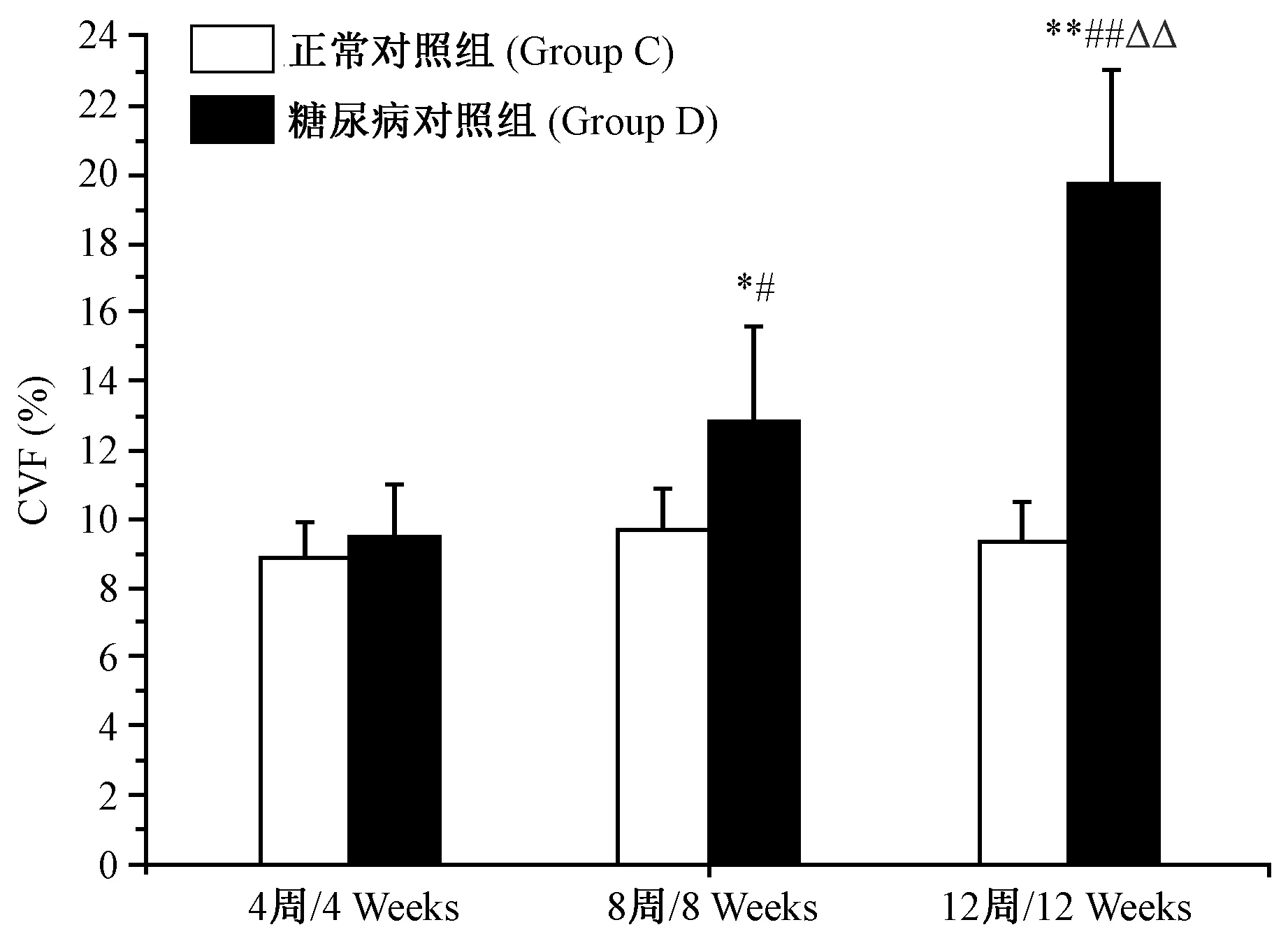
图1 Ⅱ型糖尿病大鼠在第4、8和12周时心肌CVF的变化Figure 1 Changes of CVF of the myocardium of diabetic rats at the 4th, 8th and 12th weeks

注:a. 4周正常对照组; b. 4周糖尿病对照组; c. 8周正常对照组; d. 8周糖尿病对照组; e. 12周正常对照组; f. 12周糖尿病对照组。图2 Ⅱ型糖尿病大鼠在第4、8和12周时心肌胶原的变化(Masson染色,×400)Note. a. Group 4C. b. Group 4D. c. Group 8C. d. Group 8D. e. Group 12C. f. Group 12D.Figure 2 Changes of myocardial collagen fibers of the diabetic rats at the 4th, 8th and 12th weeks (Masson staining, ×400)
2.4 Ⅱ型糖尿病大鼠在第4、8和12周时心肌RAGE蛋白表达的变化
第4周时,糖尿病对照组(4D)心肌RAGE蛋白表达与正常对照组(4C)相比差异无显著性(P﹥0.05);但在第8周时,糖尿病对照组(8D)心肌RAGE蛋白表达与正常对照组(8C)相比差异有显著性(P﹤0.01),且8周糖尿病对照组(8D)心肌RAGE蛋白表达显著高于4周糖尿病对照组(4D)(P﹤0.01);12周糖尿病对照组(12D)心肌RAGE蛋白表达显著高于12周正常对照组(12C)(P﹤0.01)和4周、8周糖尿病对照组(4D,8D)(P﹤0.01)。见图3、4。
2.5 Ⅱ型糖尿病大鼠心肌AGEs/RAGE水平与CVF相关性分析
经Pearson 相关性分析,Ⅱ型糖尿病大鼠心肌AGEs水平与CVF呈显著正相关关系(r=0.825,P﹤0.01),心肌RAGE水平与CVF也呈显著正相关关系(r=0.816,P﹤0.01)。
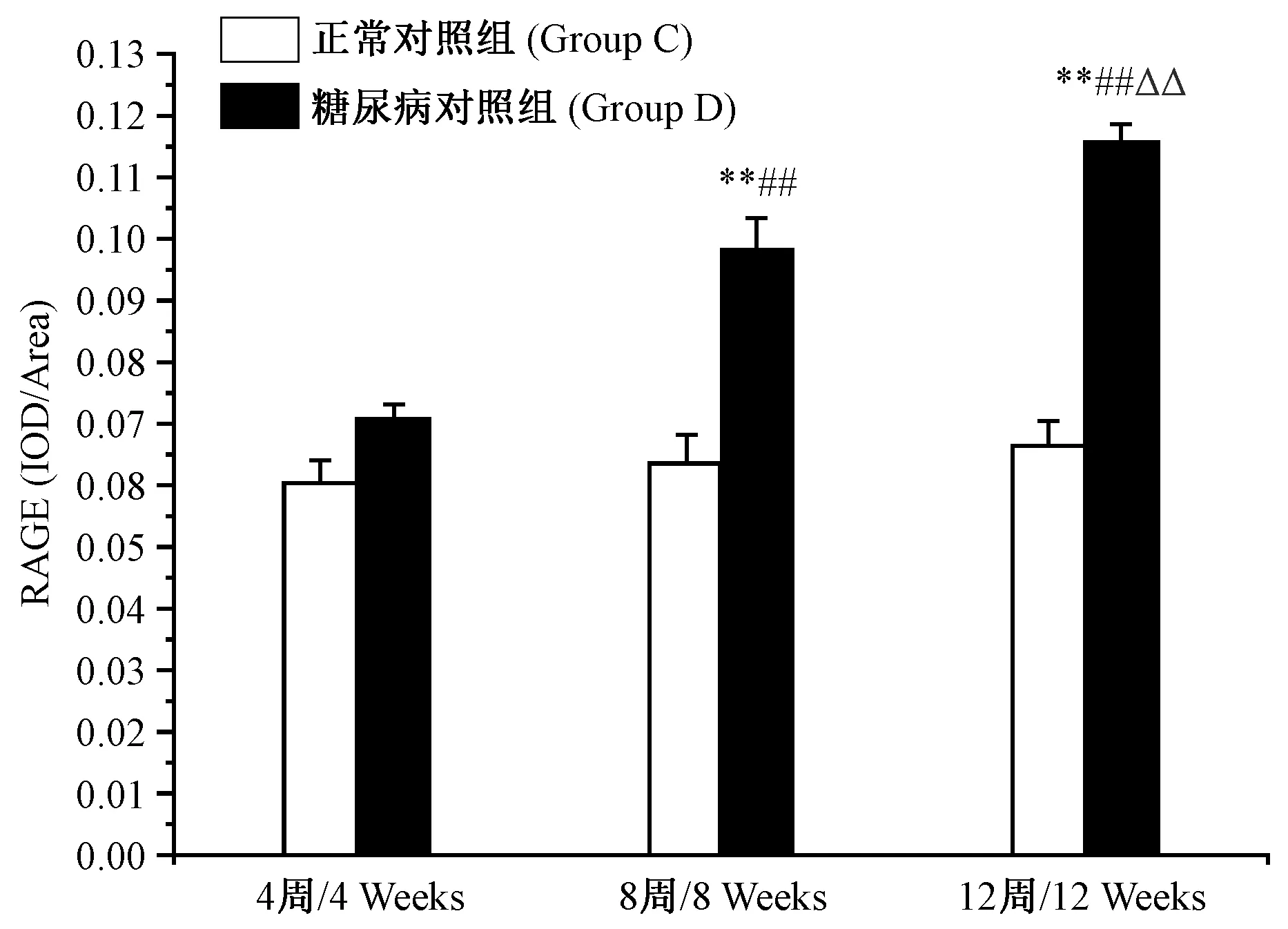
图3 Ⅱ型糖尿病大鼠在第4,8和12周时心肌RAGE蛋白表达的变化Figure 3 Changes of RAGE in the diabetic rat myocardium at the 4th, 8th and 12th weeks
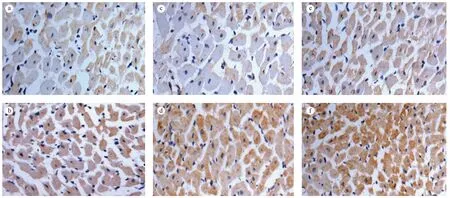
注:a. 4周正常对照组; b. 4周糖尿病对照组;c. 8周正常对照组;d. 8周糖尿病对照组; e. 12周正常对照组;f. 12周糖尿病对照组。图4 Ⅱ型糖尿病大鼠在第4、8和12周时心肌RAGE免疫组化染色的比较(DAB显色,×400)Note. a. Group 4C. b. Group 4D. c. Group 8C. d. Group 8D. e. Group 12C. f. Group 12D.Figure 4 Changes of RAGE in the myocardium of diabetic rats at 4th, 8th and 12th weeks (DAB staining, ×400)
3 讨论
心血管系统疾病是造成糖尿病病人晚期死亡的主要原因之一,是非糖尿病人群死于心血管系统疾病机率的2 ~ 4倍[8]。DCM与糖尿病心血管疾病的高发生率和高病死率密切相关。DCM是由糖尿病独立引起的心肌相关结构和功能的变化,典型变化表现为舒张功能不全,且随着时间的推移,逐渐表现为收缩功能不全,易发生充血性心力衰竭[9-10]。DCM最突出的病理组织学变化是心肌纤维化[11-12],是引起心肌舒张功能受损及收缩功能不全的重要因素。
Ⅱ型糖尿病动物模型的成功构建是研究Ⅱ型糖尿病心肌纤维化的基础。高脂饮食加小剂量链脲佐菌素(STZ)是目前国内外尤其是国内复制Ⅱ型糖尿病动物模型的常用方法,按此方法复制的Ⅱ型糖尿病动物模型具有高血糖、高胰岛素和胰岛素抵抗等Ⅱ型糖尿病的主要临床特征,价格相对来说较便宜,方法简单。本文采用高脂饮食饲喂SD大鼠6周加一次性腹腔注射链脲佐菌素30 mg/(kg·bw)成功构建Ⅱ型糖尿病大鼠模型。在造模成功后第4、8和12周时检测大鼠血液FBG、insulin和心肌胶原代谢Hyp、CVF水平,发现本实验所复制的Ⅱ型糖尿病大鼠模型具备高血糖、高胰岛素血症和胰岛素抵抗的主要临床特征,且从第8周开始,Ⅱ型糖尿病大鼠心肌纤维化开始凸显,至第12周时,已表现出明显的心肌纤维化。
AGEs主要是由还原糖如葡萄糖等的羰基与蛋白质、脂质和DNA的游离氨基端通过非酶糖基化作用(Mailard反应)形成Schiff碱,Schiff碱进一步化学重排形成较稳定的Amadori产物,Amadori产物经过复杂的脱水、重排、凝聚、氧化等形成的不可逆终末产物(即AGEs)。表2显示,随着糖尿病病程的延长,Ⅱ型糖尿病大鼠心肌AGEs含量呈上升趋势。造模成功后第4周时,正常对照组(C)与糖尿病对照组(D)心肌AGEs含量的差别还不明显,但从第8周开始,糖尿病对照组心肌AGEs含量开始大幅增加,明显高于同周次正常对照组。由于Maillard反应的发生需几周甚至几个月的时间,因此Ⅱ型糖尿病大鼠心肌AGEs含量的这种变化趋势可能与其形成的时间特点有关。
RAGE是细胞表面具有的特定化学基团、并能结合AGEs的蛋白。RAGE是细胞内信号转导多肽,AGEs/RAGE结合介导AGEs的主要致病作用。正常情况下机体RAGE表达量很低,但在高血糖状态下,RAGE表达量显著增加。有证据显示,在糖尿病血管中AGEs沉积多的地方,RAGE的表达也增多[13]。可见,AGEs与RAGE的结合形成了一个正反馈回路,放大了随后由受体介导的细胞活化。图3、4显示,随着Ⅱ型糖尿病病程的延长,Ⅱ型糖尿病大鼠心肌RAGE蛋白表达逐渐升高,大体趋势与AGEs含量增加趋势一致。原因可能是RAGE的蛋白表达受其配体的调控,配体含量的增加至少可以部分的刺激其蛋白表达上升。
总之,本研究所构建的Ⅱ型糖尿病大鼠随着病程的发展,心肌纤维化呈逐渐上升趋势,从第8周开始,心肌纤维化速度明显加快,且心肌AGEs/RAGE水平与心肌纤维化的变化趋势大体一致,提示Ⅱ型糖尿病大鼠心肌AGEs/RAGE的水平上升可能是导致糖尿病心肌纤维化的主要因素之一。
