腺苷A2a受体在博莱霉素诱导的小鼠肺纤维化中的作用*
2018-08-29陈彦凡何以成黄卡特虞晓明陈马云黄晓颖王良兴
陈彦凡, 何以成, 黄卡特, 虞晓明, 陈马云, 陈 相, 黄晓颖, 王良兴
(1. 温州医科大学附属第一医院呼吸与危重症医学科; 2. 病理科, 浙江 温州 325000; 3. 苍南县人民医院呼吸内科, 浙江 苍南 325805)
腺苷(adenosine, Ado)是重要的内源性调控介质,具有减少组织损伤和促进修复的作用[1]。Ado受体有4种亚型,即A1R、A2aR、A2bR、A3R。实验发现,A2aR具有舒张支气管、抑制急性肺损伤等效应[2]。TGF-β1是最重要的器官纤维化调控因子。研究发现,激活的A2aR可以通过抑制TGF-β1表达而减轻肾间质纤维化[3]。本实验拟对比研究A2aR基因敲除型小鼠与野生型小鼠在肺间质纤维化、TGF-β1表达方面的差异,以及A2aR特异性激动剂能否减轻肺纤维化,探讨A2aR在小鼠肺间质纤维化形成中的调控作用及其与TGF-β1的关系。
1 材料与方法
1.1 动物模型的复制和分组
雄性SPF级野生型BALB/C小鼠30只和雄性SPF级A2aR基因敲除BALB/C小鼠20只(温州医科大学实验动物中心提供),体重17~20 g,随机分为5组(n=10)。A组:野生型小鼠对照组;B组:野生型小鼠肺纤维化组;C组:A2aR基因敲除小鼠对照组;D组:A2aR基因敲除小鼠肺纤维化组;E组:野生小鼠肺纤维化+ CGS21680(A2aR激动剂)组。腹腔注射1%戊巴比妥钠(50 mg/kg体重)麻醉小鼠,常规消毒,行颈正中切口,钝性分离暴露气管,于气管软骨环间隙用5号针头穿刺,肺纤维化组小鼠缓慢注入博莱霉素(bleomycin, BLM, 日本化药株式会社, 批号730342) 50 μl(5 mg/kg体重),对照组注入等体积生理盐水,注射后立即将小鼠直立旋转3~5 min,使药液均匀分布于两肺,然后缝合皮肤并消毒。小鼠清醒后常规饲养28 d,A、B、C、D组每天腹腔注射生理盐水0.5 ml,E组每天腹腔注射CGS21680 0.5 ml(Sigma公司,0.25 mg/kg体重)。
1.2 标本取材和指标测定
造模后第29天,眼球后静脉丛取血处死小鼠。血液置-4 ℃低温离心机3 000 r/min离心10 min,分离血清置-70 ℃低温冰箱保存待测。采血后立即打开胸腔,取出肺,冲洗后迅速将右下叶置于4%多聚甲醛液中固定,行病理切片,其余部分置液氮中冻存。每组随机选取2只小鼠右下肺组织,行电镜观察。
1.3 光镜、电镜标本制作及胶原纤维的Masson染色
切片常规脱蜡至水,HE染色,光镜下观察。切片Masson染色,显微镜下染绿色为胶原沉积阳性,分析肺纤维化程度。取小鼠右肺门处0.1 cm×0.1 cm×0.1 cm的肺组织,迅速放入2.5%戊二醛固定液中,1%锇酸后固定1 h,切片,用H-600型透射电镜观察。
1.4 肺组织羟脯氨酸、血清TGF-β1含量检测
称取50~100 mg肺组织放入试管中,严格按照试剂盒(南京建成生物工程研究所)要求,测定羟脯氨酸(hydroxyproline, Hyp)含量;ELISA法(美国Rapidbio公司)检测血清转化生长因子β1(transforming growth factor-β1, TGF-β1)含量。
1.5 免疫组化法检测小鼠肺组织TGF-β1、A2aR的相对含量
抗小鼠TGF-β1、抗小鼠A2aR单克隆抗体购自Abcam公司,兔二步法检测试剂盒购自北京中杉金桥生物技术公司。肺组织切片脱蜡,3%双氧水处理,滴加血清封闭,加I抗、II抗,DAB显色,以棕色、棕黄色、褐色为阳性细胞,采用Image-Proplus 6.0图像分析系统观察分析,以积分光密度(integral optical density,IOD)表示肺组织中各指标含量。每只小鼠随机选取1张肺组织切片,每张切片随机选取5个高倍视野(×400),求平均值作为TGF-β1、A2aR的相对含量。
1.6 原位杂交检测小鼠肺组织A2aR mRNA、TGF-β1 mRNA的表达
1.6.1 寡核苷酸探针 地高辛标记的探针购自武汉博士德生物工程有限公司。探针序列,A2aR:(1)5’-AACAG TAACC TGCAC AACGT CACCA ACTTC TTTGT-3’;(2)5’-TGGAA CAACT GCAGT CAGAA AGACG GGAAC TCCAC-3’;(3)5’-AACTG TTTCA CCTTC TTCTG CTCCA CGTGC CGGCA-3’.TGF-β1: (1)5’-ACCTG CAAGA CCATC GACAT GGAGC TGGTG AAACG-3’;(2)5’-CGTGC AGAGC TGCGC TTGCA GAGAT TAAAA TCGGA-3’;(3)5’-CACAG CTCAC GGCAC CGGAG AGCCC TGGAT ACCAA-3’
1.6.2 杂交过程 切片常规脱蜡至水,用3%柠檬酸稀释的胃蛋白酶于室温消化,与地高辛标记的A2aR或TGF-β1寡核苷酸探针杂交、封闭。滴加鼠抗地高辛抗体,滴加生物素化过氧化物酶,DAB显色,阳性结果呈棕黄色。每只小鼠随机选取1张肺组织切片,应用Image Pro plus 6.0图像分析软件检测A2aR mRNA、TGF-β1 mRNA的平均吸光度(Absorbance, A),随机测定5个高倍视野,计算其平均吸光度值作为A2aR mRNA、TGF-β1 mRNA的值。
1.7 Western blot法测定小鼠肺组织匀浆A2aR、TGF-β1蛋白质
取-80 ℃保存的肺组织80~100 mg,加入400 μl RIPA裂解液,置于冰上充分研磨;超声裂解,离心,取上清液。采用二喹啉甲酸(BCA)法测定蛋白质浓度。常规SDS-PAGE,三明治法恒压电转移至PVDF膜(300 mA,A2aR、TGF-β1, 50 min)。封闭结束后加入I抗(抗A2aR抗体浓度为1∶1000,抗TGF-β1抗体浓度为1:500,抗内参GAPDH抗体浓度为1∶1000),4 ℃封闭16 h,分别加入稀释的羊抗兔IgG(Ⅱ抗)。洗涤后,用Bio-Rad凝胶成像系统进行曝光;以Quantity One软件分析各蛋白质的吸光度,计算各组目的蛋白质相对浓度的差异。
1.8 统计学方法

2 结果
2.1 各组小鼠肺组织羟脯氨酸、血清TGF-β1含量的比较
野生型小鼠纤维化组(B组)、A2aR基因敲除小鼠纤维化组(D组)的肺Hyp含量分别高于其各自对照组(A组、C组,P<0.01),D组Hyp含量也明显高于B组(P<0.01);与B组比较,野生型小鼠纤维化+ CGS21680组(E组) Hyp含量明显下降(P<0.01)。B组、D组TGF-β1含量分别明显高于各自对照组(A组、C组,P<0.01);D组TGF-β1含量也高于B组(P<0.05);与B组比较,E组TGF-β1含量明显下降(P<0.01)。TGF-β1与肺Hyp含量之间呈线性相关(偏相关系数r=0.773,P<0.05,表1)。


GroupHyp (μg/g)TGF-β1(μg/ml)A465.89±22.74195.13±37.87B606.43±58.55**353.42±33.11**C490.54±43.03214.73±32.47D689.56±97.99##▲▲406.18±50.81#▲▲E502.90±58.42##218.54±33.87##
Hyp: Hydroxyproline; TGF-β1: Transforming growth factor-β1
**P<0.01vsA group;#P<0.05,##P<0.01vsB group;▲▲P<0.01vsC group
2.2 各组小鼠肺脏大体及显微结构的比较
A组、C组肺脏大体标本表面光滑,弹性好,色泽红润。B组、D组的肺脏弹性差,呈灰色,表面不光滑,甚至有疤痕样增生;E组的上述表现较B组和D组明显减轻(图1,见彩图页Ⅰ)。
光镜下,A组和C组肺泡结构清晰完整,肺泡壁薄,肺泡间隔无明显增宽及出血。B组肺泡壁增厚,肺泡结构紊乱破坏,肺泡腔狭窄或部分陷闭,肺泡间隔增宽,纤维增生明显,炎细胞浸润;D组的上述表现较B组、C组明显加重;E组上述表现较B组明显减轻(图2,见彩图页Ⅰ)。

2.3 各组小鼠肺脏组织超微结构及纤维组织Masson染色
A组和C组肺组织I型、II型肺泡上皮细胞结构完整,线粒体及板层小体无改变,肺泡间隔无明显增宽,无胶原纤维增生;B组I型、II型肺泡上皮细胞明显空泡化,肺泡隔扩大,可见胶原纤维增生,炎细胞增多,板层小体空泡化,细胞核轻微固缩。D组肺组织的上述表现较B组愈加明显。E组的上述表现明显减轻(图3)。A组、C组肺泡间隔的阳性区域较少,呈细丝状,散在分布;B组、D组的阳性区域明显增大,呈融合片状分布,其中D组更加明显;E组的上述表现较B、D组明显减轻(图4,见彩图页Ⅱ)。

Fig.3Changes of ultrastructure in lung tissue of mice
A: WT control group; B: WT fibrosis group; C: A2aR KO control group, D: A2aR KO fibrosis group; E: WT fibrosis+A2aR agonist (CGS21680) group; WT: Wild type mice; A2aR KO:A2aR gene knockout

2.4 各组小鼠肺组织A2aR蛋白质和A2aR mRNA表达的比较
免疫组化法检测结果表明,B组小鼠肺组织A2aR蛋白质表达明显高于A组(P<0.01,表2);E组肺组织A2aR蛋白质表达明显高于B组(P<0.01)。Western blot方法检测结果表明,B组肺组织A2aR蛋白质含量高于A组(P<0.05),E组肺组织A2aR蛋白质含量高于B组(P<0.01)。原位杂交检测结果表明,B组肺组织A2aR mRNA的表达高于A组(P<0.01),E组肺组织A2aR mRNA表达明显高于B组(P<0.01,图5,6,7,图5见彩图页Ⅱ,图6见彩图页Ⅲ)。



GroupA2aR(immunohistochemical)(IOD)A2aR Western-blot(relative value)A2aR mRNA(OD)A32.01±8.150.220±0.10235.34±5.02B53.04±6.72**0.521±0.079*56.87±15.12**E69.20±14.99##1.211±0.354##76.65±7.34##
*P<0.05,**P<0.01vsA group;##P<0.01vsB group

Fig.7Expression of A2aR protein in mice(Western blot)
A: WT control group; B: WT fibrosis group; C: A2aR KO control group; D: A2aR KO fibrosis group; E: WT fibrosis+A2aR agonist (CGS21680) group; WT: Wild type mice; A2aR KO: A2aR gene knockout
2.5 各组小鼠肺脏TGF-β1蛋白质含量、TGF-β1 mRNA表达的比较
免疫组化结果显示,B组、D组肺组织TGF-β1蛋白质含量分别明显高于A组、C组(P<0.01);D组也高于B组(P<0.05);E组与B组比较,则明显下降(P<0.01,表3,图8,见彩图页Ⅲ)。Western blot检测结果表明:B组、D组肺组织TGF-β1蛋白质含量分别高于A组、C组(P<0.01),D组也高于B组(P<0.05);与B组比较,E组则明显下降(P<0.05,表3,图9)。原位杂交检测结果表明,B组、D组肺组织TGF-β1 mRNA表达分别明显高于A组、C组(P<0.01),D组也高于B组(P<0.01);与B组比较,E组则明显下降(P<0.01,表3,图10,见彩图页Ⅳ)。

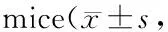

GroupTGF-β1(immunohistochemical)(IOD)TGF-β1(Western-blot)(relative value)TGF-β1mRNA(IOD)A62.12±7.960.517±0.27753.12±6.89B74.53±8.45**2.256±0.430**68.35±7.54**C54.71±6.200.767±0.50148.76±6.45D79.25±6.70#▲▲4.040±1.708#▲▲80.33±7.90##▲▲E55.07±7.29##1.040±0.442#49.08±8.14##
TGF-β1: Transforming growth factor-β1
**P<0.01vsA group;#P<0.05,##P<0.01vsB group;▲▲P<0.01vsC group

Fig.9Expression of TGF-1β protein in mice(Western blot)
A: WT control group; B: WT fibrosis group; C: A2aR KO control group; D: A2aR KO fibrosis group; E: WT fibrosis+A2aR agonist (CGS21680) group; WT: Wild type mice; A2aR KO: A2aR gene knockout
3 讨论
博莱霉素诱导的小鼠肺纤维化是目前被广泛接受的动物模型[4]。研究表明,肺纤维化小鼠肺组织早期以炎性反应为主,表现为淋巴细胞、巨噬细胞、中性粒细胞等大量聚集,随着炎性反应减弱,促纤基因的表达升高,胶原合成增加[5]。本实验于光镜下可见野生型纤维化小鼠肺组织中肺泡壁增厚,肺泡结构紊乱破坏,肺泡腔狭窄或部分陷闭,纤维增生明显,炎细胞浸润;而A2aR基因敲除肺纤维化小鼠肺组织中上述表现更为明显。同时,Masson染色后,A2aR基因敲除肺纤维化小鼠肺泡间隔阳性区域呈融合片状分布,其面积较野生型肺纤维化小鼠明显增大。电镜下,野生型纤维化小鼠肺组织中I型、II型肺泡上皮细胞和板层小体明显空泡化,细胞核固缩;A2aR基因敲除肺纤维化小鼠的细胞凋亡更为显著,提示A2aR基因的缺失加重了小鼠肺纤维化的形成[6]。
羟脯氨酸(Hyp)是胶原代谢的重要指标,肺组织中Hyp的含量可间接判断肺纤维化的严重程度。本实验发现,野生型纤维化小鼠和A2aR基因敲除肺纤维化小鼠肺组织Hyp含量明显高于各自对照组(P<0.01),提示BLM明显促进肺泡外基质的增生和沉积,继而形成肺纤维化[7]。而A2aR基因敲除肺纤维化小鼠的Hyp的含量较野生型肺纤维化小鼠愈加增高。TGF-β1是一类来源于单核巨噬细胞具有调节细胞生长和分化的多肽,现已被认为是肺纤维化形成及发展的关键因子[8],TGF-β1与成纤维细胞表面受体结合,可促进成纤维细胞的分裂、增殖及趋化,产生胶原并抑制其降解,促进组织纤维增生及修复。在慢性阻塞性肺病、肺结核、矽肺和弥漫性间质性肺疾病等肺纤维化过程中,TGF-β1水平均明显升高。本研究显示,纤维化组小鼠的血清TGF-β1浓度高于各自对照组。免疫组化和Western blot两种不同方法检测均显示,纤维化组小鼠肺组织中TGF-β1蛋白质含量明显高于对照组(P<0.01,P<0.05),TGF-β1 mRNA的表达也明显增加(P<0.01),提示TGF-β1参与了BLM诱导的肺纤维化的形成[9]。A2aR基因敲除肺纤维化小鼠的上述指标均明显高于野生型肺纤维化小鼠,且与A2aR基因敲除纤维化组小鼠肺纤维化程度增加相一致,提示A2aR缺失可能促进了TGF-β1的合成和分泌,从而增加了胶原的沉积[10]。
正常状态下,细胞外腺苷(Ado)浓度较低,但在炎症或损伤应激状态下,细胞内Ado成倍增多并分泌至细胞外,调节免疫和炎症损伤。目前认为,Ado与巨噬细胞、树突状细胞、上皮细胞、T淋巴细胞等表面的A2aR结合而发挥多种调节功能[11]。研究发现,A2aR在内毒素诱导的肝纤维化、过敏原或烟草诱导的肺部炎症以及急性肺损伤中均有反应性表达增强[12]。本研究采用Western blot、免疫组化和原位杂交等方法进行检测,结果提示野生型纤维化小鼠肺组织中A2aR蛋白质及A2aR mRNA的表达较对照组明显增加(P<0.01),显示在BLM诱导下,肺组织A2aR表达呈反应性增强。Ohta等[13]发现,A2aR基因敲除小鼠的炎症反应较野生型小鼠明显加重,甚至导致死亡,应用A2aR激动剂CGS21680能明显抑制TNFα等炎性介质的表达和释放。本实验应用A2aR激动剂CGS21680干预后,肺组织纤维化程度明显减轻,胶原沉积减少,Hyp含量降低,肺泡上皮细胞损伤减轻,同时血清中TGF-β1浓度、肺组织TGF-β1蛋白质含量及TGF-β1 mRNA的表达也明显低于野生型纤维化小鼠,提示在BLM诱导的肺纤维化中,A2aR通过降低TGF-β1的表达而抑制纤维化的形成[14]。但A2aR调节TGF-β1表达的具体信号途径尚未阐明,有待进一步研究。
