香港四照花外植体的抗褐化处理与诱导培养
2018-08-22陈梦倩范李节王小德
陈梦倩,范李节,王小德
(浙江农林大学 风景园林与建筑学院,浙江 杭州311300)
香港四照花Dendrobenthamia hongkongensis是山茱萸科Cornaceae四照花属Dendrobenthamia常绿乔木,自然分布于华东、华南、西南等地区。主干通直,冠型饱满;初夏头状花序顶生,花苞片大而洁白,观赏性强;秋季核果聚生成球形,红艳可爱,既可食用又可酿酒、入药[1-2]。四照花属的大部分植物种子都具有深休眠的特性,影响了优良种质资源的有性繁殖和推广[3]。植物组织培养技术作为一种成熟的扩繁技术,不仅能保持繁殖体的优良特性,且繁殖速度快,周期短,不受场地、环境限制,是苗木良种化、工厂化的重要途径[4]。因此,进行香港四照花的诱导培养研究,对香港四照花的扩繁和推广应用具有现实意义。香港四照花在初代培养中极易褐化,会影响外植体的诱导与生长,严重时能致其死亡,故对它进行抗褐化研究显得尤为重要。目前,常用的抗褐化措施有预处理材料,选择适宜的培养条件,使用抗褐化剂等[5]。其中,常用抗褐化剂主要有聚乙烯吡咯烷酮(PVP),活性炭(AC),抗坏血酸(VC), 硫代硫酸钠(Na2S2O3)及柠檬酸(CA)等[6]。 刘均利等[7]发现 PVP 对华盖木 Manglietiastrum sinicum外植体的抗褐化效果显著。李萍等[8]研究表明,在培养基中加入2.0 g·L-1AC培养4 d再转入不含AC的培养基中,能有效控制牡丹Paeonia suffruticosa外植体褐化。本研究选择香港四照花嫩叶、茎段和带芽茎段为外植体,通过不同消毒方式处理、筛选基本培养基、材料预处理和使用抗褐化剂等方法,以期得出能有效降低香港四照花外植体褐化率的最佳方案,并采用正交试验法,研究不同植物生长调节剂种类及质量浓度对外植体诱导的影响。
1 材料和方法
1.1 试验材料
试验所用材料为浙江农林大学校园的香港四照花,于2017年3月中旬至5月中旬,选择生长健壮、无病虫害的当年生嫩叶、茎段和带芽茎段作为外植体。
1.2 试验方法
1.2.1 培养基与培养条件 所有基本培养基若无特殊说明均为木本植物用培养基(woody plant medium,WPM), 添加蔗糖 30.0 g·L-1, 琼脂 6.0 g·L-1, 除植物生长调节剂配比试验外, 均附加 1.0 mg·L-16 苄基腺嘌呤(6-BA)+0.2 mg·L-1萘乙酸(NAA), pH 5.8。 各试验中 3 种外植体均接种 20 瓶·处理-1, 3 个·瓶-1,重复 3 次·处理-1。培养室温度为(25±2)℃,光照时间 12 h·d-1, 光照强度 1 800~2 000 lx, 接种后先暗培养7 d再进行光培养。
1.2.2 外植体的消毒处理 将采集的3种外植体用流水冲洗并用软毛笔刷去表面脏物,放在洗洁精溶液中浸泡5 min,流水冲洗1 h。沥干水后,在超净工作台上先用体积分数为70%乙醇消毒30 s,用无菌水漂洗 3 次后,分别用 2 种消毒剂处理: 30.0 mL·L-1次氯酸钠(NaClO)溶液(5, 10,15 min)和 1.0 g·L-1氯化汞(HgCl2)溶液(5,8,10 min),消毒后用无菌水漂洗5遍。切除与消毒液接触的伤口部位,将嫩叶切成1.0 cm×1.0 cm大小,茎段和带芽茎段切成1.0~1.5 cm长,接种于培养基上。每日观察统计污染率和存活率。
1.2.3 基本培养基的筛选 采用1.2.2筛选出的最佳消毒方式处理的3种外植体,分别接种在MS(Murashige and Skoog),DKW(Driver and Kuniyuki),WPM培养基上。每日观察统计褐化率及诱导率。
1.2.4 外植体抗褐化预处理 将流水冲洗1.0 h后的外植体分别置于1.0 g·L-1PVP,1.0 g·L-1柠檬酸和1 g·L-1VC中浸泡3.0 h,以未预处理为对照(ck),浸泡后将3种外植体置于超净工作台上消毒并接种。每日观察统计褐化率。
1.2.5 抗褐化剂实验 在培养基中添加不同质量浓度的 PVP(0.5,1.0,2.0 g·L-1), 柠檬酸(0.5,1.0,2.0 g·L-1), VC(0.5, 1.0, 2.0 g·L-1), 活性炭(0.5, 1.0, 2.0 g·L-1)和硫代硫酸钠(0.1, 0.2, 0.5 g·L-1),以不添加任何抗褐化剂为对照(ck),将3种外植体接种到各培养基中。每日统计外植体褐化率。
1.2.6 植物生长调节剂配比试验 采用正交试验设计L9(34),在WPM培养基中添加不同质量浓度6-BA(0.5, 1.0, 2.0 mg·L-1), NAA(0, 0.1, 0.2 mg·L-1)和 2,4-二氯苯氧乙酸(2,4-D, 0.1, 0.2, 0.5 mg·L-1),接种后每日观察并记录外植体启动时间,统计出愈率及萌发率。
1.3 数据统计与处理
在接种后第30天统计各处理的数据。用Excel 2007进行数据处理,SPSS 19.0进行方差分析。污染率=(形成愈伤组织的外植体数/接种外植体数)×100%;褐化率=(外植体褐化数/接种外植体数)×100%;存活率=(存活的外植体数/接种外植体数)×100%;诱导率=(诱导数/接种外植体数)×100%;出愈率=(诱导出愈伤组织的外植体数/接种外植体数)×100%;萌发率=(诱导出芽的外植体数/接种外植体数)×100%。
2 结果与分析
2.1 消毒时间对外植体污染率及存活率的影响
3种外植体消毒处理结果表明(表1):随着消毒时间延长,3种外植体污染率都有显著下降(P<0.05)。结合30 d后统计的存活率(图1B),1.0 g·L-1氯化汞溶液消毒5 min为最佳消毒时间,嫩叶污染率仅为33.89%,茎段、带芽茎段分别为25.00%和27.78%,3种外植体之间差异显著(P<0.05)。用30.0 mL·L-1次氯酸钠溶液消毒的外植体褐化情况较轻,但自培养第4天起不断出现污染,污染率较高,且存活率较低(图1A)。

表1 不同消毒药剂及时间对3种外植体污染率的影响Table 1 Effects of different disinfectants and time on the contamination rate of 3 explants

图1 不同消毒药剂及时间处理下的3种外植体存活率Figure 1 Survival rate of 3 explants treated with different disinfectants and time
2.2 不同基本培养基对外植体褐化及诱导的影响
将3种外植体接种于MS,DKW和WPM等 3种不同基本培养基,结果表明(表2):接种于WPM培养基的3种外植体褐化率均低于接种于MS和WPM培养基的褐化率,嫩叶、茎段和带芽茎段的褐化率分别是67.8%,60.0%和61.7%。试验中发现茎段与嫩叶经诱导产生愈伤组织,带芽茎段经诱导易萌发出新芽,其中接种于WPM培养基的外植体生长状况最好,诱导率最高。WPM与其他2种培养基的外植体褐化率与诱导率均差异显著(P<0.05),故以WPM培养基为最适基本培养基。
2.3 不同抗褐化剂预处理对外植体褐化率的影响
表 3 表明:采用 1.0 g·L-1PVP,1.0 g·L-1VC 和 1.0 g·L-1柠檬酸浸泡 3 h 的外植体褐化率都有所下降,其中1.0 g·L-1PVP预处理后的外植体褐化率最低,与对照(ck)差异显著(P<0.05)。3种外植体经1.0 g·L-1PVP预处理后,茎段褐化率为33.3%,显著低于嫩叶褐化率(50.6%)和带芽茎段褐化率(38.9%)(P<0.05)。

表2 不同基本培养基对外植体褐化及诱导的影响Table 2 Effects of different basic culture medium on the browning rate and induction rate of explants

表3 不同抗褐化剂预处理对3种外植体褐化率的影响Table 3 Effects of pretreatment with different anti browning agents on the browning rate of 3 explants
2.4 不同抗褐化剂及质量浓度对外植体褐化率的影响
以未添加抗褐化剂为对照(ck),在培养基中添加不同质量浓度的PVP,柠檬酸和VC后,3种外植体褐化率均低于ck(表4),且与ck差异显著(P<0.05)。添加0.5 g·L-1活性炭后,外植体褐化情况显著下降(P<0.05),但若培养基活性炭质量浓度过高,反而加重外植体褐化。在培养基中添加了不同质量浓度的硫代硫酸钠,3种外植体褐化率随质量浓度上升而上升。由表4得知:2.0 g·L-1PVP为茎段和带芽茎段的最佳抗褐化剂,其褐化率分别为13.3%和16.7%,与其他抗褐化剂有显著的差异(P<0.05)。嫩叶的最佳抗褐化剂为1.0 g·L-1柠檬酸,褐化率为27.4%。嫩叶褐化率与茎段、带芽茎段褐化率差异性显著(P<0.05),茎段与带芽茎段之间差异不显著(P>0.05)。
2.5 不同植物生长调节剂种类及质量浓度对外植体诱导的影响
由6-BA,NAA和2,4-D的极差(R)可知:嫩叶与茎段愈伤组织诱导的主因素分别为2,4-D(11.30)和NAA(20.52)(表 5)。 叶片诱导愈伤组织的最佳培养基组合为 WPM+1.0 mg·L-16-BA+0.2 mg·L-1NAA+0.1 mg·L-12,4-D,出愈率为58.3%,8 d叶片四周产生愈伤组织(图2A)。茎段与叶片启动时间相近,7 d基部膨大并长出少量愈伤组织(图2B),其最佳愈伤组织诱导培养基为WPM+2.0 mg·L-16-BA+0.5 mg·L-12,4-D,出愈率为75.4%,与其他处理间存在显著差异(P<0.05)。
由不同因素的极差(R)可知(表6):影响带芽茎段诱导的主因素为6-BA。经Tukey s-b分析可知:7号和4号处理与其他处理有显著差异(P<0.05),其萌发率分别为76.7%和72.8%。故带芽茎段诱导新芽的最佳组合为 WPM+2.0 mg·L-16-BA+0.5 mg·L-12,4-D, 萌发时间为 8 d(图 2C)。
3 结论与讨论
褐化现象制约着木本植物组织培养的发展,本试验采用单因素试验法,从不同消毒方式、基本培养基、外植体预处理方式、抗褐化剂等4个方面进行研究,寻找降低香港四照花褐化率的有效途径。结果表明:外植体采用1.0 g·L-1氯化汞消毒5 min存活率最高。这与路承香等[9]的研究结果一致,与唐佳佳等[3]在狭叶四照花Dendrobenthamia angustata的研究结果不一致,可能因其选用1年生幼苗更易灭菌。3种外植体接种于WPM培养基中褐化率最低,诱导率相对较高,生长状况最好。推测原因为WPM培养基无机盐总含量较低,减轻了外植体褐变[10]。想从根本上解决组织培养中外植体褐化的问题,还需从分子、遗传等角度对其外植体进行更深入的研究。
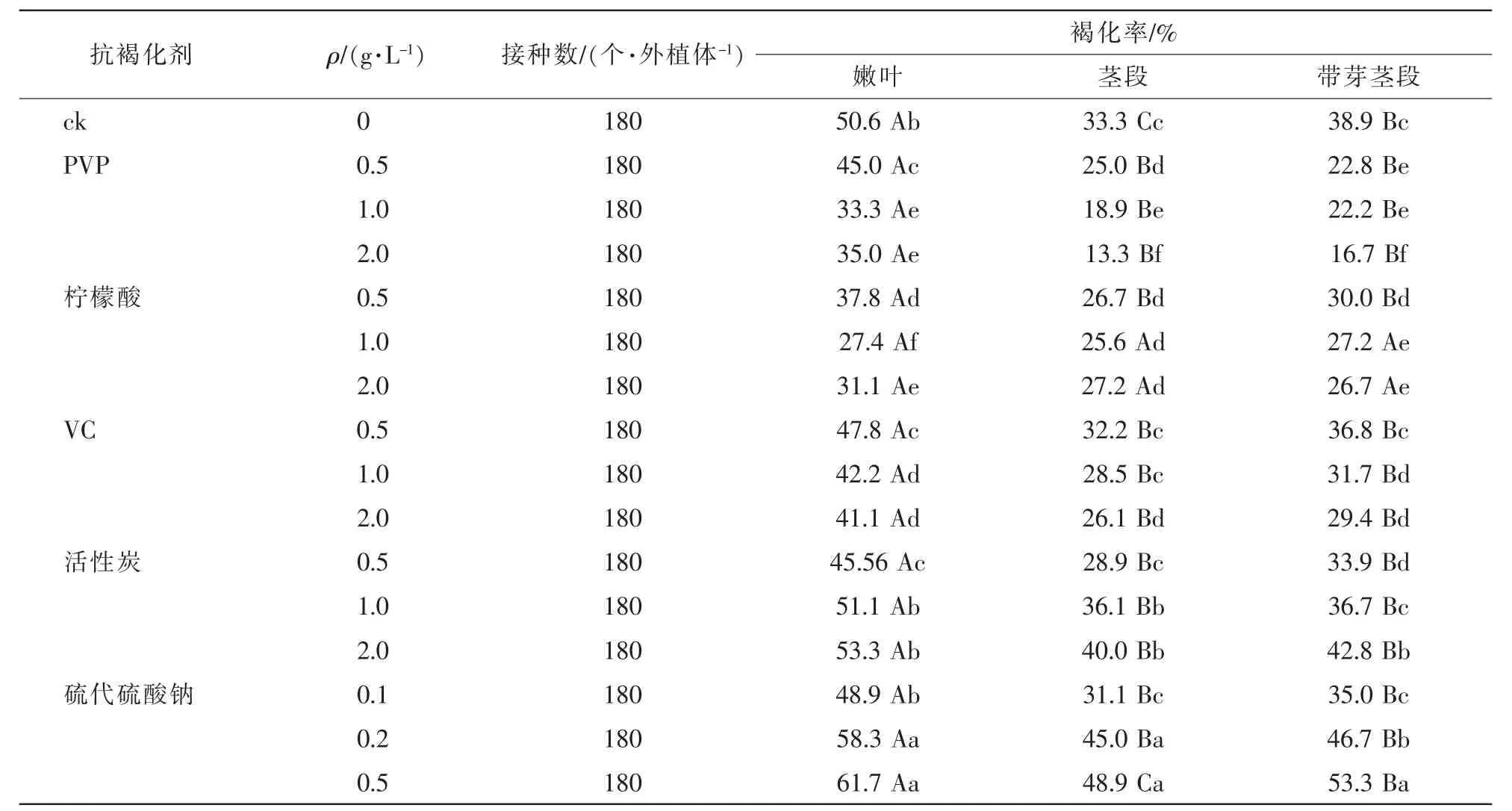
表4 不同抗褐化剂及质量浓度对3种外植体褐化率的影响Table 4 Effects of different concentrations of anti browning agents on the browning rate of 3 explants

表5 不同植物生长调节剂种类及质量浓度对愈伤组织诱导的影响Table 5 Effects of different hormone kinds and concentrations on callus induction
PVP为专一吸附酚类物质的常用吸附剂,能阻止酚类物质被氧化为醌类物质,可降低外植体褐化程度。柠檬酸通过抑制多酚氧化酶的活性来抑制褐化[11]。本研究发现:在接种前用1.0 g·L-1PVP浸泡香港四照花外植体能有效降低褐化率,在培养基中添加2.0 g·L-1PVP能明显减轻茎段与带芽茎段的褐化现象。嫩叶在添加1.0 g·L-1柠檬酸的培养基中褐化率最低,但柠檬酸遇高温会产生酸性物质,影响培养基凝固,故需高压灭菌后用注射器加入,不利于工厂化生产。硫代硫酸钠与柠檬酸活性炭褐化效果不明显,甚至在高质量浓度下加重了外植体褐化。这与在核桃楸Juglans mandshurica[12]和黑莓Rubus[13]上的研究结论不一致,可能因选用基本培养基不同,也可能是不同树种差异性所致。

表6 不同植物生长调节剂种类及质量浓度对带芽茎段诱导的影响Table 6 Effects of different hormone kinds and concentrations on the induction of stem segment with bud

图2 3种外植体的诱导培养Figure 2 Induction of 3 explants
不同的外植体类型对该种植物的诱导培养有很大的影响。试验结果表明:茎段是诱导愈伤组织的最佳外植体,而带芽茎段诱导属腋芽萌发,污染率及褐化率较低,最易萌发产生新芽;叶片褐化率较高,出愈率低于茎段,可能因其分化程度较高;试验中发现少数带芽茎段会在切口处长出奶黄色愈伤组织,但不影响带芽茎段继续萌发,故本试验只统计其萌发率。
植物生长调节剂对外植体的形态建成及其调控起着重要作用。本试验将组织培养中广泛应用的3种植物生长调节剂组合使用,以期寻找最佳诱导培养基。结果表明:嫩叶最佳植物生长调节剂组合为:1.0 mg·L-16-BA+0.2 mg·L-1NAA+0.1 mg·L-12,4-D; 茎段与带芽茎段的最佳激素组合均为: 2.0 mg·L-16-BA+0.5 mg·L-12,4-D。通过对正交试验结果的直观分析,2,4-D和NAA对嫩叶、茎段诱导愈伤组织的影响较大,而6-BA在诱导腋芽萌发具有突出的促进作用[14]。
4 参考文献
[1] 韦直,何业祺.浙江植物志:第3卷[M].杭州:浙江科学技术出版社,1993:388-389.
[2] 中国科学院中国植物志编辑委员会.中国植物志:第56卷[M].北京:科学出版社,1990.
[3] 唐佳佳,刘翠玉,尚旭岚,等.狭叶四照花茎段的离体培养与植株再生[J].中国农学通报,2014,30(22):79-83.TANG Jiajia, LIU Cuiyu, SHANG Xulan,et al.In vitro culture and plant regeneration from stem segments ofDen-drobenthamia angustata[J].Chin Agric Sci Bull,2014,30(22):79-83.
[4] 胡爱双,赵玉辉,刘镇东,等.优良榛资源快繁体系的建立与优化[J].沈阳农业大学学报,2015,46(4):476-480.HU Aishuang, ZHAO Yuhui, LIU Zhendong,et al.Establishment and optimization of rapid propagation system of elite hazelnut resources [J].J Shenyang Agric Univ,2015,46(4):476-480.
[5] 谢志亮,吴振旺.木本植物组培褐化研究进展[J].中国南方果树,2013,42(5):42-46.XIE Zhiliang, WU Zhenwang, Advances in browning of woody plants in tissue culture [J].South China Fruits,2013,42(5):42-46.
[6] 吕宗友,苏衍菁,赵国琦,等.不同防褐化措施对苏丹草愈伤诱导以及抗褐化的效果研究[J].草业学报,2011,20(3): 174-181.LÜ Zongyou, SU Yanqing, ZHAO Guoqi,et al.Effect of anti-browning agent on the sudangrass callus ofSorghum sudanense[J].Acta Pratacult Sin,2011,20(3):174-181.
[7] 刘均利,马明东.华盖木组织培养中褐化控制研究[J].浙江林业科技,2007,27(1):20-23,32.LIU Junli, MA Mingdong.Study on browning of ehdangeredManglietiastrum sinicumin tissue culture [J].J Zhejiang For Sci Technol,2007,27(1):20-23,32.
[8] 李萍,成仿云,张颖星.防褐剂对牡丹组培褐化发生、组培苗生长和增殖的作用[J].北京林业大学学报,2008, 30(2): 71-76.LI Ping, CHENG Fangyun, ZHANG Yingxing.Effects of browning antagonists on antibrowning,growth and multiplication of tissue culture of tree peony [J].J Beijing For Univ,2008,30(2):71-76.
[9] 路承香,李仲芳,王有科,等.峨眉四照花茎尖组织培养技术[J].安徽农业科学,2008,36(4):1416-1418.LU Chengxiang, LI Zhongfang, WANG Youke,et al.Preliminary discussion on tissue culture technology for the stem-tip in the rare and protected plantDendrobenthamia japonicavar.emeinsi[J].J Anhui Agric Sci,2008,36(4):1416-1418.
[10] 邱璐,陈善娜,夏跃明,等.桑树组织培养中褐化问题的研究[J].云南大学学报(自然科学版),2000,22(1): 76-78.QIU Lu, CHEN Shanna, XIA Yueming,et al.Study on browning in tissue culture ofMorus albaL.[J].J Yunnan Univ,2000,22(1):76-78.
[11] 彭思佳,丁力,刘清波,等.抗褐化剂对荻外植体褐化和愈伤组织生长的影响[J].草原与草坪,2015,35(5):7-11,16.PENG Sijia, DING Li, LIU Qingbo,et al.Effect of antioxidant on explant browning and callus growth ofMiscanthus sacchariflorus[J].Grassland Turf,2015,35(5):7-11,16.
[12] 张建瑛,祁永会,吕跃东,等.核桃楸腋芽再生体系研究[J].植物研究,2015,35(1):22-26.ZHANG Jianying, QI Yonghui, LÜ Yuedong,et al.Regeneration system for axillary bud ofJuglans mandshuricaMaxim.[J].Bull Bot Res,2015,35(1):22-26.
[13] 王小敏,吴文龙,李海燕,等.黑莓外植体褐化影响因素分析及适宜培养条件筛选[J].植物资源与环境学报,2009, 18(3): 63-68.WANG Xiaomin, WU Wenlong, LI Haiyan,et al.Analysis of influence factor on browing of blackberry explants and selection of suitable culture condition [J].J Plant Resour Environ,2009,18(3):63-68.
[14] 叶润燕,童再康,张俊红,等.樟树茎段组培快繁[J].浙江农林大学学报,2016,33(1):177-182.YE Runyan, TONG Zaikang, ZHANG Junhong,et al.Tissue culture and rapid propagation for stems ofCinnamomum camphora[J].J Zhejiang A&F Univ,2016,33(1):77-182.
