外源水杨酸甲酯对高温胁迫下茶树光合作用和抗氧化酶的影响
2018-08-16魏吉鹏李鑫王朝阳李洋张兰沈晨颜鹏张丽平韩文炎
魏吉鹏,李鑫*,王朝阳,李洋,3,张兰,沈晨,颜鹏,张丽平,韩文炎*
外源水杨酸甲酯对高温胁迫下茶树光合作用和抗氧化酶的影响
魏吉鹏1,李鑫1*,王朝阳2,李洋1,3,张兰1,沈晨1,颜鹏1,张丽平1,韩文炎1*
1. 中国农业科学院茶叶研究所,浙江 杭州 310008;2. 安康市农业科学研究院,陕西 安康 725000; 3. 河北农业大学园艺学院,河北 保定 071000
近年来茶园高温灾害频发,而关于提高茶树耐热性的研究相对较少。本文以龙井43为试验材料,利用不同浓度水杨酸甲酯(MeSA)喷施茶苗后,在高温环境下(43℃)处理12 h,随后测定茶树叶片的净光合速率(Pn),Rubisco最大羧化速率(Vmax)、RuBP最大再生速率(max),电解质渗透率(EL),丙二醛(MDA)含量以及抗氧化酶活性等相关指标。结果发现,1 mmol·L-1MeSA能够有效缓解高温导致的茶树Pn降低,维持Vmax和max稳定;高温导致茶树叶片EL和MDA含量迅速上升,而适当浓度的MeSA可显著降低高温环境下EL和MDA含量。此外,结果表明1 mmol·L-1MeSA能够提高APX和CAT活性,进而减少H2O2积累,减轻茶树细胞膜过氧化作用。综上所述,外源施用MeSA能够在一定程度上维持高温条件下植物叶片细胞光合系统稳定,提高茶树叶片的抗氧化酶活性,缓解氧化胁迫,最终提高茶树的耐热性。
水杨酸甲酯;茶树;高温胁迫;光合作用;抗氧化酶
茶是世界三大无酒精饮料之一,中国是第一产茶大国[1]。茶树的生长发育对气温和水分要求相对严格。在全球气候变暖的背景下,我国产茶区夏季极端高温、干旱等事件愈来愈频繁。高温干旱影响茶树正常的生长发育,茶树叶面温度过高容易导致气孔关闭,光合能力下降,叶绿素降解,叶片功能丧失[2];严重时导致茶叶萎焉,茶叶品质下降,甚至最终导致茶树死亡,给茶叶生产带来巨大的损失[3]。因此研究茶树应对高温胁迫的生理机制,进而寻找方法提高茶树的耐热性具有重要的科研价值和社会经济价值。
水杨酸(Salicylic acid,SA)和水杨酸甲酯(Methyl salicylate,MeSA)是植物界普遍存在的酚类化合物,SA易于转化为MeSA,两者的生理功能基本一致[4]。研究发现SA在植物气孔开闭、种子萌发、开花、果实生长等生长发育过程中起着重要作用[5]。20世纪90年代,研究人员发现SA同样参与植物应对逆境胁迫的生理过程,SA开始作为植物应对胁迫反应的一种信号分子来研究[6]。目前已有关于SA参与植物抗病、抗盐、抗热、抗旱、抗寒等生理过程的研究报道[7]。
目前的研究发现,MeSA预处理能够修复高温导致的植物叶片光合机构的损坏,维持PSⅡ反应中心结构的稳定,从而在一定程度上维持高温下植物光合作用的持续进行[8]。同时使用MeSA预处理还能提高高温下植物叶片抗氧化酶活性,降低MDA含量及细胞膜过氧化程度,减轻高温强光胁迫导致的氧化损伤[9]。在茶树方面,尽管学术界已经开展了SA参与茶树抗虫性[10],抗寒性[11],抗盐性[12]等研究,但是关于SA对茶树抗热性影响的研究尚未深入开展,尤其是SA对于高温胁迫下茶树叶片光合作用和抗氧化酶的影响还没有研究报道。基于此,本研究选用了龙井43茶苗,通过喷施不同浓度MeSA进行预处理,然后进行高温处理,随后测定茶树光合以及抗氧化酶活性等生理指标,从而探明MeSA对高温胁迫下茶树光合作用和抗氧化酶的影响。
1 材料与方法
1.1 试验材料与处理
试验在中国农业科学院茶叶研究所内进行,试验材料为龙井43茶树品种。试验选择生长状态一致,枝条健壮,无病虫害侵袭的盆栽苗待用。水杨酸甲酯(MeSA)采购自美国Aladdin公司,分别配置成不同浓度(0、0.1、1、5 mmol·L-1)。
在不同浓度的MeSA溶液中加入0.3‰的有机硅后,将其喷施在茶树叶片上,直至叶片滴水为止。随后将喷施不同浓度MeSA的盆栽茶苗均分,分别放入两个不同温度环境的人工气候培养箱中。其中常温处理设置为28℃,高温处理设置43℃。除温度不同外,人工气候箱平均光强均设定为600 μmol·m-2·s-1,光周期为14 h/10 h(昼/夜),相对湿度均控制在80%,CO2体积分数设置为0.04%。连续处理12 h后,测定茶树叶片的光合气体交换参数;随后取一芽及半展叶用于基因表达分析;取一芽二叶样品称重后置于液氮中用于后续生理指标的测定。每个处理3个生物学重复。
1.2 测定项目与方法
1.2.1 光合气体交换测定
利用LI-COR 6400型光合仪(美国LI-COR公司),在光强为600 μmol·m-2·s-1,CO2体积分数为0.04%的条件下测定茶树顶芽向下第三叶片的净光合速率(Pn)。参考Voncaemmerer等[13]的方法测定光合作用CO2响应曲线(A/Ci)后,使用Ethier等[14]的方法计算出Rubisco最大羧化速率(Vmax)以及Rubisco的最大再生速率(max)。每个处理设3个重复。
1.2.2 电导率(EL)的测定
准确称取试样0.1 g装入试管,加蒸馏水20 mL,抽气泵真空抽气1 h,随后振荡混匀并室温静置2 h。静置结束后再次振荡混匀,随后用EC215型数字电导率仪测第1次电导率值(1),然后沸水浴1 h,冷却至室温后测第2次电导率值(2)。
细胞伤害率=1/2×100%。
1和2需转化为25℃时的电导率(25)。
25=t[1 +0.02(-25)]式中,t为实测电导率,为实测温度。
1.2.3 MDA含量测定
采用硫代巴比妥酸法(TBA)法,取茶树叶片组织研磨后取上清液加入10%三氯乙酸(TCA)和0.65%硫代巴比妥酸(TBA)在95℃加热30 min,测定OD532和OD600,计算MDA含量。
1.2.4 H2O2含量测定和DAB染色
H2O2含量测定:根据Okuda T等[15]的方法,取叶片组织0.3 g加入3 mL HClO4研磨后离心,用KOH将pH调至6~7。用活性炭吸附色素后,离心取上清液过滤膜,随后根据Willekens H等[16]的方法测定滤液中H2O2的含量。
DAB染色:配制0.1%二甲基联苯胺(DAB)溶液(含50 mmol·L-1Tris-HCl,pH3.8)后,取茶树自顶芽向下第三片叶片放入其中,25℃条件下光照培养直到叶片上出现深色斑点。随后将叶片放入95%的乙醇中,100℃水浴煮沸15 min,重复这一步骤直到叶片叶绿素完全脱去,进行拍照保存。
1.2.5 APX和CAT活性测定
参考Wang等[17]的方法提取粗酶液,并加以改进。取茶树叶片组织0.3 g加入3 mL 50 mmol·L-1(含0.2 mmol·L-1EDTA)pH7.8缓冲液研磨。将匀浆转入10 mL的离心管中,12 000低温下离心20 min,上清液即为粗酶液。
抗坏血酸过氧化物酶(APX)的活性测定参考Nakano等[18]的方法,并加以改进。取100 μL酶液,加入1 700 μL 25 mmol·L-1PBS(pH7.0,含有0.1 mmol·L-1EDTA),100 μL 20 mmol·L-1H2O2,100 μL 5 mmol·L-1ASA(抗坏血酸)将反应液混合后,测定40 s内OD290的动力学变化,并计算酶活。
过氧化氢酶(CAT)活力测定参照Patra等[19]的方法,并加以改进。取100 μL酶液,加入1 700 μL 25 mmol·L-1PBS(pH7.0,含0.1 mmol·L-1EDTA),200 μL 100 mmol·L-1H2O2。将反应液混合后,立刻测定40 s内OD240的动力学变化,并计算酶活。
1.3 数据分析与处理
试验中各指标均重复测定3次,取其平均值。数据图片用Origin Pro 8.0绘制(Microcal软件公司,美国),并采用SAS 9.0进行差异显著性分析。
2 结果与分析
2.1 MeSA对高温条件下茶树叶片光合作用的影响
高温胁迫会导致茶树光合系统受到破坏,光合酶活性丧失,光合能力下降。净光合速率能够在一定程度上反应光合能力。如图1所示,相对于高温条件,常温条件下茶树光合能力维持在较高水平,各处理组净光合速率(Pn)较高;且常温条件下不同浓度的MeSA处理对茶树光合作用没有显著影响。在高温条件下,对照组未使用MeSA处理,其Pn降低了49.89%;而MeSA预处理能够缓解高温条件下Pn的下降。高温条件下0.1、1.0、5.0 mmol·L-1的MeSA预处理的茶树叶片Pn值比对照分别提高了25.25%、60.58%、和36.02%。其中1 mmol·L-1MeSA能够最大程度缓解高温条件下茶树叶片Pn的抑制作用,与对照组相比效果显著。此外,研究还发现随着MeSA浓度的提高,其作用效果并未呈线性增强,高温条件下施用5.0 mmol·L-1MeSA的茶树叶片Pn只比对照提高了36.02%,缓解效果弱于1.0 mmol·L-1MeSA处理组。

注:图中不同字母代表不同处理间差异显著,P<0.05。下同。
2.2 MeSA对高温条件下茶树叶片Rubisco的影响
Rubisco是光合作用C3碳反应中重要的羧化酶,也是光呼吸中不可缺少的加氧酶,是光合作用中决定碳同化速率的关键酶。在卡尔文循环中,Rubisco的羧化速率(Vmax)和RuBP的再生速率(max)直接影响到暗反应有机物的积累速率。高温会破坏Rubisco的蛋白结构,导致酶活性下降。如图2所示,常温条件下不同浓度MeSA处理对茶树叶片V,max和max没有显著影响;高温条件下,对照组Vmax和max分别降低了31.78%和38.32%,使用0.1、1.0、5.0 mmol·L-1的MeSA预处理的茶树叶片Vmax值比对照组分别提高了7.14%、23.93%、和20.35%,max值比对照组分别提高了12.16%、38.93%、和19.63%。尽管使用MeSA处理均能减少茶树在高温条件下V,max值的降低,其中1.0 mmol·L-1MeSA效果最为明显。同样的,使用1.0 mmol·L-1的MeSA能够最大程度的缓解高温条件下茶树叶片max值的下降,而0.1 mmol·L-1和5 mmol·L-1的MeSA缓解效果紧随其后,两者之间无明显差异。
2.3 MeSA对高温条件下茶树叶片电解质渗透率(EL)和丙二醛(MDA)含量影响
植物细胞的EL和MDA含量均与细胞膜的完整性相关。如图3所示,在常温条件下,不同浓度的MeSA处理对茶树叶片组织的EL和MDA无显著影响。高温处理后,茶树叶片EL值迅速提高,对照组EL提高了2.86倍,达到了28.62%。而施用MeSA能够在一定程度上降低高温条件下的EL,0.1、1.0、5.0 mmol·L-1的MeSA预处理的茶树叶片EL比对照组分别降低了20.72%、33.69%、和38.97%。高温处理同样导致茶树叶片MDA含量升高,高温下对照组MDA含量提高了1.82倍,达到212.69 μmol·g-1。使用0.1、1.0、5.0 mmol·L-1的MeSA预处理的茶树叶片MDA含量比对照组分别降低了9.88%、25.91%、和19.09%。同样1.0 mmol·L-1的MeSA预处理能够最大程度减少高温条件下茶树叶片MDA含量,当浓度达到5.0 mmol·L-1时,其效果有所减弱。
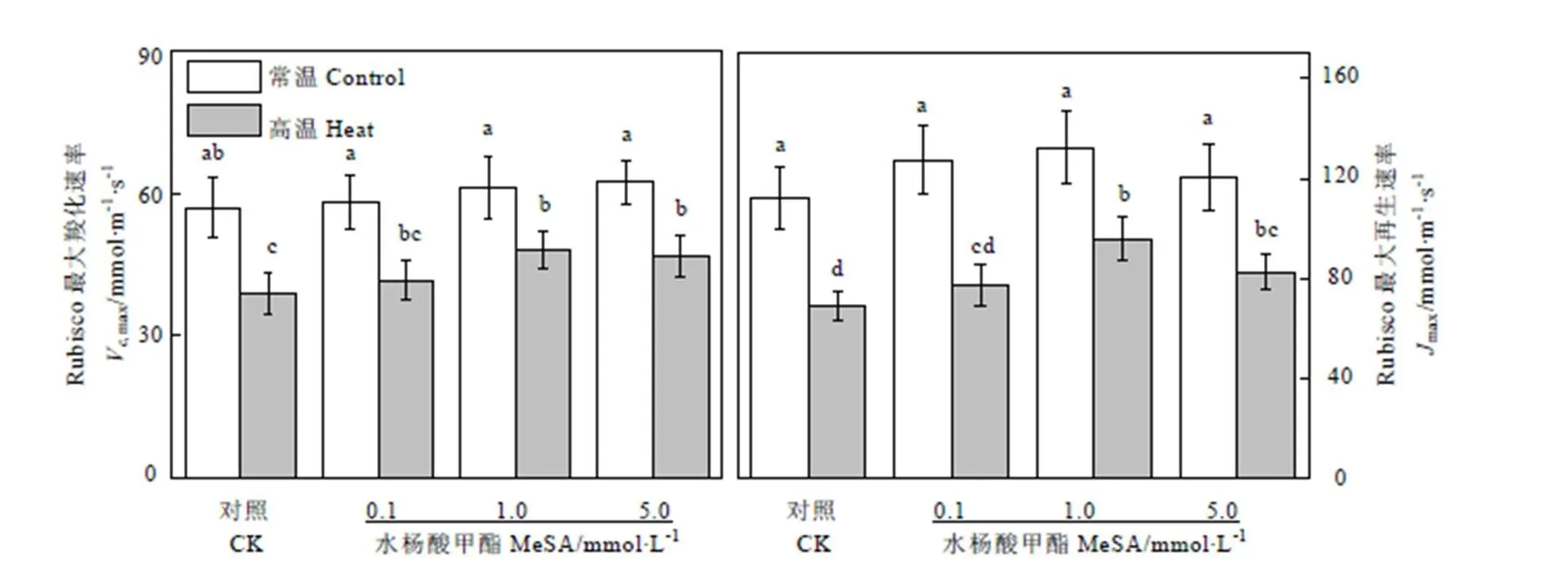
图2 MeSA处理对高温胁迫下茶树Vc,max和Jmax的影响
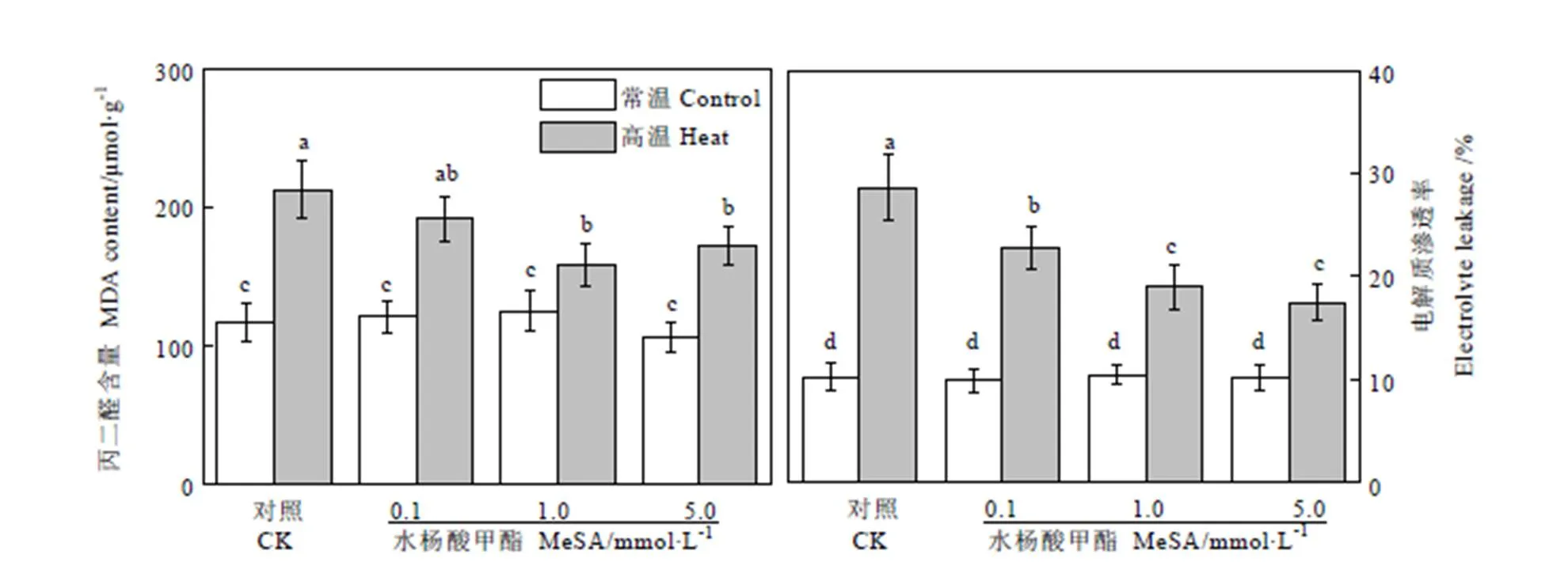
图3 MeSA处理对高温胁迫下茶树MDA和EL的影响
2.4 MeSA对高温条件下茶树叶片H2O2含量影响
H2O2是植物细胞在代谢过程中产生的一种活性氧分子,通过DAB染色后,组织细胞内有H2O2的部位生成金黄色的颗粒物。如图4-A DAB染色所示,在常温条件下茶树自顶芽向下第三叶片无明显的颗粒物,叶片颜色较均匀,呈黄色;在高温条件下,对照组叶片出现大量颗粒物沉淀,这些颗粒聚集后,叶片变为黄褐色。与对照组相比,高温条件下使用MeSA预处理的茶树叶片颗粒物均有所减少。从图中可以看出,高温条件下1.0 mmol·L-1MeSA处理的叶片颗粒物最少,5.0 mmol·L-1与之效果相似,0.1 mmol·L-1次之。
通过生物化学手段测定的H2O2含量与染色结果趋势一致。如图4-B所示,常温条件下茶树叶片组织内H2O2含量较低,喷施不同浓度MeSA的茶树叶片H2O2含量虽然有所差别,但基本维持在58~87 nmol·g-1之间。常温条件下对照组H2O2含量最低,为58.18 nmol·g-1,使用1.0 mmol·L-1MeSA处理的叶片H2O2生成量最高,达到86.35 nmol·g-1。在高温条件下,不同浓度MeSA处理茶树叶片H2O2含量升高到142~193 nmol·g-1之间。对照组在不使用MeSA处理的情况下,茶树叶片H2O2含量最高,达到了192.31 mol·g-1,为常温条件下的3.3倍。随着MeSA浓度升高,H2O2含量逐渐下降。使用0.1、1.0、5.0 mmol·L-1MeSA处理的茶树叶片H2O2生成量分别比对照组减少了7.16%、21.54%和26.02%。
2.5 MeSA对高温条件下茶树叶片抗氧化酶活性的影响
抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)是植物组织细胞内活性氧(ROS)清除系统的重要组成部分,两者均能与活性氧分子反应。如图5所示,与高温条件相比,常温下APX和CAT活性较低。在常温条件下,当MeSA浓度为1 mmol·L-1时,APX活性比对照组提高了24.68%,5 mmol·L-1MeSA处理有相似效果,而0.1 mmol·L-1MeSA处理组茶树叶片APX活性与对照组无明显差异。在高温条件下,各处理组APX活性均有提高。高温下对照组APX活性比常温条件下提高了43.01%;使用MeSA处理能够进一步提高茶树叶片中APX活性,使用0.1、1、5 mmol·L-1MeSA处理的茶树叶片APX活性分别比高温处理下对照组分别提高了12.64%、28.98%和11.83%,由此可见1 mmol·L-1MeSA能够最有效提高高温下茶树叶片APX的活性。
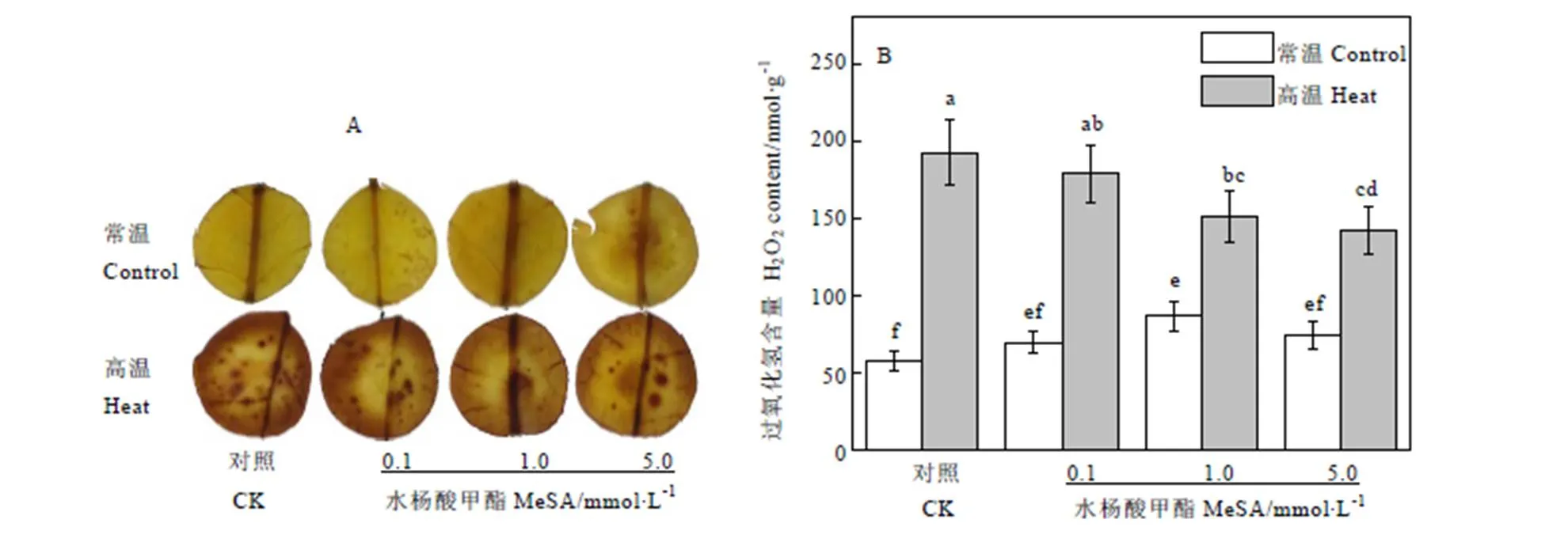
图4 MeSA处理对高温胁迫下茶树H2O2含量的影响

图5 MeSA处理对高温胁迫下茶树APX和CAT的影响
与APX类似,常温条件下使用MeSA处理的茶树叶片CAT的活性与对照组相比均有所增加,其中1 mmol·L-1MeSA处理效果最为显著。高温下茶树APX活性升高,对照组茶树叶片APX的活性在高温条件下达到0.24 μmol·mg-1·min-1,是常温下的1.52倍。高温条件下使用0.1、1.0、5.0 mmol·L-1MeSA处理的茶树叶片APX的活性分别比对照组提高了13.61%、40.33%和8.54%。
3 讨论
李治鑫等[20]的研究结果表明,持续的高温导致茶树叶片颜色改变,甚至枯萎卷曲。将茶树置于43℃条件下持续48 h后,茶树叶片叶绿素逐渐降解,茶树叶片的Fv/Fm呈现明显的下降趋势,ΦPSⅡ明显降低,综合表现为茶树叶片光合能力持续下降。而SA能够提高植物光合作用的研究早有报道。Ananiera等[21]使用大麦苗作为研究材料,发现500 μmol·L-1的SA能提高大麦叶片叶绿素含量与气孔导度,从而提高麦苗的Pn。王利军等[22]研究发现SA能够在一定程度上维持高温胁迫下温洲蜜柑叶片气孔导度,减少Fv/Fm的下降,进而减少Pn值的下降。同样在本研究中高温胁迫下不施用MeSA的茶树Pn比常温条件下的降低了49.89%,这与李治鑫等的研究结果一致。在使用不同浓度的MeSA处理后,高温条件下茶树叶片Pn值均有所提高,且当浓度达到1.0 mmol·L-1时,效果最为明显。这说明SA对高温胁迫下茶树光合机构也能发挥一定的保护作用。
高温胁迫下植物光合作用的降低,现有的研究认为主要由气孔因素和非气孔因素导致[23]。气孔因素主要包括高温导致叶片气孔关闭,光合叶片气孔导度(Gs)下降,使叶绿体内CO2的供应受阻。而在长期的高温胁迫过程中,非气孔因素才是导致植物光合效率下降的主要原因[24]。非气孔因素主要包括光合相关酶活性降低和光合器官损伤。Rubisco是碳同化代谢的关键酶,其初始活力是决定植物光合碳反应能力最直接的内在因素[25]。高温主要是通过影响Rubisco活性来影响光合作用暗反应的进行。研究发现随着温度的升高,Rubisco对CO2的亲合性会逐渐减弱,Vmax下降,导致Rubisco更倾向于加氧反应。随着光呼吸速率增高,光合作用强度减弱,影响了有机物的积累[26]。本研究中使用MeSA处理后,高温下Rubisco的Vmax和max均有所提升,说明SA能够在一定程度上缓解高温对Rubisco活性的抑制,稳定高温下Rubisco对CO2的亲合性,抑制光呼吸,促进有机物的生成,从而增强茶树在高温条件下的光合作用。
植物细胞膜的完整性对维持细胞的微环境和正常的代谢起着重要的作用。在常温条件下细胞膜对物质具有选择透性能力,植物细胞内电解质含量保持稳定。研究发现当植物遭受包括高温在内的逆境胁迫时,植物细胞膜脂容易与活性分子发生过氧化作用,生成大量的MDA[27]。同时MDA还能与细胞膜上结构物质反应,进一步破坏细胞膜的完整性。在高温胁迫下植物细胞膜发生过氧化作用后,细胞膜结构完整性受到破坏,膜透性增大,导致细胞内的电解质外渗,以致植物细胞浸提液的电导率增大[28]。细胞膜完整性越差,膜内电解质外渗越多,电导率越大。因此,MDA含量和电导率的大小能够在一定程度上反映出细胞膜的完整程度。王开冻等[29]研究发现,使用100 μmol·L-1的SA溶液能够有效降低高温条件下南瓜幼苗的EL和MDA含量。吕俊等[30]研究发现0.5 mmol·L-1的SA预处理水稻幼苗,能够降低其在高温胁迫下的电导率和MDA含量,说明SA预处理能够降低膜脂过氧化程度,减缓水稻幼苗电解质的渗出。本研究的试验结果与前人研究相似,喷施不同浓度的MeSA均能有效降低高温胁迫下茶树电导率和MDA含量。说明MeSA能够在一定程度上稳定高温条件下茶树细胞膜脂结构,减少MDA的生成,从而在一定程度上维持了细胞膜的完整性,降低了高温胁迫下茶树电导率。而茶树细胞膜的完整,是进行正常生理代谢的基础。
植物细胞在高温胁迫下会产生过量的H2O2等活性氧类(ROS)物质。过量的H2O2能与植物体内的蛋白质、膜质、DNA及其他细胞组分发生反应,对植物细胞造成伤害,影响生理功能[31]。因此通过降低高温条件下植物H2O2的含量能够提高植物在高温条件下的抗性。Dat等[32]研究发现使用SA处理能够降低芥菜(L)幼苗在高温条件下H2O2的累积量,并显著改善高温下幼苗的生长发育状况。本研究通过生化手段测定了高温胁迫下茶树H2O2的累积量,发现高温同样导致茶树产生过量的H2O2。研究发现使用MeSA预处理能够降低高温下H2O2的累积量,这很有可能是通过增强茶树体内的抗氧化系统来实现的。
当植物在高温下产生过量的ROS分子时,植物体会通过抗氧化系统来清除过量的ROS分子[33]。植物体内主要有两类抗氧化防御系统,即酶类抗氧化和非酶类抗氧化防御系统,其中酶类抗氧化防御系统包括APX和CAT在内的一系列抗氧化酶[34]。APX通过催化抗坏血酸与H2O2分子反应,从而消除过量的H2O2分子,达到保护细胞的作用[35];CAT是一种以铁卟啉为辅基的酶类清除剂,它能够促进H2O2迅速分解为分子氧和水,约占过氧化物酶体40%[16]。Fan等[36]研究发现,外源施用SA后,将榆树置于35℃的高温条件下,分析差异表达基因,发现SA能够上调控制APX和CAT合成相关的基因,促进高温条件下两者的生物合成。杜朝昆等[37]研究发现,使用300 mmol·L-1SA溶液预处理的玉米幼苗,能够提高其体内APX和的CAT活性,从而提高玉米幼苗对高温抗性。而在本研究中,我们发现通过喷施1 mmol·L-1的MeSA能够显著提高茶树体内APX和CAT的酶活,从而提高茶树在高温下对H2O2的清除能力,由此进一步提高茶树对高温的抗性。
在本研究中,我们使用0.1、1、5 mmol·L-1的MeSA处理茶树后进行高温处理,随后检测了各项生理生化指标,通过综合评价我们认为1 mmol·L-1的MeSA能够最为有效维持高温条件下茶树叶片内部Rubisco的活性,提高高温条件下Vmax和max。由此在一定程度上维持茶树在高温条件下暗反应的顺利进行,从而减少茶树Pn的下降。同时通过研究发现,SA能够通过提高包括APX和CAT在内的抗氧化酶活性,提高高温条件下茶树清除H2O2的能力。这在一定程度上减少了ROS对细胞膜的破坏,减轻膜脂过氧化作用,进而降低高温条件下茶树MDA的生成,缓解叶片组织El的升高。因此MeSA能够在一定程度上维持高温条件下茶树细胞膜完整性,维持茶树叶片细胞正常代谢,从而提高茶树对高温的抗性。
尽管MeSA能够提高茶树对高温的抗性,但是具体的信号途径尚不清晰。Slaymaker等[38]研究烟草发现SA能与靶细胞膜上一种受体结合蛋白(SABP)结合,随后影响靶细胞内H2O2含量和Ca2+含量[39]。H2O2和Ca2+作为信号分子进而介导下游的一系列抗性反应。但是这一介导过程的信号途径尚未明确。而Horváth等[40]研究发现,过高浓度的SA本身导致植物大量合成ROS分子,会使植物产生氧化胁迫,反而削弱了植物对于高温等逆境胁迫的抗性。这也可能是导致在本研究中5 mmol·L-1的MeSA处理效果反而不如1 mmol·L-1的MeSA效果明显的原因。由于SA在茶树体内的作用机制研究并不透彻,关于其在茶树高温抗性上的研究相对较少,因此相关问题亟需进一步研究。
[1] 梅峰. 国际茶市现状与中国茶产业发展[J]. 中国茶叶加工, 2009(1): 3-6.
[2] 韩冬, 杨菲, 杨再强, 等. 高温对茶树叶片光合及抗逆特性的影响和恢复[J]. 中国农业气象, 2016, 37(3): 297-306.
[3] 何辰宇, 李蓓蓓, 杨菲. 高温干旱对茶叶生产的影响及应对措施[J]. 江苏农业科学, 2016, 44(4): 215-217.
[4] Paterson J R, Srivastava R, Baxter G J, et al. Salicylic acid content of spices and its implications [J]. Journal of Agricultural & Food Chemistry, 2006, 54(8): 2891-2896.
[5] Klerk G J D, Marinova S, Rouf S, et al. Salicylic acid affects rooting of apple microcuttings by enhancement of oxidation of auxin [J]. Acta Horticulturae, 1997, 447(447): 247-248.
[6] Ogawa D, Nakajima N, Sano T, et al. Regulation of salicylic acid synthesis in ozone-exposed tobacco and[J]. Phyton, 2005, 45(4): 169-175.
[7] 王利军, 战吉成, 黄卫东. 水杨酸与植物抗逆性[J]. 植物生理学报, 2002, 38(6): 619-624.
[8] An C F, Mou Z L. Salicylic acid and it’s function in plant immunity [J]. Journal of Integrative Plant Biology, 2011, 53(6): 412-428.
[9] Wang L J, Li S H. Salicylic acid-induced heat or cold tolerance in relation to Ca2+homeostasis and antioxidant systems in young grape plants [J]. Plant Science, 2006, 170(4): 685-694.
[10] 苗进, 韩宝瑜. 外源水杨酸甲酯(MeSA)处理茶树对茶园主要害虫及其天敌的影响[J]. 生态学杂志, 2011, 30(3): 564 -568.
[11] 杨恕玲, 单守明, 巩传银, 等. 水杨酸对休眠期茶树光合作用和抗冻性的影响[J]. 中国农学通报, 2009, 25(15): 121-124.
[12] 周旋, 申璐, 肖霄, 等. 外源水杨酸对盐胁迫下茶树生长及抗氧化酶活性的影响[J]. 西北农业学报, 2014, 23(6): 127-133.
[13] Caemmerer S V, Farquhar G D. Some relationships between the biochemistry of photosynthesis and the gas-exchange of leaves [J]. Planta, 1981, 153(2): 376-387.
[14] Ethier G J, Livingston N J. On the need to incorporate sensitivity to CO2transfer conductance into the Farquhar-von Caemmerer-Berry leaf photosynthesis model [J]. Plant Cell and Environment, 2004, 27(2): 137-153.
[15] Okuda T, Matsuda Y, Yamanaka A, et al. Abrupt increase in the level of hydrogen peroxide in leaves of winter wheat is caused by cold treatment [J]. Plant Physiology, 1991, 97(3): 1265-1267.
[16] Willekens H, Chamnongpol S, Davey M, et al. Catalase is a sink for H2O2and is indispensable for stress defence in C3 plants [J]. The EMBO Journal, 1997, 24(16): 4806-4816.
[17] Wang S D, Zhu F, Yuan S, et al. The roles of ascorbic acid and glutathione in symptom alleviation to SA-deficient plants infected with RNA viruses [J]. Planta, 2011, 234(1): 171-181.
[18] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts [J]. Plant and Cell Physiology, 1981, 22(1): 867-880.
[19] Patra H K, Kar M, Mishra D. Catalase activity in leaves and cotyledons during plant development and senescence [J]. Biochemie Und Physiologie Der Pflanzen, 1978, 172(1): 385-390.
[20] 李治鑫, 李鑫, 范利超, 等. 高温胁迫对茶树叶片光合系统的影响[J]. 茶叶科学, 2015, 35(5): 415-422.
[21] Ananiera E A, Alexieva V S, Popoval LP. Treatment with salicylic acid decreases the effects of paraquat on photosynthesis [J]. Journal of Plant Physiology, 2002, 159(7): 685-693.
[22] 王利军, 刘允芬, 刘琪璟, 等. 高温干旱胁迫下水杨酸和钾对温洲蜜柑光合作用和叶绿素荧光的影响[J]. 江西科学, 2003, 21(1): 202-205.
[23] 王利军, 黄卫东. 高温胁迫及其信号转导[J]. 植物学通报, 2000, 17(2): 114-120.
[24] 云建英, 杨甲定, 赵哈林. 干旱和高温对植物光合作用的影响机制研究进展[J]. 西北植物学报, 2006, 26(3): 641-648.
[25] Andersson I, Backlund A. Structure and function of Rubisco [J]. Plant Physiology and Biochemistry, 2008, 46(3): 275-291.
[26] Stidham M A, Uribe E G, Williams G J. Temperature dependence of photosynthesis in. II. Contribution from electron transport and photophosphorylation [J]. Plant Physiology, 1982, 69(4): 929-934.
[27] 陈培琴, 郁松林, 詹妍妮, 等. 植物在高温胁迫下的生理研究进展[J]. 中国农学通报, 2006, 22(5): 223-226.
[28] 高京草, 王慧霞, 李西选. 可溶性蛋白、丙二醛含量与枣树枝条抗寒性的关系研究[J]. 北方园艺, 2010(23): 18-20.
[29] 王开冻, 颜志明, 马卫军, 等. 水杨酸对高温胁迫下南瓜幼苗生理生化的影响[J]. 浙江农业科学, 2009(1): 42-45.
[30] 吕俊, 张蕊, 宗学凤, 等. 水杨酸对高温胁迫下水稻幼苗抗热性的影响[J]. 中国生态农业学报, 2009, 17(6): 1168-1171.
[31] Salin M L. Toxic oxygen species and protective system of the chloroplast [J]. Physiology Plant, 1987, 72(1): 681-689.
[32] Dat J F, Lopez-Delgado H, Foyer C H, et al. Parallel changes in H2O2and catalase during thermotolerance induced by salicylic acid or heat acclimation in mustard seedlings [J]. Plant Physiology, 1998, 116(4): 1351-1357.
[33] 范双喜, 谷建田, 韩莹琰. 园艺植物高温逆境生理研究进展[J]. 北京农学院学报, 2003, 18(2): 147-150.
[34] Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 9(7): 405-410.
[35]Willekens H, Langebartels C, Tiré C, et al. Differential expression of catalase genes in(L.) [J]. Proceeding of the National Academy of Sicence of the Unitied States of America, 1994, 91(22): 10450-10454.
[36] Fan M H, Sun X, Xu N J, et al. Integration of deep transcriptome and proteome analyses of salicylic acid regulation high temperature stress in[J]. Scientific Reports, 2017, 7(1): 11052. doi:10.1038/s41598- 017-11449-w.
[37] 杜朝昆, 李忠光, 龚明. 水杨酸诱导的玉米幼苗适应高温和低温胁迫的能力与抗氧化酶系统的关系[J]. 植物生理学通讯, 2005, 41(1): 19-22.
[38] Slaymaker D H, Navarre D A, Clark D, et al. The tobacco salicylic acid-binding protein 3 (SABP3) is the chloroplast carbonic anhydrase, Which exhibits antioxidant activity and plays a role in the hypersensitive defense response [J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(18): 11640-11645.
[39]Polidoros A N, Scalios J G. Role of hydrogen peroxide and different classes of antioxidants in the regulation of catalase and glutathione S-transferase gene expression in maize (L.) [J]. Physiologia Plantarum, 1999, 106(1): 112-120.
[40] Horváth E, Szalai G, Janda T. Induction of abiotic stress tolerance by salicylic acid signaling [J]. Journal of Plant Growth Regulation, 2007, 26(3): 290-300.
Effects of Exogenous Salicylic Acid on Photosynthesis and Antioxidant Enzymes of Tea Plants under HighTemperature
WEI Jipeng1, LI Xin1*, WANG Zhaoyang2, LI Yang1,3, ZHANG Lan1, SHEN Chen1, YAN Peng1, ZHANG Liping1, HAN Wenyan1*
1. Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 2. Ankang Academy of Agricultural Sciences, Ankang 725000, China; 3. The Horticulture College of Hebei Agricultural University, Baoding 071000, China
In recent years, heat stress was more frequently occurred in tea gardens.However, few studies were focused on the approaches towards the improvement of heat tolerance in tea plants. In this study, Longjing 43 was used as experimental material to investigate the effects of various concentrations of MeSA on the net photosynthetic rate (Pn), the maximum carboxylation rate of Rubisco (V,max), the maximum RuBP regeneration rate (max), electrolyte leakage (EL), MDA content and antioxidant enzyme activities in tea leaves under heat stress. Results showed that 1 mmol·L-1MeSA could significantly increase Pn,Vmaxandmaxin tea leaves under heat stress. EL and MDA content in tea leaves increased significantly after heat stress, while the application of MeSA attenuated heat-induced increases in EL and MDA. In addition, the application of 1 mmol·L-1MeSA stimulated the activities ofAPX and CAT, leading to an efficient scavenging of hydrogen peroxide (H2O2) in tea leaves. In summary, we revealed that the applications of MeSA could improve photosynthetic capacity, strengthen the antioxidant system, reduce reactive oxygen species accumulation and lipid peroxidation in tea leaves under heat stress, and thus improve the tolerance of tea plants under heat stress.
salicylic acid, tea plant, heat stress, photosynthesis, antioxidant enzyme
S571.1;Q945.11
A
1000-369X(2018)04-353-10
2017-07-31
2017-10-09
国家重点研发计划政府间国际科技创新合作重点专项(2017YFE0107500)、中国农业科学院科技创新工程(CAAS-ASTIP-2014-TRICAAS)、中国农业科学院茶叶研究所基本科研业务费专项项目(1610212016025)
魏吉鹏,男,硕士研究生,主要从事茶树栽培与生理生化研究。*通讯作者:hanwy@tricaas.com
