甲酸脱氢酶外源表达发酵条件优化及在L-2-氨基丁酸合成中的应用
2018-08-10徐建妙赵哲陈策柳志强
徐建妙,赵哲,陈策,柳志强
(浙江工业大学 生物工程学院, 浙江 杭州,310014)
L-2-氨基丁酸(L-2-aminobutyric acid,L-ABA)可通过酰胺化制备(S)-2-氨基丁酰胺盐,是合成抗癫痫药左乙拉西坦的关键中间体,也可通过还原末端羧基用于制备(S)-2-氨基丁醇,并被用来合成乙胺丁醇[1-2]。目前,L-2-氨基丁酸的合成主要由化学法合成和生物法合成。化学法合成常需要昂贵的试剂,成本较高,工业生产不易采用,同时大量有机溶剂的使用还会造成环境污染[3-4]。生物法包括微生物发酵法和酶转化法,酶转化法是一种高选择性反应,不同种类的酶可作用于不同构型和不同种类的特定底物,从而达到定向转化的目的。目前酶法制备L-2-氨基丁酸主要有两种,一种是对消旋 2-氨基丁酸进行酶法拆分制备[5];另一种是以 2-酮丁酸为原料,通过脱氢酶[6-8]或者转氨酶[9-15]来催化制备。但是由于2-酮丁酸价格较高,直接以其为原料不适合大规模工业生产。目前,比较常用的是用苏氨酸脱氨酶(TD)催化价格相对低廉的L-苏氨酸为2-酮丁酸,同时添加亮氨酸脱氢酶(LDH)在外加NAD+或NADH的基础上,以甲酸脱氢酶(FDH)催化甲酸铵用于辅酶NADH的循环再生(图1)。
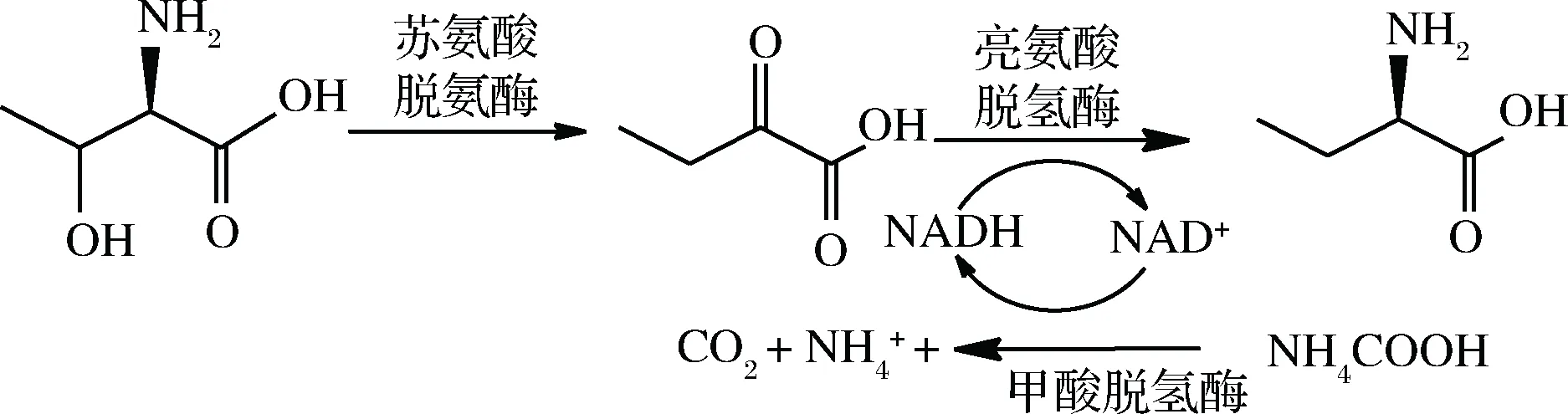
图1 苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶偶联催化合成L-2-氨基丁酸工艺路线Fig.1 Synthesis of L-2-ABA by coupling TD, LDH and FDH
相对于其他NADH辅酶再生体系,甲酸铵/甲酸脱氢酶用于NADH辅酶再生体系优势明显。例如,其反应具有不可逆性,所产生的副产物CO2对反应体系无任何不良影响,也易于后期产品的分离提取[16]。但是,目前报道的不同种类来源的甲酸脱氢酶催化活力普遍较低,蛋白表达的可溶性偏低,底物的转化率不高,不利于后期工业化应用。本论文主要是对实验室构建好的重组菌表达甲酸脱氢酶发酵条件进行优化,用于后续的催化反应,并对催化反应工艺进行探索,以寻找一条底物转化率高,成本低廉并能实现工业化生产L-2-氨基丁酸的生产路径。
1 材料与方法
1.1 材料与试剂
L-苏氨酸(L-Thr),甲酸铵,阿拉丁公司;NAD+, 上海生工。重组大肠杆菌Escherichiacoli-BL21(DE3)/pET28b-FDH (FDH的基因片段来自Fusariumgraminearum),由实验室构建并保藏。
1.2 仪器与设备
高效液相色谱仪,Eclipse XD8-C18(5 μm 4.6 mm×250 mm),美国戴安公司;恒温水浴锅,上海一恒科技;低温离心机,美国Beckman Coulter公司;ME104E型电子天平,Mettler-Toledo仪器有限公司。5 L发酵罐,上海保兴生物设备工程有限公司;恒温培养振荡器,上海智城分析仪器制造有限公司;高压蒸汽灭菌锅,松下健康医疗器械株式会社。多功能酶标仪,Molecular Devices;全自动旋光仪,美国鲁道夫公司。
1.3 实验方法
1.3.1 培养基与发酵条件
LB培养基:蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L;发酵培养基:蛋白胨15 g/L、酵母粉 10 g/L、NaCl 10 g/L、甘油 12 g/L、(NH4)2SO45 g/L 、KHPO41.36 g/L、K2H2PO4·3H2O 2.28 g/L、MgSO4·7H2O 0.375 g/L,在 121 ℃灭菌 20 min,接种时添加无菌的卡那霉素。
种子培养: 从甘油管中吸取50 μL菌液接入装有50 mL LB液体培养基的摇瓶,并加入50 μL质量浓度 50 mg/L卡那霉素,37 ℃,150 r/min恒温培养12 h。
摇瓶培养及诱导:培养基用LB培养基,种子液以1%(v/v)的接种量及100 μL质量浓度为50 mg/L的卡那霉素转接至100 mL LB液体培养基中,在37 ℃,180 r/min的摇床上培养,待OD600值为0.6~0.8时,加入IPTG, 降温诱导培养。结束后,于8 000 r/min,4 ℃,离心10 min收集菌体,将菌体于-20℃保存备用。
发酵培养及诱导: 培养基用发酵培养基,将种子液按 5%接种量接种并添加卡那霉素于发酵培养基,调节pH 7.0,控温37 ℃,搅拌转速450 r/min ,待OD600值为8时降温至22 ℃,加入合适浓度的诱导剂乳糖,继续培养。发酵结束后,发酵液于4 ℃,8 000 r/min离心15 min,收集菌体,-20 ℃保存备用。
1.3.2 分析方法
衍生化条件:50 μL 1% 2,4-二硝基氟苯乙腈溶液、100 μL待测样品以及100 μL 0.5 mol/L的NaHCO3溶液,60 ℃避光反应60 min,进样检测。色谱条件:液相柱 Eclipse XD8-C18(5 μm 4.6 mm×250 mm) ,流动相:0.02 mol/L的磷酸氢二钠(pH=7.2)∶乙腈=70∶30,流速:1.0 mL/min,柱温:30 ℃,检测波长:360 nm。原理:在碱性条件下,氨基酸的游离末端NH2与2,4-二硝基氟苯发生亲核芳环取代反应后,生成黄色的二硝基苯氨基酸衍生物,可用HPLC进行定量测定。
菌体密度测定:菌体密度以OD600表示,将发酵液稀释一定倍数后用紫外分光光度计于600 nm处测定吸光值。菌体破碎液的制备: 发酵所得菌体用 0.1 mol/L、pH 8.5磷酸盐缓冲液悬浮,置于超声破碎仪中破碎。超声破碎条件:工作功率300 W,工作 1 s,间歇 1 s,破碎时间20 min。破碎液于 4 ℃,8 000 r/min离心 15 min,取上清液经Ni柱纯化后用于酶蛋白含量及酶活测定。蛋白含量测定选用凯基BCA蛋白含量检测试剂盒。酶活测定用96孔板检测NADH吸光值(340 nm对应的含量标准曲线作为参照)。1 U酶活定义为pH 7.5,35 ℃下每分钟催化生成1 μmoL NADH所需的酶量。1 L催化反应体系控制搅拌转速500 r/min,恒温35 ℃,开始时投加120 g的L-苏氨酸和120 g的甲酸铵,0.03 g NAD+,3 h添加30 g苏氨酸和0.02 g NAD+,反应6 h添加30 g苏氨酸和0.03 g NAD+,反应8 h在反应中添加0.02 g NAD+。
2 结果与分析
2.1 摇瓶水平对重组菌表达甲酸脱氢酶蛋白的优化
2.1.1 诱导温度的确定
设置16、18、20、22、24、26和28 ℃这7个温度梯度,诱导时间16 h,IPTG浓度0.1 mmol/L。由图2可以看出,温度对外源蛋白的表达影响较大,当诱导温度为16 ℃时,表达的蛋白基本可溶,随着诱导温度的逐渐升高,包涵体也逐渐增多,当诱导温度超过24 ℃时,沉淀中的蛋白含量超过了上清液中的。
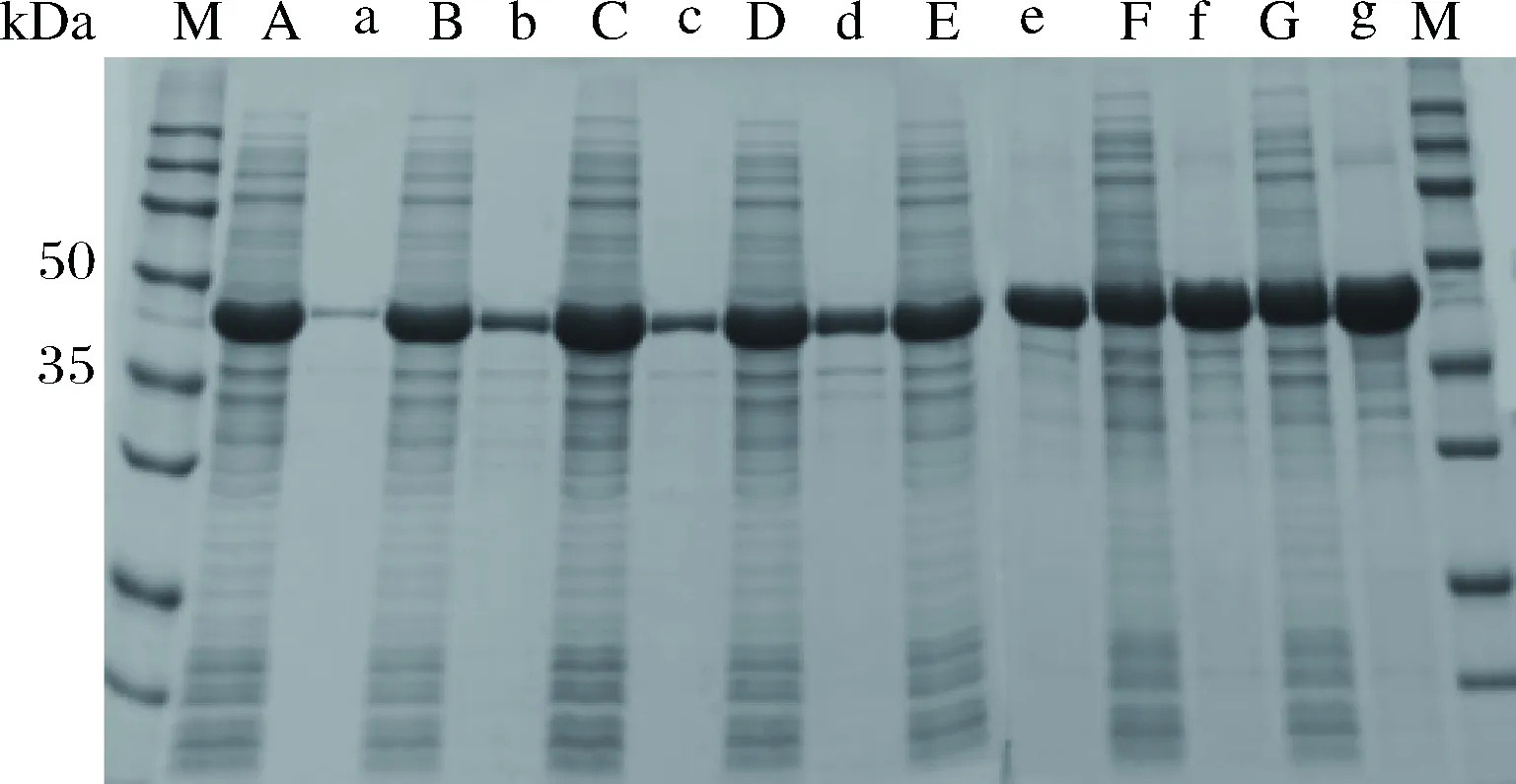
A~G-分别是在诱导温度16、18、20、22、24、26和28 ℃下培养 E. coli BL21-FDH 的菌体破碎上清物;a~g为相对应的沉淀物图2 不同诱导温度下FDH的SDS-PAGE分析Fig.2 SDS-PAGE analysis of FDH at different induced temperatures
随着温度的升高,细胞破碎液上清中的蛋白浓度略有下降,但是沉淀中的蛋白随着温度的升高,明显增加,这也说明随着温度的升高,大部分蛋白都没有得到正确折叠,从而形成了包涵体。取等量的7组菌体破碎液与苏氨酸脱氨酶及亮氨酸脱氢酶粗酶液匹配,外加辅酶NAD+,底物L-苏氨酸,辅底物甲酸铵。图3显示,随着诱导温度的降低,外源表达的甲酸脱氢酶对于催化反应进程有促进。综合考虑选用22 ℃作为后期诱导蛋白表达的合适温度。
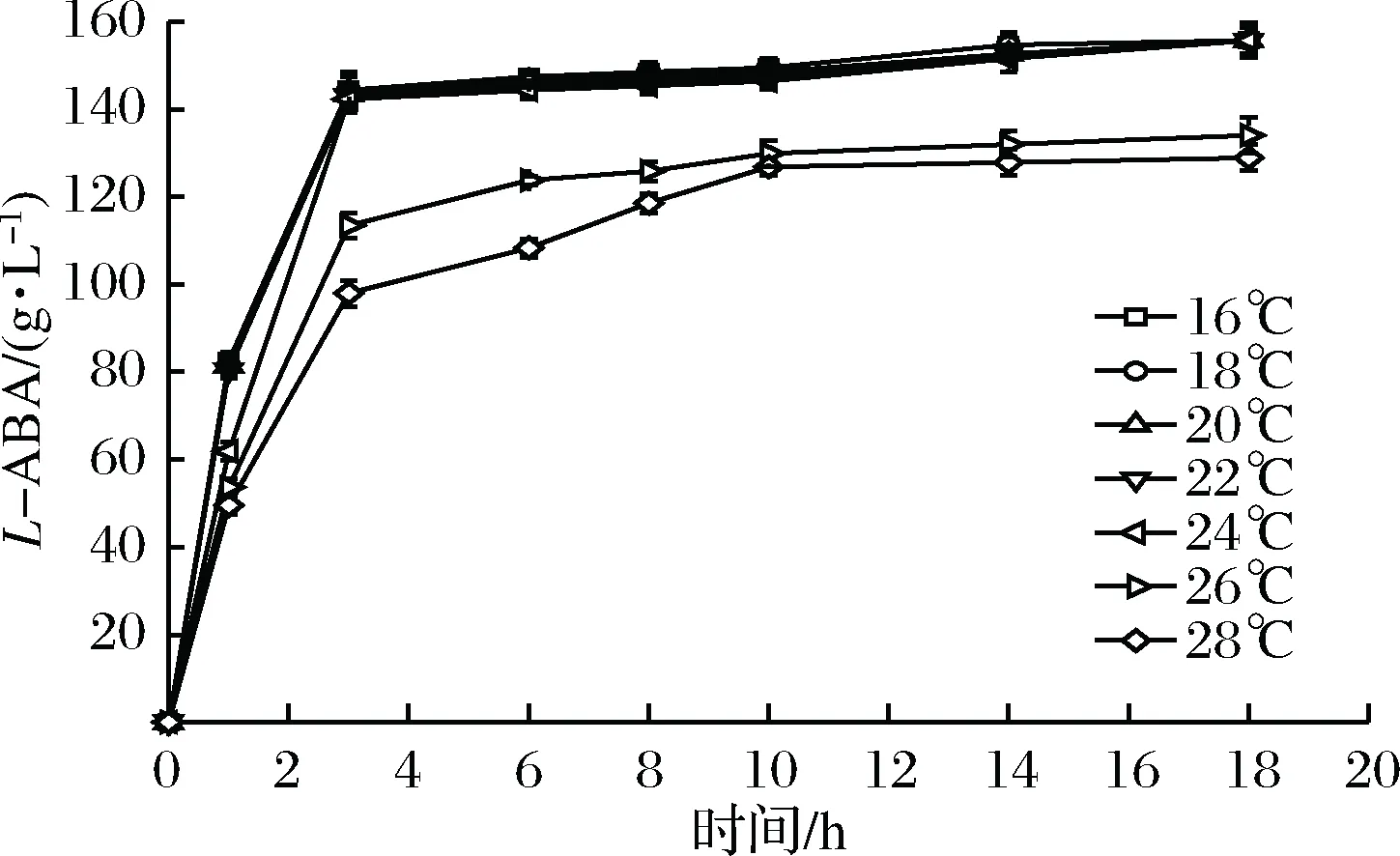
图3 不同诱导温度下表达的甲酸脱氢酶对催化反应进程的影响Fig.3 Time course of production of L-ABA by FDH using different induced temperatures
2.1.2 IPTG诱导浓度的确定
确定诱导温度为22 ℃,设置0.01、0.02、0.05、0.1、0.2和0.5 mmol/L IPTG诱导剂浓度对目的蛋白进行诱导表达,从图4的蛋白胶图可以看出,添加0.01 mmol/L的 IPTG后目的蛋白的表达量相对于其他几组的蛋白表达量较少。随着诱导剂浓度的提高,蛋白表达并没有明显提高。图5的结果也显示,采用0.01 mmol/L的IPTG诱导的菌体用于催化反应,底物转化率只有70%,但是过高的浓度也不会有效促进催化反应的进程。综合考虑选用0.1 mmol/L IPTG作为后期诱导蛋白表达的诱导剂。
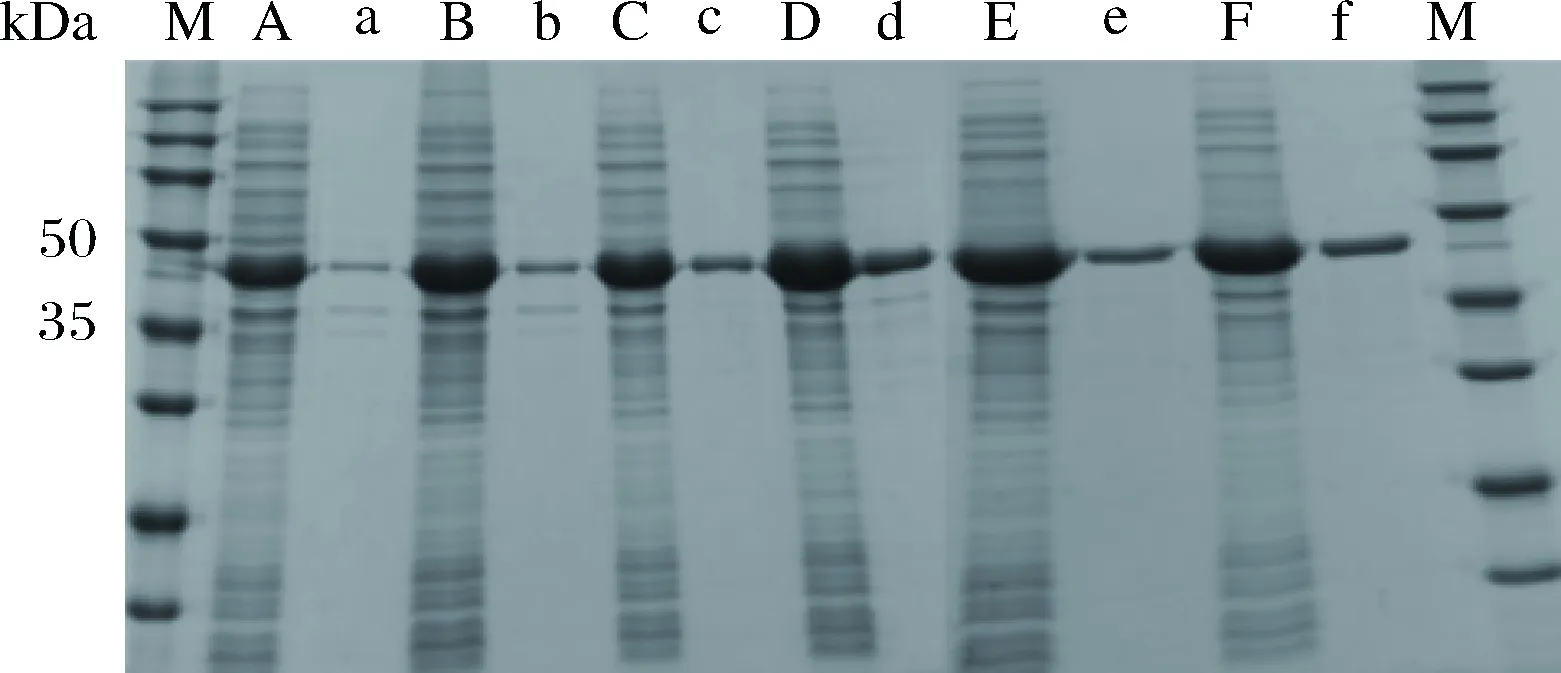
A~F-分别是在诱导剂浓度0.01、0.02、0.05、0.1、0.2和0.5 mmol/L下培养E. coli BL21-FDH 的菌体破碎上清物; a~f-相对应的沉淀物图4 不同诱导剂浓度下FDH的SDS-PAGE检测Fig.4 SDS-PAGE analysis of FDH at different inducer concentrations
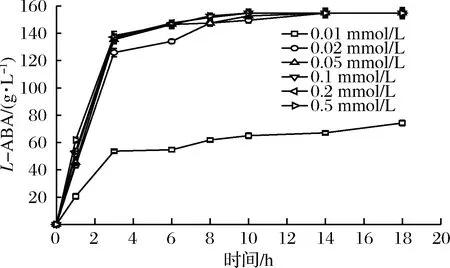
图5 不同浓度IPTG诱导下表达的甲酸脱氢酶对催化反应进程影响Fig.5 Time course of production of L-ABA by FDH using different IPTG concentration
2.1.3 诱导时间的确定
确定诱导温度22 ℃,诱导剂IPTG浓度0.1 mmol/L ,设置诱导时间8、10、12、14、16、18和20 h。图6表明随着诱导时间的延长,目的蛋白的表达量也随着增加。然而,包涵体也随之增多。图7随着目的蛋白诱导时间的延长,一定程度上利于催化反应进程的进行。当诱导时间大于16 h,其催化反应进程不会随着诱导时间的延长而明显变化。综合考虑选用16 h诱导时长作为后期诱导蛋白表达的时间。
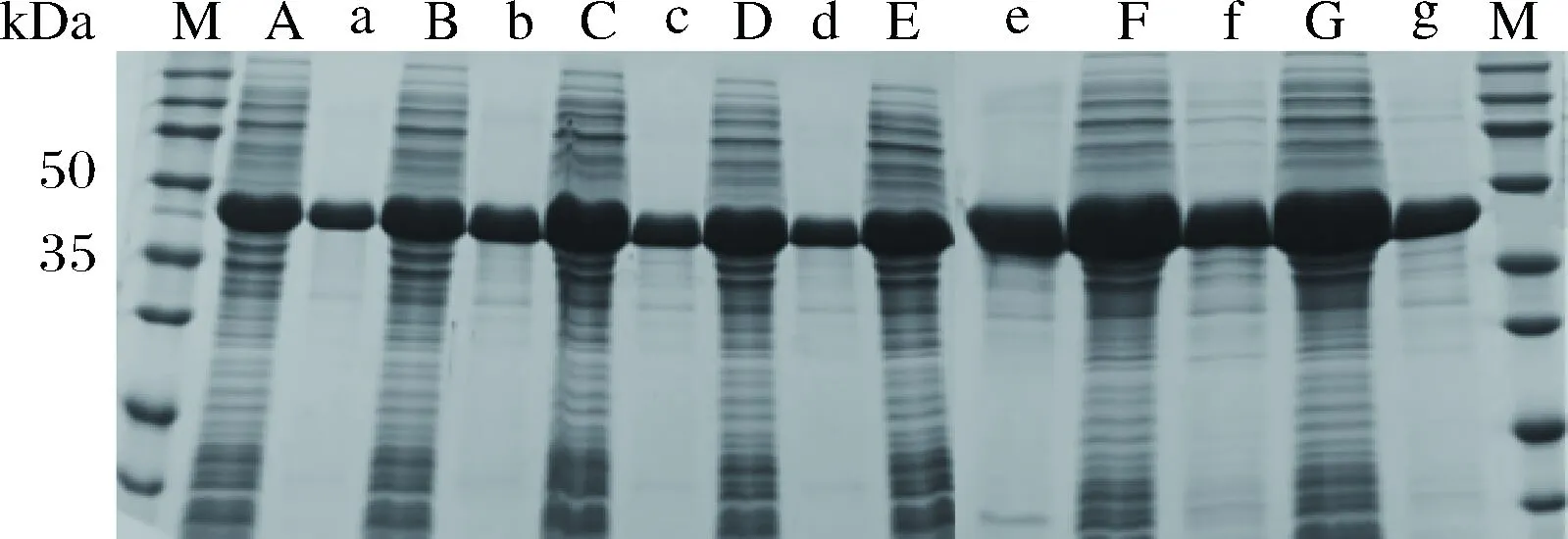
A~G-分别是在诱导时长8、10、12、14、16、18和20 h下培养 E. coli BL21-FDH 的菌体破碎上清物;a~f-相对应的沉淀物图6 不同诱导时间下FDH的SDS-PAGE检测Fig.6 SDS-PAGE analysis of FDH in different induction time
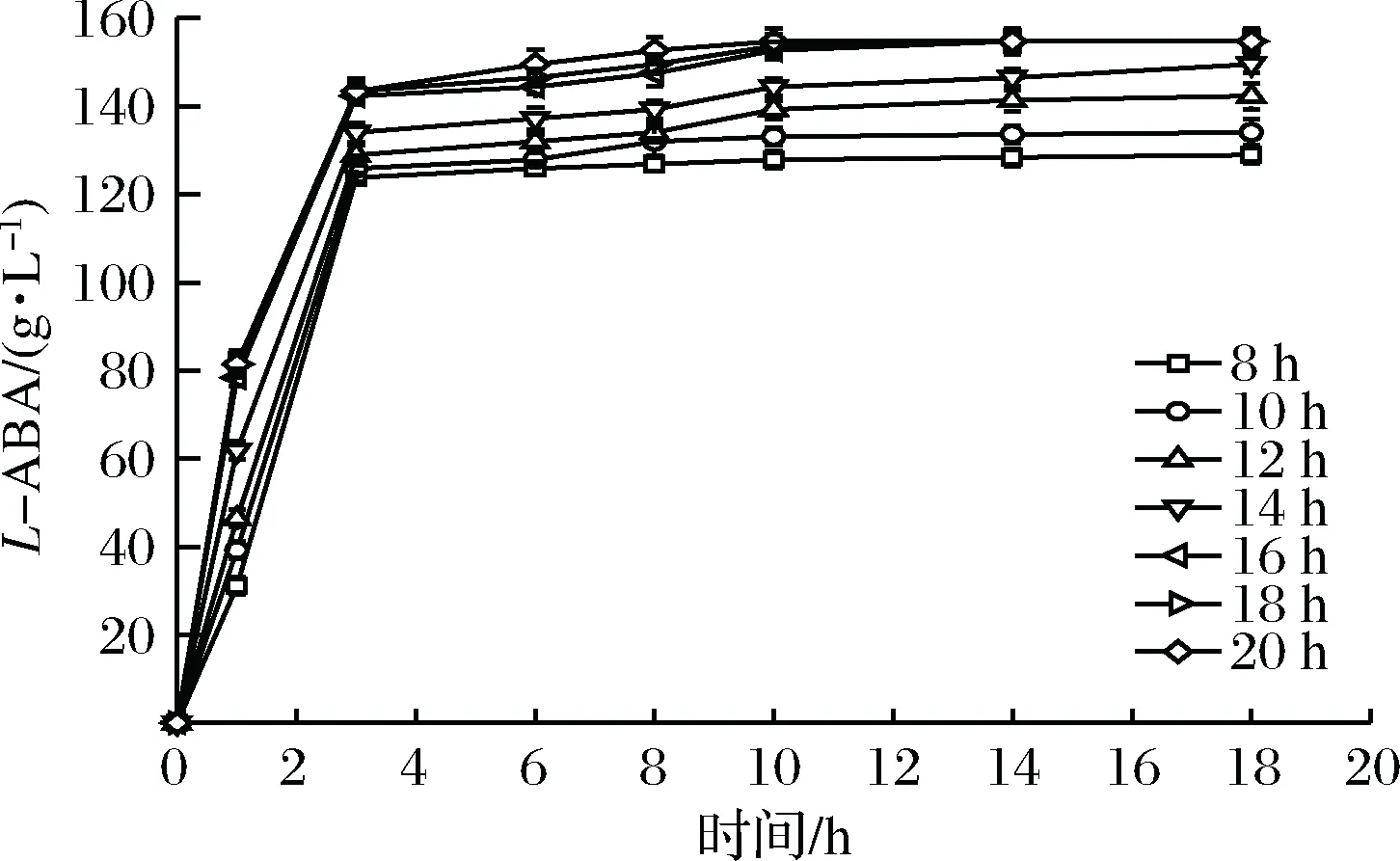
图7 不同诱导时间诱导表达的甲酸脱氢酶对催化反应进程的影响Fig.7 Time course of L-ABA production by FDH at different induction time
经摇瓶水平优化后甲酸脱氢酶的酶活为7.16 U/mg,相对于原始菌株摇瓶培养蛋白酶活6.88 U/mg并没有显著提高,然而可溶性目的蛋白表达量为52.12 mg/g,相对于原始菌株摇瓶培养蛋白表达量40.12 mg/g提高29.91%(图8)。
1-原始菌株;2-摇瓶优化图8 纯化后的甲酸脱氢酶SDS-PAGE结果Fig.8 SDS-PAGE analysis of purified FDH
2.2 5 L发酵罐水平对重组菌表达甲酸脱氢酶蛋白的优化
2.2.1 不同乳糖浓度诱导表达产生的甲酸脱氢酶对催化反应进程的影响
用质量浓度分别为5、8、10、12.5、15、18 g/L的乳糖诱导外源甲酸脱氢酶蛋白的表达。由图9可以看出,5 g/L的乳糖添加,8 h目的酶蛋白催化底物转化率可达到88%左右,18 h催化底物转化率可达到95%左右。随着乳糖质量浓度增加,前期催化底物能力略有下降,后期皆能使底物完全转化。故选用乳糖质量浓度为8 g/L。
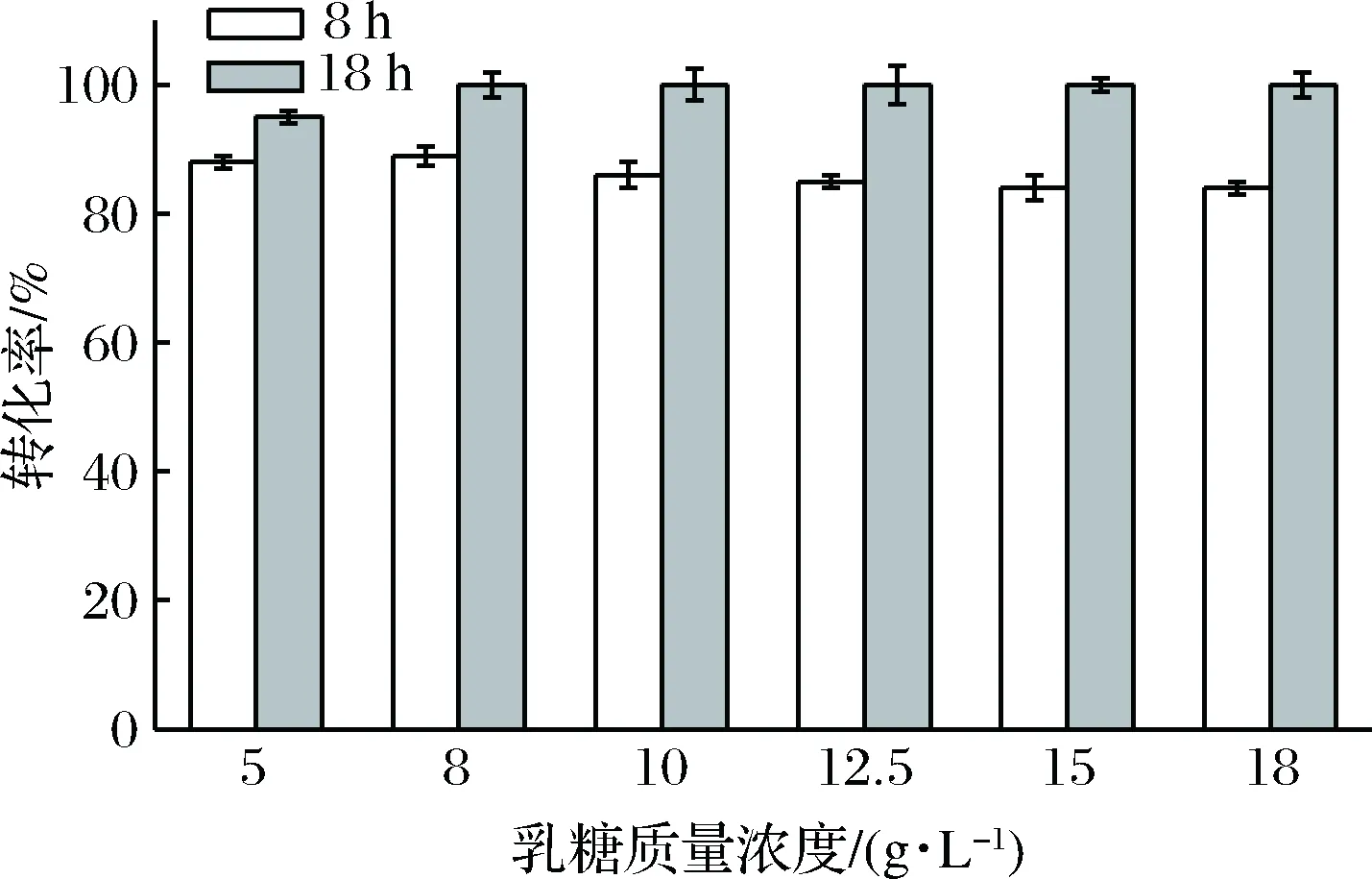
图9 不同乳糖浓度诱导表达产生的甲酸脱氢酶对催化活力影响Fig.9 Effect of lactose on FDH catalysis activity
2.2.2 不同诱导时间诱导表达产生的甲酸脱氢酶对催化反应进程影响
一般而言,外源蛋白在重组菌中会随着诱导时间的延长,蛋白的表达量会有一定程度的增加。在5 L发酵罐培养菌体过程中,分别在诱导后8、10、12、14、16、18、20 h取样检测。由图10可以看出随着诱导时间的增加,目的酶蛋白的催化能力也随着增加,16 h后基本趋于稳定。故选用诱导时间16 h。
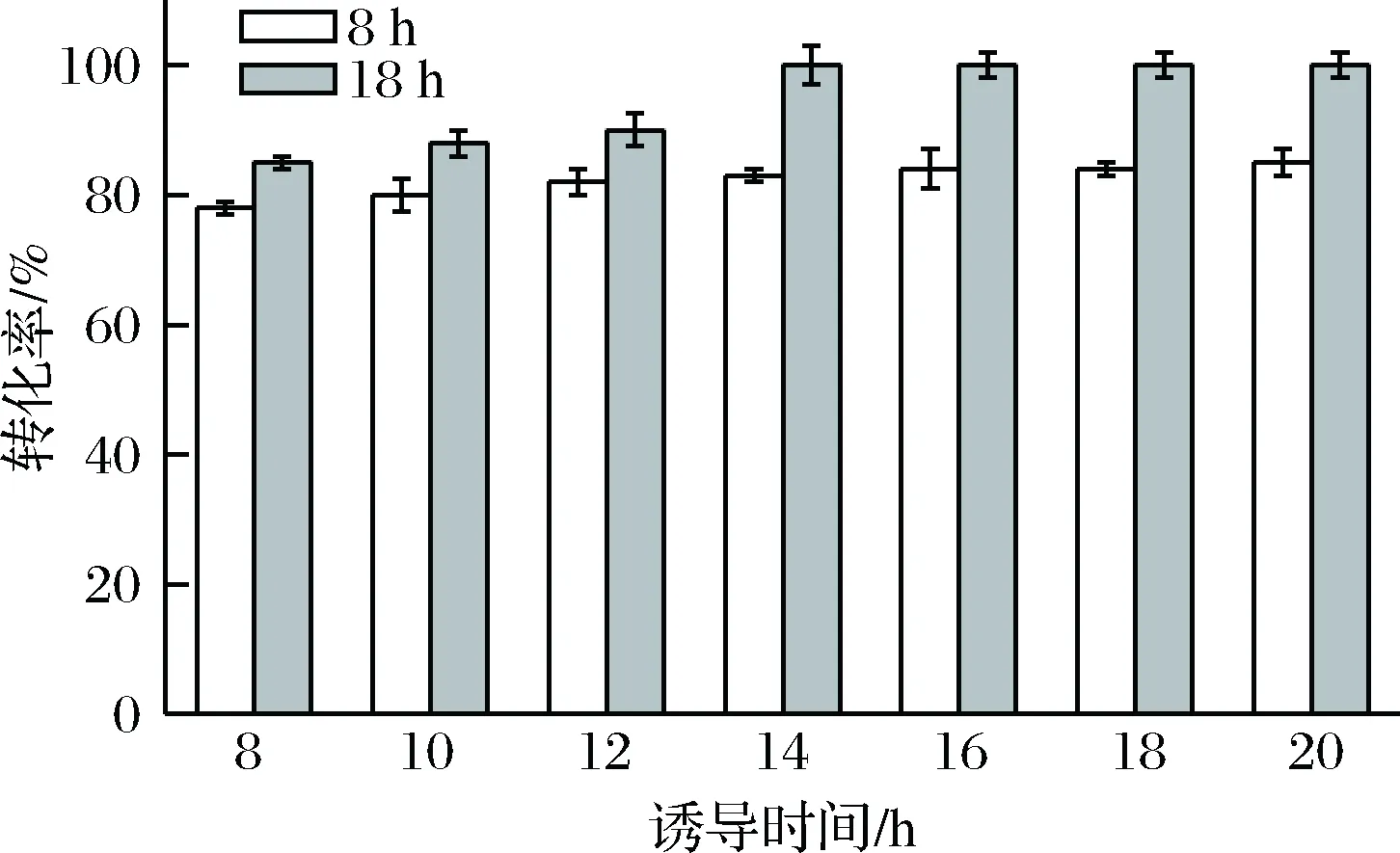
图10 不同诱导时间诱导表达产生的甲酸脱氢酶对催化活力的影响Fig.10 Effect of induction time on FDH catalysis activity
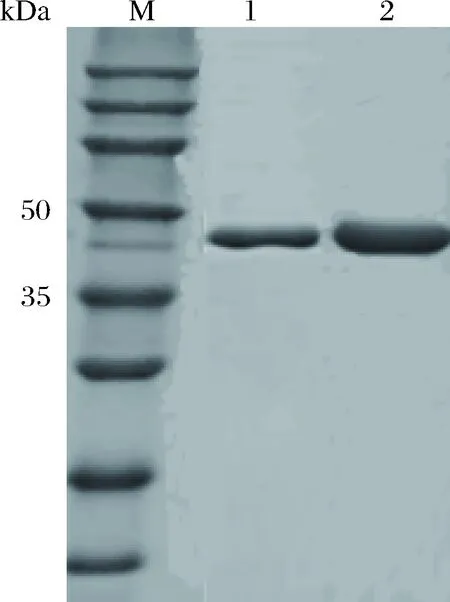
在5 L发酵罐水平上对外源甲酸脱氢酶蛋白发酵条件进行优化(见图11)。结果表明,目的蛋白在诱导温度22 ℃,诱导剂乳糖质量浓度8 g/L,诱导16 h下可溶性目的蛋白表达量为41.26 mg/g,相对于原始菌株发酵罐培养蛋白表达量为34.15 mg/g,提高20.82%。甲酸脱氢酶优化后的酶活为6.12 U/mg,相比于原始菌株发酵培养得到目的蛋白酶活5.88 U/mg略有提高。

1-原始菌株;2-发酵罐优化图11 纯化后的甲酸脱氢酶SDS-PAGE结果Fig.11 SDS-PAGE analysis of purified FDH
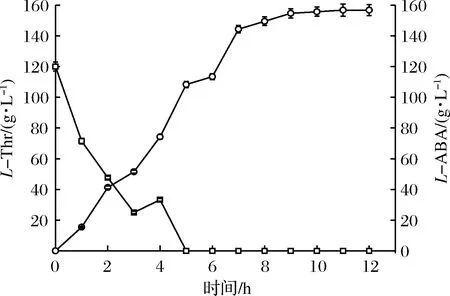
图12 三酶偶联催化合成L-2-氨基丁酸进程Fig.12 Time course of production of L-ABA by FDH coupling with TD and LDH
图12表明,在1 L反应体系中,利用优化后的甲酸脱氢酶,耦合苏氨酸脱氨酶和亮氨酸脱氢酶,底物L-苏氨酸180 g,在9 h完全被转化为L-2-氨基丁酸,转化率99%以上,e.e.值99.5%以上,时空产率17.2 g/(L·h)。
3 结论
本文分别在摇瓶及5 L发酵罐水平对重组甲酸脱氢酶工程菌的外源表达条件进行优化。结果表明:当诱导温度为22 ℃,IPTG浓度为0.1 mmol/L(摇瓶培养)、乳糖质量浓度8 g/L(发酵罐培养),诱导时间16 h时,有利于甲酸脱氢酶的外源表达。在5 L发酵罐水平目的蛋白由34.15 mg/g提高到41.26 mg/g,酶活由5.88 U/mg提高到6.12 U/mg。从研究结果可以看出,温度是影响目的蛋白的可溶表达的最大因素,诱导时间对目的蛋白表达量具有比较显著的影响,相对而言诱导剂的浓度对目的蛋白的影响并不显著。利用5 L发酵罐培养获得的菌体经破碎获得的甲酸脱氢酶粗酶液匹配苏氨酸脱氨酶粗酶液,亮氨酸脱氢酶粗酶液,在1 L反应体系中外加NAD+0.1 g, 底物L-苏氨酸180 g,辅底物甲酸铵120 g,辅酶NAD及底物L-苏氨酸分别采用分批添加策略,9 h左右底物L-苏氨酸几乎完全转化为L-2-氨基丁酸。相比于一次性添加底物L-苏氨酸及辅酶NAD+而言催化反应进程明显缩短,底物催化浓度明显提高,底物转化率99%以上,时空产率17.2 g/(L·h),e.e.值99.5%以上。反应底物浓度及时空得率均高于目前报道水平。本课题所采用的生产工艺及结果为后续L-2-氨基丁酸的工业化提供一定的参考依据。
