IBDV细胞适应株的驯化及其VP2基因的分子特征分析
2018-08-10王洁琼赵玉杰周薇帆周云飞陈田田刘建勋李新生
王洁琼,赵玉杰,周薇帆,周云飞,陈田田,刘建勋,李新生
(河南农业大学 牧医工程学院,河南 郑州 450002)
传染性法氏囊病(infectious bursal disease,IBD)是一种可以诱发雏鸡产生急性、高度接触性和免疫抑制的传染病,该病首先在美国特拉华州甘布罗镇出现,故又被称为“甘布罗病”。由于死于该病的鸡肾脏受损,最初被称为“禽肾病”,但后来被正式命名为鸡传染性法氏囊病(IBD)[1-2]。
传染性法氏囊病毒(IBDV)属双股RNA病毒科禽双股RNA病毒属,病毒颗粒为单层衣壳结构,无囊膜,是典型的六边形结构,呈正二十面体。IBDV有2个血清型,其中对鸡有致病性的血清Ⅰ型毒株又分为经典毒株(classical IBDV,cIBDV)、减毒株(attenuated IBDV)、变异毒株(variation IBDV,vIBDV)和超强毒株(very virulent IBDV,vvIBDV)[3]。IBDV超强毒株的出现,严重威胁着世界养禽业的发展,被世界卫生组织(OIE)列为“影响社会经济的重要疾病”[4]。有研究表明,IBDV的VP2蛋白是主要的宿主保护性抗原,与病毒中和抗体的诱导、抗原和毒力的变异以及细胞的凋亡密切相关[5-6]。VP2蛋白的氨基酸变异对病毒侵染宿主靶细胞的过程至关重要,是影响IBDV细胞嗜性和毒力差异的主要因素。因此,对不同毒株的VP2进行氨基酸序列分析,不仅有助于了解毒株之间的亲缘关系,分析IBD的流行特点,还能为其病原抗原性和毒力的研究积累资料。本研究对从河南某地区鸡群分离出的1株IBDV进行驯化,使其适应永生细胞DF-1,并对其VP2基因进行克隆和生物信息学分析,从氨基酸序列及系统进化树方面分析探讨了毒株间基因变异的分子机制,旨在为筛选到免疫原性良好的IBD疫苗株奠定基础。
1 材料与方法
1.1 材 料
1.1.1 毒株、SPF鸡胚和细胞 IBDV毒株X1分离自河南某地区鸡群的发病鸡中。SPF鸡胚购自北京梅里亚维通实验技术有限公司。DF-1细胞购自中国兽医药品监察所。鸡胚成纤维细胞(CEF细胞)应用10日龄SPF鸡胚制备。
1.1.2 主要试剂 LATaq酶、DNA Marker 5000、MiniBEST Viral RNA/DNA Extraction kit Ver 5.0、M-MLV反转录酶、T4 DNA连接酶、限制性内切酶,均购自宝生物工程(大连)有限公司;普通琼脂糖凝胶DNA回收试剂盒、大肠杆菌DH5α感受态细胞,购自天根生化科技(北京)有限公司;大肠杆菌(E.coli) BL21(DE3),由本实验室保存;高纯度质粒小提试剂盒,购自康为世纪生物科技有限公司;pGEM-T Easy Vector,购自Promega公司。
1.1.3 引物设计合成 参照GenBank上已登录的IBDV UK661株A片段mRNA序列(X92760),利用Oligo 7.0软件分析并设计1对引物,扩增产物长度为1 756 bp的包含VP2全长基因的片段。引物序列为:上游引物P17.5′-GAACTCCTCCTTCTACAATGCT-3′;下游引物P56.5′-TCGTGATGACCACAGGGAATAG-3′。引物由华大基因合成。
1.2 IBDV X1株鸡胚半数致死量(ELD50)的测定
IBDV X1毒株在SPF鸡胚上稳定传代后,将鸡胚绒毛尿囊膜研磨液上清液进行10倍梯度稀释,选取10-5,10-6,10-7,10-8,10-95个稀释度,经绒毛尿囊膜途径接种10日龄SPF鸡胚,每个稀释度病毒接种5枚鸡胚,接种量均为0.1 mL/枚,于37 ℃孵化器内孵化,剔除24 h内死亡鸡胚,至144 h时记录各组鸡胚死亡情况及胚体病变情况,按文献[7]中介绍的Reed-Muench法计算尿囊膜悬液中病毒的ELD50。
1.3 IBDV X1株的DF-1细胞适应性驯化
法氏囊组织的处理参照文献[8]进行,取按照上述方法得到的上清液,参照文献[9]将IBDV X1株经绒毛尿囊膜途径接种10日龄SPF鸡胚,收集48~120 h内死亡鸡胚,研磨后如上继续传代。取传至第8代的IBDV鸡胚毒用PBS按照1∶200体积比稀释,接种按常规方法制备长成单层的CEF细胞,于37 ℃ CO2培养箱吸附1 h后弃去病毒液,加入维持液,于培养箱中培养,每天观察,待80%细胞出现病变(培养72~96 h)时传代,共传10代。取传至第10代的IBDV CEF细胞毒接种DF-1细胞,依上述方法连续传代,每天观察细胞病变。
1.4 IBDV X1株细胞适应株的电镜观察
将细胞毒冻融3次,4 000 r/min离心20 min,取上清液10 000 r/min离心1 h,弃去沉淀,取上清液38 000 r/min超速离心1 h,弃上清液,将沉淀用少量pH 7.4的0.01 mol/L PBS悬浮,制备负染样品。用悬浮法吸附10 min后用质量分数2%磷钨酸染色5 min,使用Hitachi HT 7700透射电子显微镜进行观察。将获得的细胞适应株命名为C1。
1.5 IBDV RNA的提取及cDNA的合成
将X1毒株的病毒上清液经0.22 μm滤器过滤除菌后,以CAM途径接种10日龄SPF鸡胚,每胚0.2 mL,弃去24 h内死亡鸡胚,收获48~120 h内死亡鸡胚,观察鸡胚死亡状况,并无菌收取绒毛尿囊膜,研磨至匀浆,反复冻融3次后5 000 r/min离心10 min,取上清液。按MiniBEST Viral RNA/DNA Extraction kit Ver 5.0说明书提取RNA。
将收获的C1株DF-1细胞毒的病毒液反复冻融3次,3 500 r/min离心20 min,取上清液。按MiniBEST Viral RNA/DNA Extraction kit Ver 5.0说明书提取RNA。
用下游引物P56(浓度为25 μmol/L)将上述2种RNA反转录合成cDNA。具体操作为:取10 μL RNA提取物,加入1 μL下游引物P56,70 ℃水浴10 min,冰浴5 min,加入dNTP 1 μL 、反转录酶M-MLV 0.5 μL、5×M-MLV Buffer 4 μL、RNasin 0.5 μL、ddH2O 3 μL,42 ℃反应1 h,最后75 ℃ 15 min使反转录酶失活。
1.6 VP2基因的克隆
以cDNA为模板对VP2基因进行PCR扩增。扩增体系为:cDNA 2 μL,LATaq酶12.5 μL,P17(25 μmol/L) 0.5 μL,P56(25 μmol/L) 0.5 μL,ddH2O 9.5 μL。PCR反应程序为:95 ℃预变性5 min;94 ℃变性50 s,53 ℃退火50 s,72 ℃延伸2 min,总计34个循环;最后72 ℃延伸10 min。
将PCR产物用1%琼脂糖凝胶电泳分离,目的片段用普通琼脂糖凝胶DNA回收试剂盒回收,操作按说明书进行。将回收产物与pGEM-T Easy载体16 ℃过夜连接后,按常规方法转入大肠杆菌DH5α感受态细胞。进行蓝白斑筛选,挑取生长状态良好的菌落接种于含50 mg/L氨苄青霉素(Amp)的LB培养基中进行扩增培养,以4 μL培养菌液为模板,进行PCR鉴定(反应体系和反应程序同1.6节)。将鉴定阳性的菌液用高纯度质粒小提试剂盒提取其质粒,送至武汉奥科鼎盛生物科技有限公司测序。
1.7 序列分析
用DNA Star和MEGA 6.0软件将测序所得结果与GenBank上登录的17个IBDV序列(表1)进行同源性分析,并构建遗传系统进化树。同时应用Clustalx软件对它们的VP2基因高变区推导的氨基酸序列与这17个IBDV参考毒株进行比对分析。
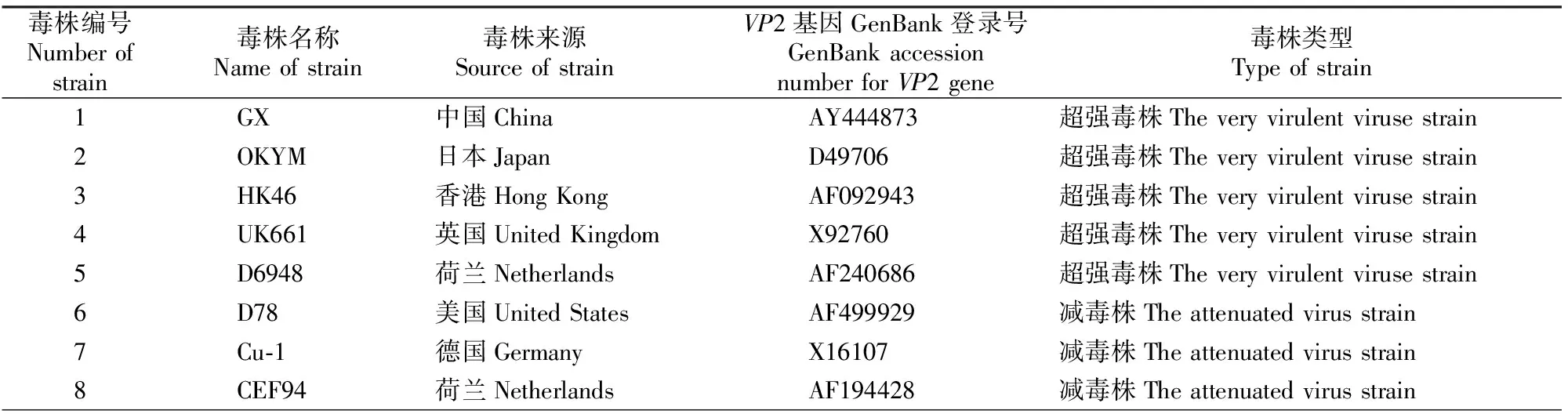
表1 IBDV参考毒株及其GenBank登录号Table 1 IBDV reference strain and its GenBank accession number
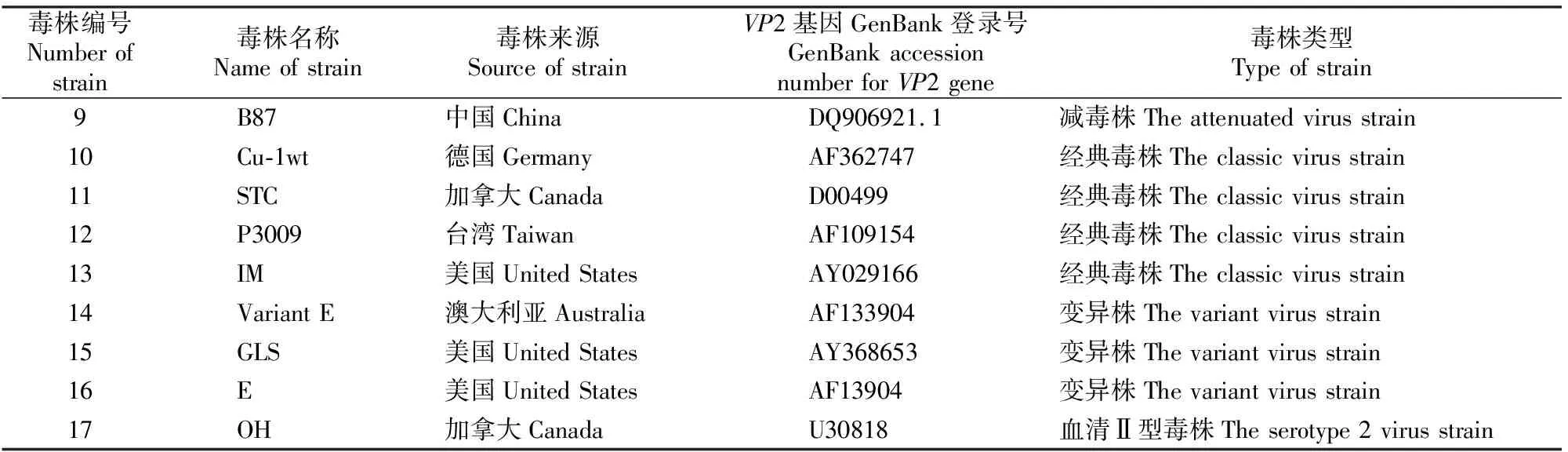
表1(续) Continued table 1
应用DNA STAR软件对X1株及其细胞适应株C1的VP2高变区及七肽区推导的氨基酸进行比对分析。
2 结果与分析
2.1 IBDV X1株的ELD50
稀释10-5,10-6,10-7,10-8,10-9的鸡胚绒毛尿囊膜研磨液的鸡胚死亡率分别为100%,100%,50%,37.5%和10%,利用Reed-Muench法计算出鸡胚分离物中病毒的ELD50为10-8mL-1。
2.2 IBDV X1株细胞适应株的驯化
将IBDV X1株鸡胚病毒液接种长成单层的CEF细胞传代并观察细胞病变,传至第10代时细胞病变稳定,第10代72 h时CEF细胞圆缩、脱落悬浮(图1)。将第10代的IBDV CEF细胞毒接种DF-1细胞传代,至第8代细胞产生稳定病变,第8代72 h时细胞圆缩,折光度增强,逐渐脱落悬浮,有拉网现象(图2)。结果表明,分离株(X1株)细胞适应株驯化成功,命名为C1株。
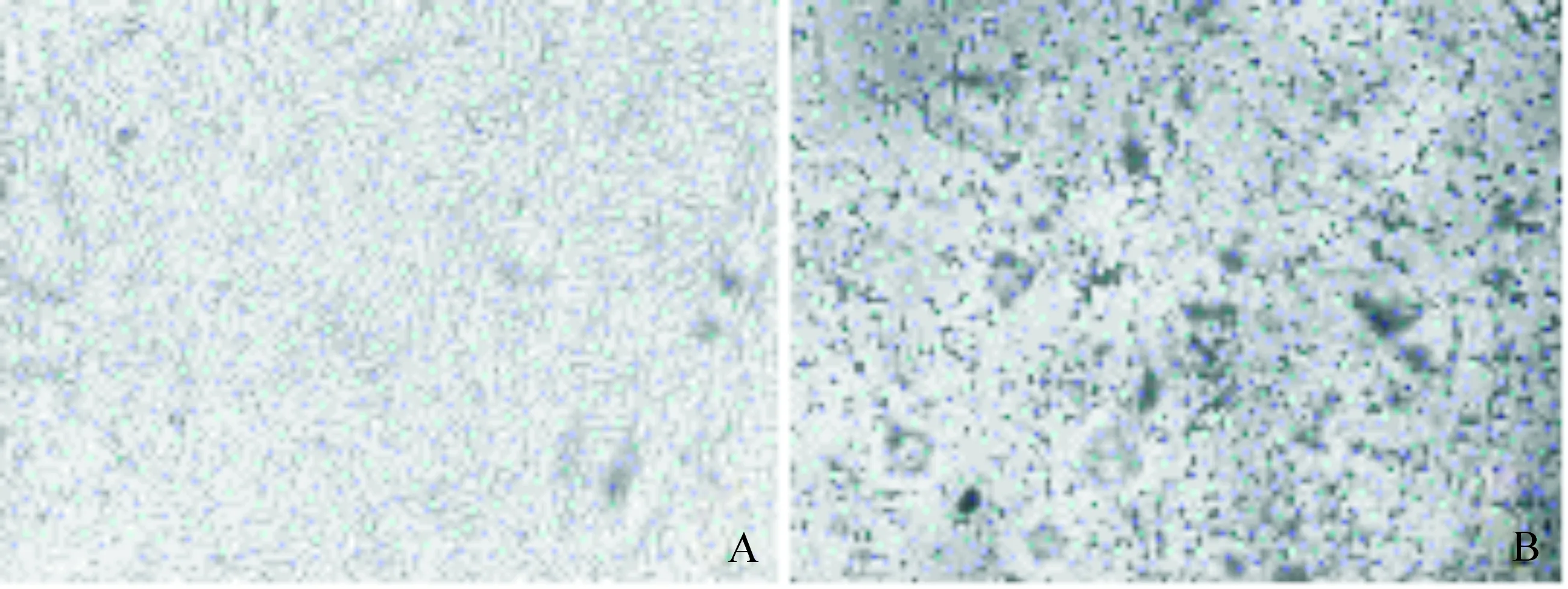
A.单层CEF细胞;B.第10代IBDV感染72 h的CEF细胞A. Single layer of CEF cells; B. The 10th generation of IBDV infected with CEF cells for 72 h图1 IBDV X1株对CEF细胞的适应性驯化Fig.1 Adaptability of IBDV strain X1 to CEF cells

A.单层DF-1细胞;B.接种第8代IBDV X1株CEF细胞毒72 h后的DF-1细胞A.Single layer of DF-1 cells;B.The status of DF-1 cells after 72 hours of inoculation with the 8th generation IBDV strain X1 from CEF cells图2 IBDV X1株CEF细胞毒对DF-1细胞的适应性驯化Fig.2 Adaptability of IBDV X1 strain CEF cytotoxicity to DF-1 cells
2.3 IBDV C1株细胞毒负染样品透射电子显微镜观察结果
经提纯浓缩的病毒液悬滴负染后在透射电子显微镜下观察,可见单个病毒粒子呈六边形或卵圆形,无囊膜,病毒直径50~60 nm,有实心和空心2种病毒(图3)。
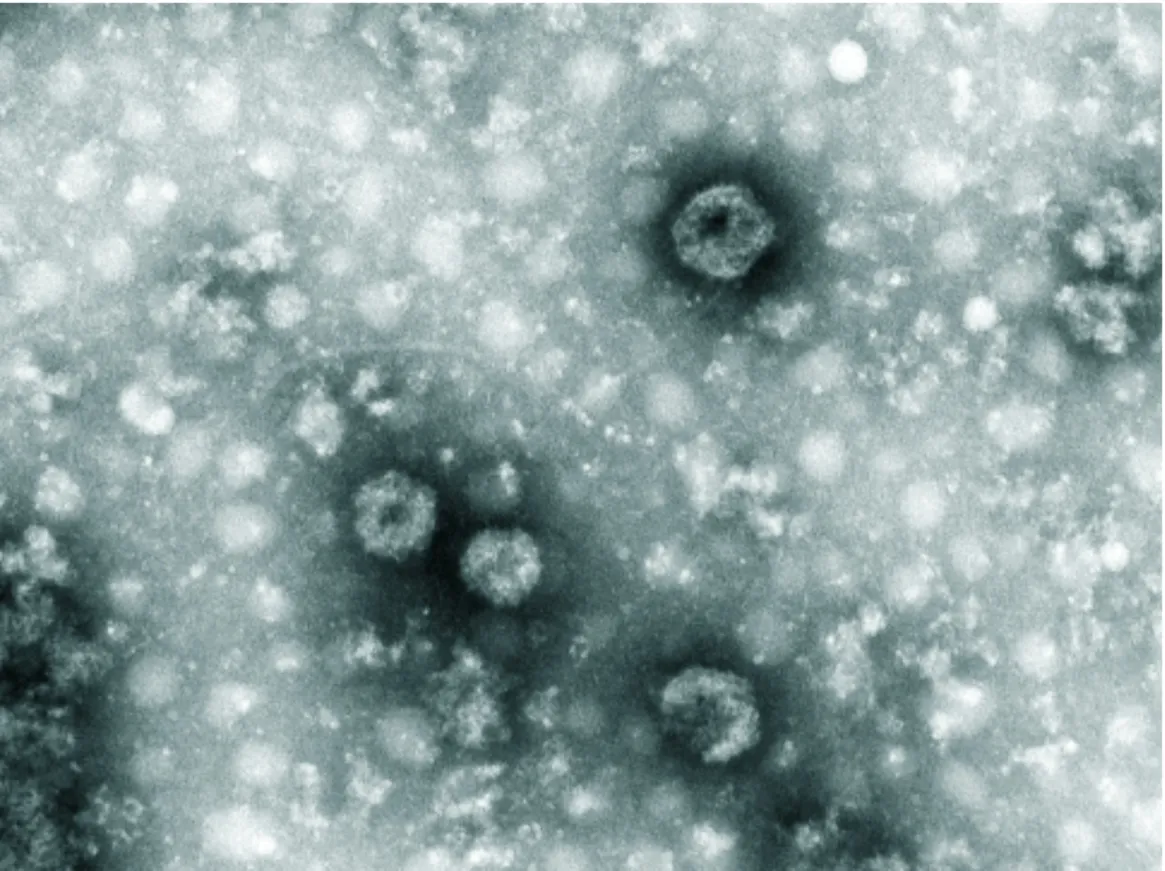
图3 IBDV C1株病毒粒子的透射电子显微镜观察(×50 000)Fig.3 Observation of IBDV strain C1 of virus particles using electron microscopic negative staining method (×50 000)
2.4 IBDV VP2基因的克隆及鉴定
基因克隆结果显示,X1和C1株病毒均能扩增出长度约为1 756 bp的条带,表明2株病毒均为IBDV毒株(图4)。菌液PCR产物鉴定结果显示,随机挑取的菌落中均可以扩增出与RT-PCR反应长度相同的条带(图5)。
2.5 IBDV VP2基因序列测定及分析
表2结果显示,分离株X1与超强毒株GX、OKYM、HK46、UK661、D6948的同源性较高,均为99.3%;C1株与减毒株CEF94(8号毒株)同源性较高,为99.6%,与X1株同源性为96.7%。通过对IBDV分离株及细胞适应毒株VP2基因推导的氨基酸序列同源性进行比较分析判断,分离株X1为超强毒株,X1株的细胞适应毒株C1与减毒株同源性较高,毒力致弱,具有选为疫苗株的潜力。
对分离株X1及其细胞适应毒株C1的VP2基因推导的氨基酸序列与表1中引用的IBDV参考毒株氨基酸序列构建系统进化树,结果(图6)表明,X1株与中国香港超强毒株HK46亲缘关系较近,细胞适应毒株C1与减毒株CEF94亲缘关系较近。

M.DNA Marker DL5000;1.X1株;2.C1株 M.DNA Marker DL5000;1.Strain X1;2.Strain C1 M.DNA Marker DL5000;1.X1株;2.C1株 M.DNA Marker DL5000;1.Strain X1;2.Strain C1图4 IBDV毒株VP2基因的RT-PCR扩增结果 图5 IBDV毒株VP2基因的菌液PCR扩增结果Fig.4 RT-PCR of the VP2 gene of IBDV strains Fig.5 Bacteria liquid PCR of the VP2 gene of IBDV strains

毒株StrainsX1C11234567891011121314151617X196.799.399.399.399.399.397.196.797.196.098.297.195.698.296.296.796.286.3C13.497.197.197.197.197.199.698.799.698.298.297.696.598.297.497.897.486.910.72.9100.0100.0100.0100.097.697.497.696.798.997.896.298.996.997.496.986.720.72.90.0100.0100.0100.097.697.497.696.798.997.896.298.996.997.496.986.730.72.90.00.0100.0100.097.697.497.696.798.997.896.298.996.997.496.986.740.72.90.00.00.0100.097.697.497.696.798.997.896.298.996.997.496.986.750.72.90.00.00.00.097.697.497.696.798.997.896.298996.997.496.986.7

表2(续) Continued table 2
注:右上三角表示同源性(%),左下三角表示分歧度;1~17对应的毒株同表1。
Note:Identity in upper triangle (%) while divergence in lower triangle.The strain numbers of 1-17 are the same as Table 1.
2.6 IBDV C1株和X1株的VP2高变区及七肽区推导氨基酸比对
在对IBDV分离株X1进行传代使其适应细胞的过程中,VP2高变区及七肽区部分氨基酸发生了变异(表3)。

表3 IBDV C1和X1株的VP2高变区(206~305位氨基酸)及七肽区(326~332位氨基酸)氨基酸突变情况Table 3 Changes in amino acid of VP2 hypervariable region (amino acids 206 to 305) and septapeptides (amino acids 326 to 332) of IBDV strain C1 and strain X1
注:P.脯氨酸;V.缬氨酸;K.赖氨酸;H.组氨酸;N.天冬酰胺;T.苏氨酸;L.亮氨酸;E.谷氨酸;R.精氨酸;A.丙氨酸;I.异亮氨酸;Q.谷氨酰胺;D.天冬氨酸;S.丝氨酸。
Note:P.Proline;V.Valine;K.Lysine;H.Histidine;N.Asparagine;T.Threonine;L.Leucine;E.Glutamic acid;R.Arginine;A.Alanine;I.Isoleucine;Q.Glutamine;D.Aspartic acid;S.Serine.
表3结果显示,C1株与X1株VP2相比,在第206~305位VP2高变区有11个位点发生了改变,七肽区有1个位点发生了改变。改变如下:222位(A→P)、242位(I→V)、249位(Q→K)、253位(Q→H)、256位(I→V)、279位(D→N)、284位(A→T)、290位(T→L)、294位(I→L)、299位(S→N)、300位(K→E)以及七肽区的330位(S→R)。vvIBDV X1株在第222,256,294位和299位上具有A、I、I、S 4个特征性氨基酸,这与何秀苗等[10]的研究相同。2012年,侯仲杰等[11]在研究IBDV基因组A节段编码前体多聚蛋白的遗传踪迹时也发现,超强毒株与减毒株的242,253,299及330位氨基酸均不同。超强毒株X1的DF-1细胞适应毒株C1也出现了相应的变化。通常被认为与毒力变异相关的七肽区含有6个保守氨基酸残基,若其中1个或2个丝氨酸被取代则必将导致毒力下降[12],而减毒株C1在第330位的精氨酸R取代了超强毒株X1在330位的丝氨酸S。
3 讨 论
鸡IBD主要攻击法氏囊并感染囊泡中的B前淋巴细胞,导致淋巴细胞溶解减少,最终致使囊萎缩,其不仅直接导致感染鸡的发病与死亡,还可引起免疫抑制使鸡对次生细菌或病毒的感染高度敏感,对疫苗接种的免疫应答能力下降[13]。1986年以后,由于IBDV超强毒株的出现,使IBD的流行出现了一些新的特点,流行的地域性、抗原性、发病率、死亡率、病理变化与经典IBD均有差异,使得IBD的防治面临新的挑战与困难。本研究成功克隆了从河南某鸡场分离到的IBDV X1毒株的VP2全长基因,对其与NCBI上登录的其他IBDV毒株的VP2基因的氨基酸序列进行比较分析,对其致病性、VP2基因进行了系统的分析和鉴定。结果显示,X1毒株对10日龄SPF鸡胚的ELD50为10-8mL-1,其在第222,256,294和299位上具有A、I、I、S 4个特征性氨基酸,与vvIBDV HK46VP2基因的氨基酸序列同源性高达99.3%,确定分离株X1为vvIBDV。
鸡IBDV经典毒株、变异毒株和超强毒株等自然野毒株均不适应CEF等细胞的培养,必须在细胞或鸡胚上盲传数代,使其对鸡的毒力减弱成为减毒株,病毒才可以在细胞上增殖。对于毒力不返强的减毒株可筛选为IBDV活疫苗株。本研究完成了一株vvIBDV毒株致弱的全过程,将分离的1株IBDV超强毒株X1经鸡胚传代8代次,CEF细胞传代10代次,DF-1细胞传代8代次毒力获得细胞适应毒株C1,并对其进行VP2全基因克隆分析。结果显示,在七肽区减毒株C1在第330位精氨酸R取代了超强毒株X1在330位的丝氨酸S;第222位氨基酸均由A变成P;决定病毒毒力的位点第256和284位分别由I、A变为V和T。在IBDV VP2可变区的270~290位氨基酸之间是其3个小的亲水区之一,有研究推测279和284位氨基酸的变化导致这一区域的亲水性下降并阻止α-螺旋的形成,从而影响到病毒的表面结构,这一结果暗示了VP2可变区的279和284位氨基酸残基对IBDV的毒力变化起着比较关键的作用。细胞适应毒株C1在279位由天冬酰胺N替代了超强毒株X1的天冬氨酸D,在284位由苏氨酸T替代了丙氨酸A。细胞适应毒株能够在DF-1上稳定增殖,而且容易大量培养,病毒滴度较高,预测其具备作为灭活疫苗种毒或弱毒疫苗种毒的特征,对于此毒株的免疫原性,本实验室将会进一步进行深入的研究。
目前,IBD的控制很大程度上依赖于疫苗的应用,一个理想化的疫苗应保护鸡群抵抗疾病,尤其是在发病的急性期[14]。但减毒活疫苗和灭活疫苗都有其不同的局限性。在减毒活疫苗的情况下,选择压力导致变异毒株的产生,导致保护失败和疾病的持续爆发[15]。同时活疫苗与母源抗体也会冲突,而灭活疫苗也存在缺点如成本和生产复杂性[16]。DNA疫苗接种是预防和控制疾病的替代方法。DNA疫苗接种包括注射携带编码抗原的基因的质粒DNA,疫苗不包含完整病毒,可防止与常规疫苗相关的问题,如复发的毒力、变异毒株的出现等。但DNA疫苗在目前的研究中对其是否具有交叉保护尚不清晰[17]。VP2蛋白是IBDV主要的宿主免疫保护性结构蛋白,并且是引起病毒抗原变异的决定因素[18]。因此在以后的试验中,将对IBDV VP2蛋白做进一步研究与探索。
本研究对1株vvIBDV X1及其细胞适应株C1与参考毒株的同源性进行了比对以及进化树和VP2氨基酸序列分析,比较总结其差异,初步揭示了vvIBDV在适应细胞、从超强毒力向弱毒力转化过程中,VP2高变区及七肽区氨基酸序列的变化情况,为培育筛选到免疫原性好的IBD疫苗株奠定了基础。
