葡聚糖分子量对玉米醇溶蛋白接枝物结构和乳化性的影响
2018-08-10赵城彬鄢健楠许秀颖刘美宏吴玉柱刘景圣
赵城彬,张 浩,鄢健楠,许秀颖,刘美宏,曹 勇,吴玉柱,刘景圣※
葡聚糖分子量对玉米醇溶蛋白接枝物结构和乳化性的影响
赵城彬1,张 浩1,鄢健楠2,许秀颖1,刘美宏1,曹 勇1,吴玉柱1,刘景圣1※
(1. 吉林农业大学食品科学与工程学院 小麦和玉米深加工国家工程实验室,长春 130118;2. 东北农业大学生命科学学院,哈尔滨 150030)
为了探究葡聚糖接枝作用对玉米醇溶蛋白结构和乳化性的影响,明确蛋白质结构与功能性的关系,本研究以玉米醇溶蛋白(Zein)和不同分子量(6、20、40和70 kDa)葡聚糖(dextran,DX)为原料,采用湿热法制备Zein-DX接枝物,并对接枝物的结构和乳化性进行研究。结果表明,低分子量(6 kDa)DX具有更高的反应活性,赖氨酸和精氨酸是参与Zein与DX接枝反应的主要氨基酸。傅里叶红外光谱(fourier transform infrared,FTIR)证明了DX以共价键与Zein形成了复合物。DX的共价接枝能够导致Zein荧光猝灭的发生,降低Zein的热稳定性,改善Zein的乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)。低分子量(6 kDa)DX与Zein形成的接枝物最大发射波长发生显著红移,三级结构变的松散,具有更低的热稳定性,且EAI最高达到(23.28±0.71)m2/g。然而,高分子量(70 kDa)DX与Zein形成的接枝物ESI高达(26.44±0.47)min,高于其他Zein-DX接枝物样品。乳状液粒径和流变性分析表明,随着DX分子量的增加,乳状液粒径降低,黏度增加,这与ESI的研究结果相符。研究结果可为改善玉米蛋白功能性和深入了解玉米蛋白改性机制提供理论依据。
玉米醇溶蛋白;黏度;乳化;葡聚糖;接枝物;结构
0 引 言
玉米醇溶蛋白(Zein)是玉米加工副产物玉米黄粉中主要蛋白质成分,一般采用溶剂法提取,属于醇溶性谷蛋白。Zein被美国食品药品监督管理局被认为是安全且有价值的食品原料,具有无毒、可降解、环保、可食用等优点[1]。Zein分子中非极性氨基酸残基占氨基酸总量的一半以上,由于具有较强疏水性使其不溶于水而溶于乙醇溶液。此外,在pH值大于11的碱性溶液中溶解性较大,有机溶剂和强碱的使用限制了Zein在食品加工中的应用[2]。
近年来,蛋白质接枝改性作为一种绿色、安全、无污染的改性方法而受到国内外学者的广泛关注。由于该反应不需要催化剂,并在可控的条件下获得所需的反应产物,可以作为新功能性材料应用于食品工业、生物材料及医药科学等领域[3]。蛋白质的接枝改性发生在糖分子的还原羰基与蛋白质的ε-氨基之间,在美拉德反应基础上,通过缩合、重排形成糖基胺重排产物即蛋白质-糖接枝物,能够显著改善蛋白质的功能性质,这与蛋白质结构修饰密切相关[4]。Li等[5]研究接枝反应对花生蛋白结构和理化性质的影响,发现花生蛋白-多糖接枝物具有较高的溶解性和乳化性,同时蛋白质结构变的更加松散,这可能是改善蛋白质功能性的重要因素。Zhang等[6]对大豆蛋白-葡聚糖接枝物稳定的水包油乳液的冻融稳定性进行研究,发现油滴尺寸以及絮凝和聚结程度均降低,乳状液稳定性得到明显改善。Fan等[7]采用乳清蛋白-葡聚糖接枝物制备纳米乳液,并对其理化稳定性和体外消化性进行分析,发现乳清蛋白与葡聚糖接枝反应能够降低纳米乳液的粒径,增加其稳定性,尤其是蛋白质等电点附近的稳定性,同时改善体外消化性。胥伟等[8]研究发现蛋清粉与葡聚糖共价接枝能够显著改善蛋清粉的凝胶性、乳化性、起泡性和热稳定性。然而,关于Zein与葡聚糖(dextran,DX)的接枝反应以及接枝物结构和乳化性的研究鲜有报道。本试验将Zein与不同分子量DX发生接枝反应制备Zein-DX接枝物,采用傅里叶红外光谱、荧光光谱和DSC分析接枝物的分子结构和热特性,同时对接枝物的乳化性进行研究,探究不同分子量DX对Zein接枝物分子结构和乳化性的影响,为改善玉米蛋白功能性和深入了解玉米蛋白改性机制以及促进玉米精深加工提供理论依据。
1 材料与方法
1.1 材料与设备
试验材料:玉米醇溶蛋白(Zein),百灵威科技有限公司,采用凯氏定氮法测定蛋白质质量分数为(91.36±0.82)%;分子量为6、20、40、70 kDa的葡聚糖(DX),美国Sigma公司;邻苯二甲醛(o-phthalaldehyde,OPA)、β-巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),美国Sigma公司;三氯乙酸(trichloroacetic acid,TCA),南京化学试剂股份有限公司;溴化钾,上海化学试剂公司;其他化学试剂均为国产分析纯级。
主要仪器:Alpha1-4LDplus冷冻干燥机,德国Christ公司;1600PC紫外可见分光光度计,上海美普达仪器有限公司;CM-5分光色差仪,日本柯尼卡美能达公司;L-8900A全自动氨基酸分析仪,日本日立公司;VERTEX 70傅里叶红外光谱仪,德国Bruker公司;F-4500荧光分光光度计,日本Hitachi公司;差示扫描量热仪(differential scanning calorimetry,DSC),美国TA公司;Spectra Max 190酶标仪,美谷分子仪器有限公司;Mastersizer 2000激光粒度仪,英国马尔文仪器有限公司;流变仪,奥地利Anton Paar公司。
1.2 试验方法
1.2.1 Zein-DX接枝物制备
将玉米醇溶蛋白(Zein)分散到KCl-NaOH缓冲液(0.2 mol/L,pH值12.0)中,常温下磁力搅拌1 h使蛋白质充分溶解,配成质量分数为1%的Zein溶液。以蛋白多糖质量比为2:1的比例添加6、20、40和70 kDa的葡聚糖(DX),磁力搅拌均匀得到混合溶液,然后在85℃水浴中热处理2 h,冰浴冷却至室温,离心分离取上清液,调节pH为7.0,4℃透析24 h,冷冻干燥即得Zein-DX接枝物,分别用Zein-DX6、Zein-DX20、Zein-DX40、Zein-DX70表示。不含DX的天然Zein为对照组。
1.2.2 游离氨基含量和接枝度测定
将80 mg的OPA溶解在2 mL体积分数为95%的乙醇中,并与50 mL 10 mmol/L的四硼酸钠缓冲液(pH值9.7)、5 mL质量分数为20%的SDS以及200L的β-巯基乙醇混合,充分混匀后用蒸馏水稀释至100 mL配成OPA试剂。将200L的蛋白样品溶液(2 mg/mL)与4 mL的OPA试剂在室温下反应5 min,然后采用紫外可见分光光度计测定340 nm下的吸光度,相同操作下蒸馏水代替反应液作为空白,以赖氨酸为标准物作标准曲线计算样品中游离氨基含量。接枝度(degree of graft,DG)的计算公式如式(1)。

式中0为未反应(0 min)的蛋白质吸光度;A为接枝物的吸光度。
1.2.3 色泽测定
采用色差仪对样品色泽进行测定,具体操作参照Liu[9]的方法。以国际照明委员会(CIE)建立的颜色参数(*值、*值、*值)为标准,*值表示红(+)到绿(-),*值表示黄(+)到蓝(-),*值表示黑(0)到白(100)。
1.2.4 氨基酸含量测定
采用全自动氨基酸分析仪测定氨基酸组成。测定前将样品进行预处理,具体操作参考Li等[10]的方法。取 20 mg样品放入到试管中,然后加入10 mL 6 mol/L的HCl溶液,再添加100L的β-巯基乙醇。混匀后进行液氮冷冻,然后用氮气密封。在110 ℃下水解22 h,然后添加2 mL pH值为2.2的三氯乙酸(TCA),4 ℃下反应2 h,然后将反应液通过0.22 nm的过滤膜过滤。
1.2.5 傅里叶红外光谱(fourier transform infrared, FTIR)测定
参照Zhao等[11]的方法测定FTIR,将蛋白样品与溴化钾研磨成均匀粉末,压片后置于红外光谱仪中进行测定。红外光谱仪的测定温度为25 ℃,波数扫描范围为4 000~400 cm-1,分辨率为4 cm-1,波数精度为0.01 cm-1,扫描次数为64次。
1.2.6 内源荧光光谱测定
参考Sun等[12]的方法,采用F-4500荧光分光光度计测定蛋白样品的内源荧光光谱。样品浓度为0.2 mg/mL,设定激发波长和发射波长的夹缝宽均为5 nm,激发波长为280 nm,发射波长扫描范围为290~450 nm,扫描速度为100 nm/min。
1.2.7 热性质(differential scanning calorimetry, DSC)测定
根据Zhao等[13]的方法,冻干蛋白样品的热性质分析采用DSC热分析仪进行测定。将3 mg样品放入铝盘中,盖上盖子压片,放入DSC仪器中测定。以10 ℃/min升温速率将样品由30 ℃加热到160 ℃,氮气速率为40 mL/min,空铝盘作为对照。采用热力学分析软件STARe 6.1对热分析图进行分析,得到起始温度(T)、峰值温度(T)、终止温度(T)和热焓变(D)等热力学参数。
1.2.8 乳状液制备
将蛋白样品溶于0.1 mol/L的磷酸盐缓冲液(pH值7.5)中,配成蛋白浓度为5 mg/mL的溶液,添加质量分数为0.02%的NaN3抑制微生物生长,室温下磁力搅拌 2 h,4℃过夜使蛋白充分水合。取15 mL的蛋白溶液与 5 mL的玉米胚芽油混合,采用高速均质机在12 000 r/min下高速均质乳化1 min即得乳状液。
1.2.9 乳化性测定
蛋白样品的乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)根据Molina等[14]的浊度法进行测定。将制备好的乳状液分别在0和30 min时,从测试管底部取50L样品,用质量分数为0.1%的SDS溶液稀释100倍,采用Spectra Max 190酶标仪在500 nm处测定样品的吸光度,以SDS溶液为空白。EAI和ESI的计算公式如式(2)~(3)。

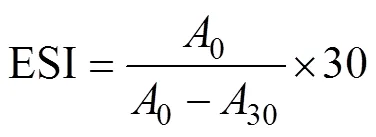
式中0和30分别为0和30 min时的吸光度;DF为稀释倍数(100);为蛋白质浓度,g/mL;为乳状液中油相所占比例(0.25)。
1.2.10 乳状液粒径测定
参考Zhao等[15]的测定方法,采用Mastersizer 2000激光粒度仪在室温下测定乳状液的粒径分布。测定转速为1 900 r/min,折射率指数为1.46,吸收率为0.01,乳状液的平均粒径采用体积平均直径(43)来表示。
1.2.11 乳状液流变性测定
根据Liang等[16]的测定方法,采用流变仪测定乳状液的流变学特性。温度设置为25 ℃,探头选择直径为 25 mm的PP25平板,平板与测试板间距为1 mm,剪切速率扫描范围为0~100 s-1。取一定量乳状液样品于测试板上,擦去多余的样品液,套上保温套,测定乳状液的黏度随剪切速率的变化。
1.3 统计分析
每组试验重复3次,采用SPSS V17.0软件进行ANOVA差异显著性分析,作图采用Origin8.5软件完成,<0.05为显著性差异。
2 结果与分析
2.1 Zein-DX接枝物接枝度和色泽分析
表1为Zein-DX接枝物的游离氨基含量、接枝度和色泽。由表1可以看出,与天然Zein相比,Zein-DX接枝物的游离氨基含量显著降低(<0.05)。Hiller等[17]研究发现,蛋白质的游离ε-氨基和多糖的还原羰基发生脱水缩合反应,这是导致游离氨基含量降低的主要原因,这也说明蛋白质和多糖之间发生了共价接枝反应。随着DX分子量的减小,游离氨基含量逐渐降低,接枝度逐渐升高,这表明低分子量(6 kDa)DX更容易与Zein发生接枝反应,这可能由于低分子量多糖具有较弱的空间 位阻作用,利于反应基团的相互接触,进而促进反应 进行[18]。

表1 Zein-DX接枝物的游离氨基含量、接枝度和色泽
注:同列中不同小写字母表示差异显著(<0.05);Zein代表不含DX的天然蛋白;Zein-DX6、Zein-DX20、Zein-DX40和Zein-DX70分别代表Zein与6、20、40和70 kDa DX形成的接枝物,下同。
Note: Different lower case letters in the same column indicate significant difference (<0.05);Zein represents the native protein that does not contain DX; Zein-DX6, Zein-DX20, Zein-DX40 and Zein-DX70 represents the conjugates that prepared by Zein and DX with 6, 20, 40 and 70 kDa, respectively, the same below.
在美拉德反应高级阶段,蛋白质和多糖能够形成褐色复合物,可通过色差仪测定产物色泽变化。由*、*、*的变化可以看出,与对照组Zein相比,Zein-DX接枝物*和*显著增加(<0.05),而*显著降低(<0.05),这表明Zein与DX之间发生了接枝反应,产生了褐色产物。随着DX分子量的降低,接枝物的褐变程度加剧,说明低分子量(6 kDa)多糖的反应活性更高,这与接枝度的分析结果一致。这可能是由于低分子量(6 kDa)DX能够暴露出更多活性羰基,使活性中间产物含量增加,并与其他活性前体连接、聚合,在美拉德反应最终阶段形成褐色聚合物[19]。
2.2 Zein-DX接枝物氨基酸分析
接枝反应发生在糖的还原羰基和蛋白质的ε-氨基之间,可以通过氨基酸的减少来判断,主要是赖氨酸和精氨酸[20]。图1为Zein-DX接枝物的赖氨酸和精氨酸含量,由图1可知,Zein-DX接枝物的赖氨酸和精氨酸含量均低于对照组Zein,这表明蛋白质中的赖氨酸和精氨酸很可能是参与接枝反应的游离氨基。此外,随着DX分子量的减少,接枝物的游离氨基含量进一步降低,说明低分子量(6 kDa)DX与Zein的接枝反应水平较高,这与接枝度和色泽的分析结果一致。Li等[21]对大米蛋白接枝物氨基酸含量进行研究,发现高分子量多糖与蛋白质形成的复合物赖氨酸含量较高,说明接枝反应速率较慢。Kato[22]的研究结果也表明由于空间位阻作用,高分子量DX具有较低的反应活性,导致接枝物具有较高的赖氨酸和精氨酸含量。可以看出,本文得到的结果与前人的研究结果相似。

图1 Zein-DX接枝物的赖氨酸和精氨酸质量分数
2.3 Zein-DX接枝物红外光谱分析
傅里叶红外光谱技术(FTIR)是通过分子振动引起辐射吸收,从而提供大分子的官能团和化学键信息,可用于蛋白质-糖共价接枝物的定性分析。图2为Zein-DX接枝物傅里叶红外光谱(FTIR),由图2可知,与对照组Zein相比,Zein-DX接枝物分别在3 200~3 700 cm-1和1 000~1 260 cm-1波长范围内出现强吸收峰,这是由C-O-C糖苷键的伸缩振动和游离-OH的伸缩振动产生 的[23],表明多糖以共价键与蛋白质形成了复合物。Zein- DX接枝物在酰胺Ⅰ(1 689 cm-1)和酰胺Ⅲ(1 409 cm-1)处的吸收峰增强,这可能是接枝反应过程中产生的希夫碱等中间产物引起吸收峰的变化,在大豆分离蛋白与羧甲基纤维素接枝反应的研究中也发现了相似的现象[24]。此外,Zein-DX接枝物在860和545 cm-1处均出现强吸收峰,进一步说明DX的共价接枝使Zein的结构发生了改变。
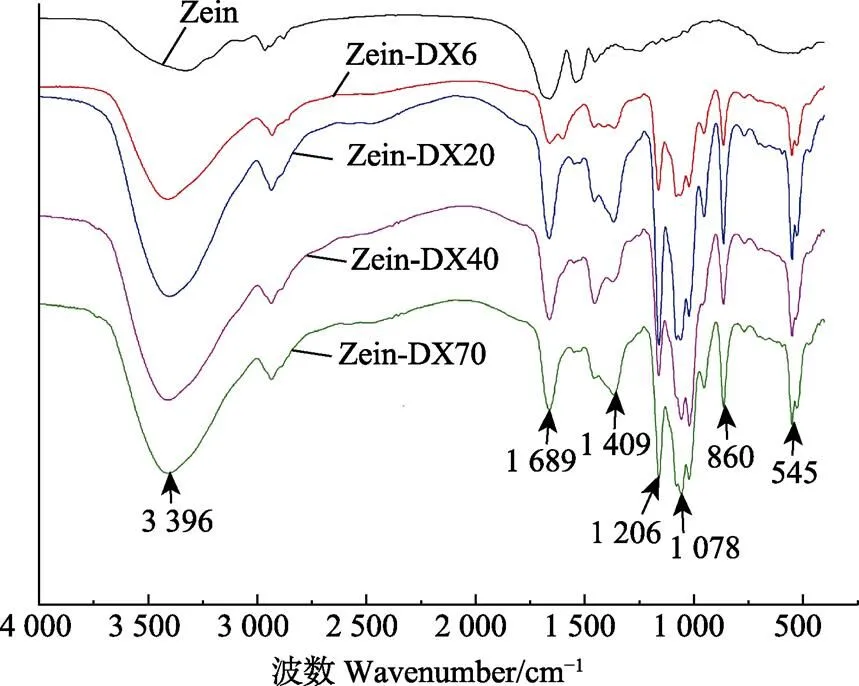
图2 Zein-DX接枝物傅里叶红外光谱(FTIR)
2.4 Zein-DX接枝物内源荧光光谱分析
内源荧光光谱被认为是能够提供蛋白质周围微环境结构信息的一种有效技术有段,蛋白质三级结构的信息能够通过荧光光谱获得。图3为Zein-DX接枝物的内源荧光光谱,由图3可知,天然Zein的最大发射波长(max)在304 nm附近,这主要是由于酪氨酸残基引起的。Sun等[25]对玉米醇溶蛋白(Zein)的研究发现,Zein分子中酪氨酸残基含量相对较高,在304 nm波长处具有最大吸收峰。与天然Zein相比,Zein-DX接枝物具有更低的荧光强度,表明Zein与DX共价接枝能够导致荧光猝灭的发生,Sun等[26]在卵清蛋白的接枝反应研究中也得到了相似的结果。荧光猝灭可能归因于多种分子间相互作用,包括分子重排、能量转移、复合物的形成和碰撞猝灭 等[27]。本文中荧光猝灭的发生可能是由于DX与Zein的酪氨酸基团发生作用形成共价复合物,从而减少酪氨酸残基在溶剂中暴露导致的。此外,多糖链的屏蔽作用也能够引起Zein荧光强度的降低[28]。随着DX分子量的减小,Zein-DX接枝物的荧光强度逐渐降低,表明低分子量 (6 kDa)DX与Zein形成的接枝物荧光猝灭现象更显著,这可能与较高的接枝度有关(表1)。
Zein与6、20、40和70 kDa的DX形成的接枝物max分别为312.4、310.6、308.3和307.6 nm,相比于天然Zein的max(304 nm)发生了不同程度的红移,说明DX的共价接枝能够改变Zein的空间构象,使Zein的三级结构变的松散。随着DX分子量减小,接枝物的max红移程度增大,低分子量(6 kDa)DX与Zein形成的接枝物具有更松散的三级结构。结合接枝度分析(表1)可以看出,较高接枝度的Zein-DX接枝物具有更松散的三级结构。Spotti等[29]在乳清蛋白-葡聚糖接枝物的荧光光谱分析中发现,共价接枝后max发生红移,且随着多糖分子量的降低,接枝度增加,max红移程度更大,这与本文的研究结果一致。
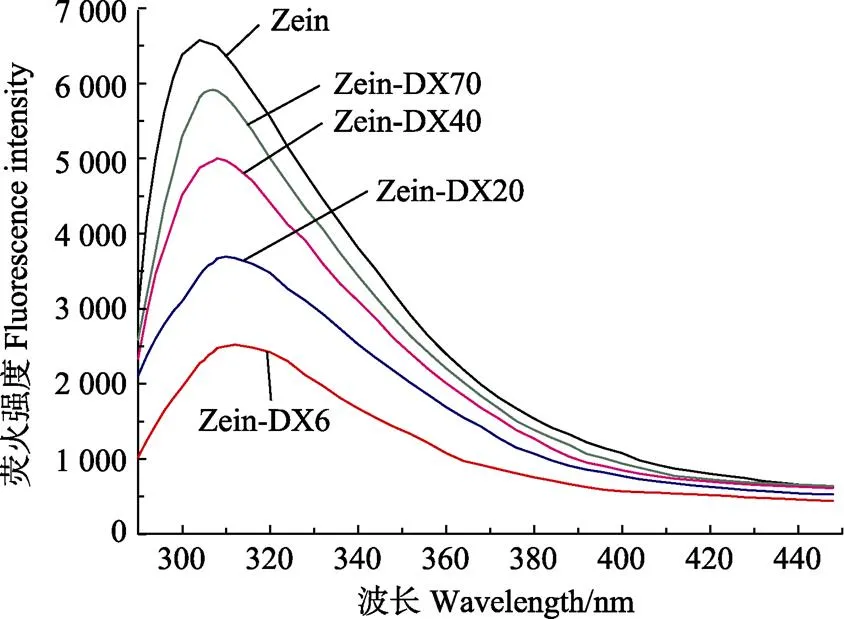
图3 Zein-DX接枝物的内源荧光光谱
2.5 Zein-DX接枝物DSC分析
差示扫描量热法(DSC)可以直接测量蛋白质在温度升高或降低过程中所引起的热量变化,主要包括热变性峰值温度(T)和热变性引起的热焓变(D),可用于反映蛋白质空间构象及结构稳定性[30]。图4为Zein-DX接枝物的DSC热分析图,由图4可知,与天然Zein相比,Zein-DX接枝物具有更高的反应吸收热,而且吸热峰均向左偏移,即吸热峰温度更低。

图4 Zein-DX接枝物的DSC热分析图
表2为Zein-DX接枝物的DSC热力学参数,与天然Zein相比,Zein-DX接枝物具有较小的T值和T值,根据Baeza等[31]的报道,T值和T值减小表明热稳定性的降低,这说明DX的共价接枝会降低Zein的热稳定性。接枝反应使Zein分子解折叠,结构变的更加松散,同时引入的多糖分子具有较大的空间位阻作用,阻止了蛋白质聚集,这可能是导致热稳定性降低的主要原因[32]。随着DX分子量的减小,Zein-DX接枝物的T由89.72 ℃降低至83.39℃,表明低分子量(6 kDa)DX与Zein形成的接枝物具有更低的热稳定性,这可能与较高的接枝反应程度有关(表1)。DX共价接枝会使Zein的D显著降低(<0.05),随着DX分子量的减小,Zein-DX接枝物的D进一步降低,这可能与Zein的解折叠状态有关[33]。此外,Zein与DX发生接枝反应可能会使蛋白质失去部分二级结构,如α-螺旋含量会降低,这可能也会对蛋白质的热稳定性产生影响。由此可知,接枝度越高,Zein-DX接枝物的T和D越低,其热稳定性越低。

表2 Zein-DX接枝物的DSC热力学参数
2.6 Zein-DX接枝物乳化性分析
蛋白质的乳化能力为紧密吸附在油-水界面的能力,油-水界面中的表面活性蛋白能够降低界面张力,阻止液滴聚集和相分离的发生,从而形成稳定的油-水界面膜。表3为Zein-DX接枝物的乳化活性(EAI)和乳化稳定性(ESI),由表3可知,天然Zein的EAI和ESI分别为(11.57±0.54)m2/g和(12.23±0.68)min。与天然Zein相比,Zein-DX接枝物的EAI和ESI均显著提高(<0.05),这可能是由于多糖中亲水基团的引入提高了蛋白质的亲水性,接枝反应使蛋白质空间结构变的松散,能够暴露出蛋白分子内部的疏水基团,增加了其疏水性,蛋白质的亲水/疏水平衡得到改善,有效降低界面张力,从而提高了蛋白质的乳化性[34]。随着DX分子量的减小,Zein-DX接枝物的EAI由(16.64±0.65)m2/g增加至(23.28± 0.71)m2/g,表明低分子量(6 kDa)DX与Zein形成的接枝物具有更高的乳化活性,这可能是由于Zein-DX6具有更高的接枝度(表1),导致油-水吸附性增强。这说明Zein-DX接枝物的EAI随着接枝度的增加而升高。随着DX分子量的增大,Zein-DX接枝物的ESI由(19.95± 0.58)min增加至(26.44±0.47)min,这可能与高分子量多糖具有较大的空间位阻作用有关。Pugnaloni等[35]研究表明,蛋白质-多糖接枝物能够在液滴附近形成混合的多分子层结构,从而降低液滴的聚集程度,达到改善乳化性的目的。

表3 Zein-DX接枝物的乳化活性(EAI)和乳化稳定性(ESI)
2.7 Zein-DX接枝物乳状液粒径分析
图5为Zein-DX接枝物乳状液的粒径分布(图5a)及平均粒径(图5b)。由图5a可知,Zein-DX接枝物乳状液的粒径分布与Zein乳状液相似,均呈单峰分布,表明DX的共价接枝不会改变Zein乳状液粒径分布的峰型。然而,Zein-DX接枝物乳状液的粒径分布范围变宽,且更多的分布在小粒径范围。由图5b可知,Zein-DX接枝物乳状液的平均粒径显著低于Zein乳状液。一般来说,乳状液的平均粒径越小,乳状液的稳定性越高[36],说明DX的共价接枝能够提高Zein乳状液的稳定性。这主要是由于Zein-DX接枝物能够吸附在油-水界面上形成较厚的空间界面膜,提高蛋白质乳化能力,且在液滴间产生排斥作用,抑制液滴聚集,从而提高乳状液稳定性[37]。Yin等[38]采用美拉德反应将玉米蛋白肽分别与葡聚糖(16 kDa)和麦芽糊精(3 kDa)制备成共价接枝物,并对接枝物的乳化性进行研究,发现玉米蛋白肽与多糖形成的共价接枝物使乳状液的平均粒径显著降低,有效改善了乳状液的稳定性,这与本文的研究结果相似。此外,随着DX分子量的增大,接枝物乳状液的平均粒径进一步降低,说明高分子量DX(70 kDa)与Zein形成的接枝物具有最好的乳化稳定性。这可能是由于高分子量DX的空间位阻效应会对乳状液中液滴的聚集起到抑制作用,阻止大液滴的形成,促进小液滴的分散,导致较低的平均粒径。

图5 Zein-DX接枝物乳状液的粒度特征
2.8 Zein-DX接枝物乳状液流变性分析
流变性是评价乳状液稳定性的一个重要参数,食品中大多数乳状液都显示出剪切变稀行为,这对乳液在流动过程中黏度的控制尤为重要[39]。图6为Zein-DX接枝物乳状液黏度随剪切速率的变化,由图6可知,所有乳状液样品的黏度都随着剪切速率的增加而降低,最终达到平衡,此为典型的假塑性流体特性。与天然Zein相比,Zein-DX接枝物乳状液的黏度均增加,且随着DX分子量的增大,乳状液黏度进一步增加。Liu等[40]对核桃乳状液的研究发现,高黏度乳状液能够阻碍液滴的相互聚集,从而提高乳状液的物理稳定性。高分子量(70 kDa)DX由于具有较大的空间位阻排斥作用,与Zein形成的接枝物乳状液黏度最大,表明Zein-DX70形成的乳状液稳定性最好,这与本文中乳状液粒径分析结果一致。通过乳状液粒径分析(图5)和流变性分析(图6)可以看出,乳状液稳定性与接枝度关系不大,而高分子量(70 kDa)DX的空间位阻效应是改善Zein-DX接枝物乳状液稳定性的主要因素。

图6 Zein-DX接枝物乳状液黏度随剪切速率的变化
3 结 论
将玉米醇溶蛋白(Zein)与不同分子量葡聚糖(DX)发生接枝反应,随着DX分子量的减小,Zein-DX接枝物的游离氨基含量降低,接枝度升高,颜色加深,说明低分子量DX具有更高的反应活性。赖氨酸和精氨酸是参与接枝反应的主要氨基酸。傅里叶红外光谱分析证明了Zein与不同分子量DX均形成了共价复合物。荧光光谱分析表明,Zein与DX共价接枝能够导致荧光猝灭的发生,低分子量DX与Zein形成的接枝物荧光猝灭现象更显著,且最大发射波长的红移程度更大,说明较高接枝度的Zein-DX接枝物具有更松散的三级结构。DSC分析表明,DX的共价接枝会降低Zein的热稳定性,且接枝度越高,Zein-DX接枝物的热变性峰值温度和热焓变越低,其热稳定性越低。乳化性分析表明,接枝反应能够提高Zein的乳化活性(EAI)和乳化稳定性(ESI),这可能与松散的三级结构和较低的热稳定性有关。低分子量DX与Zein形成的接枝物具有更高的EAI为(23.28± 0.71)m2/g,这可能是由于Zein-DX6具有较高接枝度导致的,说明Zein-DX接枝物的EAI随着接枝度的增加而升高。而高分子量DX与Zein形成的接枝物具有更高的ESI为(26.44±0.47)min,这可以在乳状液粒径和流变性分析中证明。高分子量DX与Zein形成的接枝物乳状液具有更小的平均粒径和更大的黏度,从而导致乳状液稳定性提高。这是由于高分子量DX的空间位阻效应会对乳状液中液滴的聚集起到抑制作用,同时增加乳状液黏度,利于Zein-DX接枝物乳状液的稳定。
[1] Paliwal R, Palakurthi S. Zein in controlled drug delivery and tissue engineering[J]. Journal of Controlled Release, 2014, 189(2): 108-122.
[2] Sun C, Dai L, Liu F, et al. Simultaneous treatment of heat and high pressure homogenization of zein in ethanol-water solution: Physical, structural, thermal and morphological characteristics[J]. Innovative Food Science and Emerging Technologies, 2016, 34(4): 161-170.
[3] 王梦萍,陈燕琼,王金梅,等. 糖接枝处理改善大豆蛋白纤维聚集体泡沫稳定性[J]. 农业工程学报,2016,32(4):249-255. Wang Mengping, Chen Yanqiong, Wang Jinmei, et al. Improvement of foam stabilty of soy protein on fibrillar aggregate by glycosylation[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(4): 249-255. (in Chinese with English abstract)
[4] Yang Z H, Li C, Li Y Y, et al. Effects of Maillard reaction on allergenicity of buckwheat allergen Fag t 3 during thermal processing[J]. Journal of the Science of Food and Agriculture, 2013, 93(6): 1510-1515.
[5] Li C, Xue H, Chen Z, et al. Comparative studies on the physicochemical properties of peanut protein isolate- polysaccharide conjugates prepared by ultrasonic treatment or classical heating[J]. Food Research International, 2014, 57(3): 1-7.
[6] Zhang Z, Wang X, Yu J, et al. Freeze-thaw stability of oil-in-water emulsions stabilized by soy protein isolate- dextran conjugates[J]. LWT - Food Science and Technology, 2017, 78(5): 241-249.
[7] Fan Y, Yi J, Zhang Y, et al. Physicochemical stability and invitro, bioaccessibility of β-carotene nanoemulsions stabilized with whey protein-dextran conjugates[J]. Food Hydrocolloids, 2017, 63(2): 256-264.
[8] 胥伟,黄迪,王海滨,等. 糖基化反应过程中蛋清蛋白粉的功能性研究[J]. 食品科技,2016,41(1):33-36. Xu Wei, Huang Di, Wang Haibin, et al. Functional properties of egg white powder during glycation[J]. Food Science and Technology, 2016, 41(1): 33-36. (in Chinese with English abstract)
[9] Liu K. Particle size distribution of distillers dried grains with solubles (DDGS) and relationships to compositional and color properties[J]. Bioresource Technology, 2008, 99(17): 8421-8428.
[10] Li Y, Zhong F, Ji W, et al. Functional properties of Maillard reaction products of rice protein hydrolysates with mono-, oligo- and polysaccharides[J]. Food Hydrocolloids, 2013, 30(1): 53-60.
[11] Zhao C B, Zhang H, Xu X Y, et al. Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J]. Process Biochemistry, 2017, 57(6): 117-123.
[12] Sun C, Liu F, Yang J, et al. Physical, structural, thermal and morphological characteristics of zein-quercetagetin composite colloidal nanoparticles[J]. Industrial Crops and Products, 2015, 77(12): 476-483.
[13] Zhao C B, Wu F, Li Y P, et al. Effects of β-glucans on properties of soya bean protein isolate thermal gels[J]. International Journal of Food Science and Technology, 2015, 50(2): 347-355.
[14] Molina E, Papadopoulou A, Ledward D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15(3): 263-269.
[15] Zhao C B, Zhou L Y, Liu J Y, et al. Effect of ultrasonic pretreatment on physicochemical characteristics and rheological properties of soy protein/sugar Maillard reaction products[J]. Journal of Food Science and Technology, 2016, 53(5): 2342-2351.
[16] Liang R, Xu S, Shoemaker C F, et al. Physical and antimicrobial properties of peppermint oil nanoemulsions[J]. Journal of Agricultural and Food Chemistry, 2012, 60(30): 7548-7555.
[17] Hiller B, Lorenzen P C. Functional properties of milk proteins as affected by Maillard reaction induced oligomerisation[J]. Food Research International, 2010, 43(4): 1155-1166.
[18] Niu L, Jiang S, Pan L, et al. Characteristics and functional properties of wheat germ protein glycated with saccharides through Maillard reaction[J]. International Journal of Food Science and Technology, 2011, 46(10): 2197-2203.
[19] Spotti M J, Perduca M J, Piagentini A, et al. Does dextran molecular weight affect the mechanical properties of whey protein/dextran conjugate gels[J]. Food Hydrocolloids, 2013, 32(1): 204-210.
[20] An Y, Cui B, Wang Y, et al. Functional properties of ovalbumin glycosylated with carboxymethyl cellulose of different substitution degree[J]. Food Hydrocolloids, 2014, 40(10): 1-8.
[21] Li Y, Lu F, Luo C R, et al. Functional properties of the Maillard reaction products of rice protein with sugar[J]. Food Chemistry, 2009, 117(1): 69-74.
[22] Kato A. Industrial applications of Maillard-type protein- polysaccharide conjugates[J]. Food Science and Technology Research, 2002, 8(3): 193-199.
[23] Xu W, Liu B, Yang H, et al. Effect of γ-irradiation on the physicochemical properties of mixed soy protein isolate/starch material[J]. African Journal of Biotechnology, 2012, 11(28): 7238-7246.
[24] Su J F, Huang Z, Yuan X Y, et al. Structure and properties of carboxymethyl cellulose/soy protein isolate blend edible films crosslinked by Maillard reactions[J]. Carbohydrate Polymers, 2010, 79(1): 145-153.
[25] Sun C, Dai L, Liu F, et al. Dynamic high pressure microfluidization treatment of zein in aqueous ethanol solution[J]. Food Chemistry, 2016, 210(11): 388-395.
[26] Sun Y, Hayakawa S, Izumori K. Modification of ovalbumin with a rare keto-hexose through the Maillard reaction, effect on protein structure and gel properties[J]. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1293-1299.
[27] Albrecht C. Principles of fluorescence spectroscopy, 3rd Edition[J]. Analytical and Bioanalytical Chemistry, 2008, 390(5): 1223-1224.
[28] Jiménez-Castaño L, López-Fandiño R, Olano A, et al. Study on β-lactoglobulin glycosylation with dextran: Effect on solubility and heat stability[J]. Food Chemistry, 2005, 93(4): 689-695.
[29] Spotti M J, Martinez M J, Pilosof A M R, et al. Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J]. Food Hydrocolloids, 2014, 39(39): 223-230.
[30] Liu F, Ma C, Mcclements D J, et al. A comparative study of covalent and non-covalent interactions between zein and polyphenols in ethanol-water solution[J]. Food Hydrocolloids, 2017, 63(2): 625-634.
[31] Baeza R I, Pilosof A M R. Calorimetric studies of thermal denaturation of β-lactoglobulin in the presence of polysaccharides[J]. LWT - Food Science and Technology, 2002, 35(5): 393-399.
[32] Joye I J, Davidov-Pardo G, Ludescher R D, et al. Fluorescence quenching study of resveratrol binding to zein and gliadin: Towards a more rational approach to resveratrol encapsulation using water-insoluble proteins[J]. Food Chemistry, 2015, 185(10): 261-267.
[33] Medrano A, Abirached C, Panizzolo L, et al. The effect of glycation on foam and structural properties of β-lactoglobulin [J]. Food Chemistry, 2009, 113(1): 127-133.
[34] Zhang Y, Chen T, Zhang X, et al. Effects of maltodextrin glycosylation following limited enzymatic hydrolysis on the functional and conformational properties of soybean protein isolate[J]. European Food Research and Technology, 2014, 238(6): 957-968.
[35] Pugnaloni L A, Dickinson E, Ettelaie R, et al. Competitive adsorption of proteins and low-molecular-weight surfactants: computer simulation and microscopic imaging[J]. Advances in Colloid and Interface Science, 2004, 107(1): 27-49.
[36] Zhang B, Guo X, Zhu K, et al. Improvement of emulsifying properties of oat protein isolate-dextran conjugates by glycation[J]. Carbohydrate Polymers, 2015, 127(8): 168-175.
[37] Pachekrepapol U, Horne D, Lucey J. Interactions between acidified dispersions of milk proteins and dextran or dextran sulfate[J]. Journal of dairy science, 2014, 97(9): 5371-5382.
[38] Yin B, Wang C, Liu Z, et al. Peptide-polysaccharide conjugates with adjustable hydrophilicity/hydrophobicity as green and pH sensitive emulsifiers[J]. Food Hydrocolloids, 2017, 63(2): 120-129.
[39] Paximada P, Koutinas A A, Scholten E, et al. Effect of bacterial cellulose addition on physical properties of WPI emulsions. Comparison with common thickeners[J]. Food Hydrocolloids, 2016, 54(10): 245-254.
[40] Liu S, Sun C, Xue Y, et al. Impact of pH, freeze-thaw and thermal sterilization on physicochemical stability of walnut beverage emulsion[J]. Food Chemistry, 2016, 196(4): 475-485.
Effect of dextran molecular weight on structure and emulsifying property of zein conjugates
Zhao Chengbin1, Zhang Hao1, Yan Jiannan2, Xu Xiuying1, Liu Meihong1, Cao Yong1, Wu Yuzhu1, Liu Jingsheng1※
(1.130118,; 2.150030,)
In order to investigate the effect of conjugation by dextran on the structure and emulsifying property of zein and the relationship between protein structure and functional properties, zein-dextran conjugates were prepared by conjugating zein and dextran with different molecular weights (6, 20, 40 and 70 kDa) under wet-heated Maillard reaction at 85 ℃ for 2 h. The free amino content, degree of graft, colour and amino acid content for zein-dextran conjugates were measured by UV-vis (ultra-violet-visible) spectrophotometer, colorimeter and automatic amino acid analyzer. For the zein-dextran conjugates, the free amino content was reduced, and a* and b* increased, while L* decreased in comparison with native zein, indicating the covalent graft reaction between protein and polysaccharide. As the decrease of the molecular weight of dextran, the conjugate prepared by zein and dextran with low molecular weight (6 kDa) had lower free amino content, higher degree of graft and darker colour, which suggested that the dextran with low molecular weight (6 kDa) was more reactive. The amino acid analysis indicated that lysine and arginine were the main amino acids involved in conjugation reaction between zein and dextran. The structures of conjugates were researched using Fourier transform infrared spectroscopy (FTIR), intrinsic fluorescence spectroscopy and differential scanning calorimetry (DSC). FTIR demonstrated that zein and dextran with different molecular weights could form the covalent conjugates. The covalent conjugation of dextran could result in the fluorescence quenching of zein and reduce the thermal stability of zein. The bathochromic shift of fluorescence emission maximum wavelength for the conjugate prepared by zein and dextran with low molecular weight (6 kDa) occurred, leading to looser tertiary structure. Moreover, zein conjugating with the dextran with 6 kDa molecular weight had lower thermal stability, revealing that zein-dextran conjugate with higher degree of graft had a looser tertiary structure, and the higher the degree of graft, the lower the thermal denaturation peak temperature and enthalpy, the lower the thermal stability of zein-dextran conjugates, which might be an important reason for improving the emulsifying activity index (EAI) and emulsifying stability index (ESI) of zein-dextran conjugates. The emulsifying properties of conjugates were researched using microplate reader, laser particle sizer and dynamic rheometer. The EAI and ESI of native zein were (11.57±0.54) m2/g and (12.23±0.68) min, respectively. The EAI and ESI of zein-dextran conjugates were higher than that of native zein, indicating the significant improvement of emulsifying properties of zein by the covalent conjugation of dextran. The conjugate prepared by zein and dextran with low molecular weight (6 kDa) had higher EAI of (23.28±0.71) m2/g, which could be related to higher degree of graft, suggesting that the EAI of zein-dextran conjugates improved with the increase of degree of graft. However, the conjugate prepared by zein and dextran with high molecular weight (70 kDa) had higher ESI of (26.44±0.47) min. It was possible that the dextran with high molecular weight (70 kDa) had a large steric hindrance, inhibiting the aggregation of droplets in emulsion and forming more droplets with smaller size. Meanwhile, the emulsion was more viscous, which also resulted in the improvement of emulsion stability. These could be confirmed by particle size and rheological analysis of emulsion. It could be seen that the emulsion stability had little relation to degree of graft. However, the steric hindrance effect of dextran with high molecular weight (70 kDa) was the main factor to improve the stability of zein-dextran conjugate emulsions. The results of this study can provide theoretical basis for improving the functional properties of corn protein and understanding its modification mechanism.
zein; viscosity; emulsification; dextran; conjugates; structure
赵城彬,张 浩,鄢健楠,许秀颖,刘美宏,曹 勇,吴玉柱,刘景圣.葡聚糖分子量对玉米醇溶蛋白接枝物结构和乳化性的影响[J]. 农业工程学报,2018,34(14):288-295.doi:10.11975/j.issn.1002-6819.2018.14.037 http://www.tcsae.org
Zhao Chengbin, Zhang Hao, Yan Jiannan, Xu Xiuying, Liu Meihong, Cao Yong, Wu Yuzhu, Liu Jingsheng. Effect of dextran molecular weight on structure and emulsifying property of zein conjugates[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(14): 288-295. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.14.037 http://www.tcsae.org
2018-01-02
2018-04-12
国家重点研发计划项目(2016YFD0400702);现代农业产业技术体系建设专项(CARS-02-30);吉林省教育厅科学研究项目(JJKH20180654KJ);吉林农业大学科研启动基金资助项目(201715)
赵城彬,讲师,博士,主要从事粮食、油脂及植物蛋白工程研究工作。Email:zhaochengbin66@126.com
刘景圣,教授,博士,博士生导师,主要从事粮食深加工与功能性食品研究工作。Email:liujingshengname@163.com
10.11975/j.issn.1002-6819.2018.14.037
TS201.2
A
1002-6819(2018)-14-0288-08
