农杆菌介导的胡麻转化因子的优化
2018-08-02李淑洁罗俊杰林玉红裴怀弟李闻娟
李淑洁,罗俊杰,林玉红,裴怀弟,李闻娟
(1.甘肃省农业科学院 生物技术研究所,兰州 730070;2.甘肃省农业科学院 作物研究所,兰州 730070)
农杆菌介导的转基因技术因具有转化机理清楚、整合外源基因拷贝数低、整合位点稳定、外源基因表达和遗传稳定性好、操作简单、所需仪器少和试验成本低而成为目前最有效的基因转化方法之一[1]。该技术转化率主要受多个转化因子,诸如受体系统中的再生体系、选择剂及筛选浓度、农杆菌转化系统中的菌株、表达载体、侵染菌液浓度及时间等影响。
胡麻(LinumusitatissimumL.)即油用亚麻,是亚麻科亚麻属1 a生草本植物,其种子富含α -亚麻酸和木酚素,是具有重要营养价值和保健功能的油料作物。因其植株小、生育期短、自花授粉,种子繁殖、种子小且量大、基因组小(2n=30,约700 Mb)等特点成为麻类作物功能基因组学研究的代表作物[2]。转基因技术是研究基因功能及作物改良的重要技术,因此,胡麻转基因技术体系的建立对于研究其功能基因组学和遗传改良具有重要意义。
亚麻转基因研究主要采用外源DNA导入法和农杆菌介导法。其中农杆菌介导的胡麻转基因研究始于1983年Hepburm等[3]用根癌农杆菌侵染亚麻上胚轴得到亚麻肿瘤株系,表明亚麻是易于被农杆菌侵染转化的。之后,优化转化体系、提高转化效率一直是国内外的一个研究热点,并对外植体[4-5]、培养基成份[2,6-8]、筛选基因的选择[5,9-12]等开展了大量工作。本研究以甘肃省主推胡麻品种‘定亚22号’和‘陇亚10号’为受体,在已报道的国内外亚麻(包括纤维用亚麻和油用亚麻)遗传转化体系基础上,选取一些还未达成一致的转化因子参数进行优化,如草铵膦选择压、下胚轴的是否剥表皮处理、预培养时间、高效农杆菌菌株的筛选和侵染时间等,以期建立高效、稳定的胡麻转化系统,为后续的胡麻功能基因组学研究和遗传改良奠定基础。
同时本研究中以gus表达率或表达频率、抗性苗分化率作为衡量遗传转化率的代换指标,其相关性高、检测方便,在转化初期和中期都能快速统计分析,便于参数优化,快速建立高效稳定的遗传转化体系。
1 材料与方法
1.1 材料及受体准备
基因转化受体‘陇亚10号’和‘定亚22’为油用亚麻品种。胡麻种子用流水冲洗30 min,φ=75%乙醇快速杀菌30 s,φ=2% NaClO浸泡12 min,无菌水冲洗3~5次,接种于1/2 MS培养基。20 ℃黑暗培养3 d后转移至光照条件下,16 h/d 光周期培养。剪取6~7 d苗龄的无菌苗下胚轴(长度约0.5~1 cm)作为外植体。
农杆菌菌株和质粒:农杆菌菌株AGL1、C58c1、EHA105、GV3101和LBA4404, pCAMBIA3301质粒T-DNA区带有CaMV35S启动子驱动的gusA报告基因和bar选择标记基因(图1)。
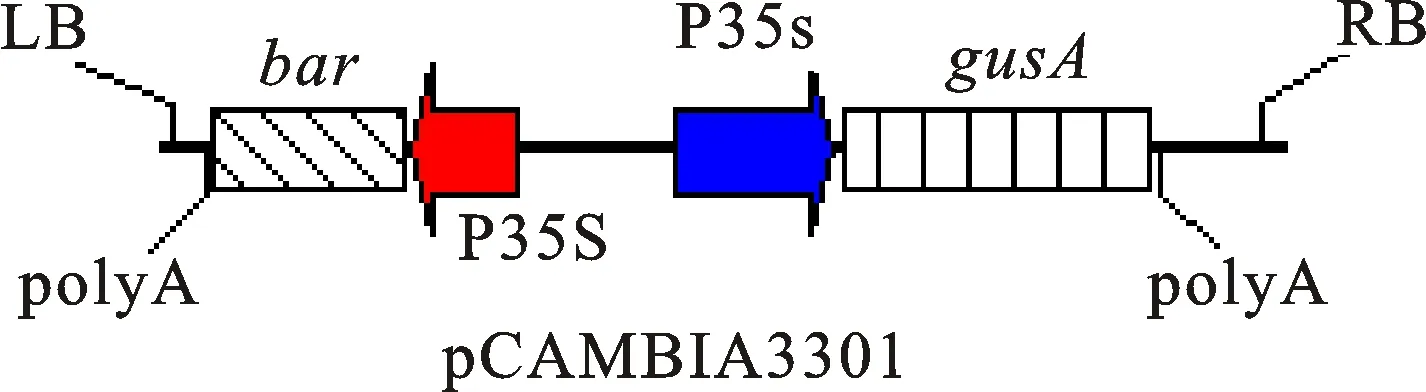
图1 pCAMBIA3301植物表达载体结构简图Fig.1 General frame of plasmid pCAMBIA3301
1.2 农杆菌菌液的制备及侵染
侵染菌液的制备:将pCAMBIA3301植物表达载体分别转化农杆菌菌株AGL1、C58c1、EHA105、GV3101和LBA4404,并挑取单菌落接种于含有利福平(rif)、链霉素(str)和卡那霉素(kan)各50 mg/L 的YEP液体培养基中,28 ℃、220 r/min 振荡培养24 h左右。然后取2 mL菌液加入到50 mL YEP液体培养基进行扩大培养,待菌液的浓度达到OD600=0.5~0.6 后,4 ℃、5 000 r/min 离心5 min收集菌体。将菌体重悬于1/2 MS液体培养基(pH = 5.4)至OD600=0.5~0.6 备用。
农杆菌侵染转化程序:下胚轴接种于愈伤诱导分化培养基(MS + 6-BA 1.0 mg/L + NAA 0.1 mg/L,pH 5.8),26/22℃(日/夜)、16/8 h(光/暗)预培养3 d后,用制备好的菌液侵染10 min,侵染结束后用无菌滤纸吸干多余菌液,接种于共培养基(同愈伤诱导分化培养基),25 ℃黑暗培养3 d。
1.3 各转化因子的优化
1.3.1 草铵膦(PPT)临界选择压 分别进行了愈伤组织诱导、分化苗伸长生长和生根阶段草铵膦临界选择压筛选,每个阶段设PPT 0 mg/L、2 mg/L(仅限生根阶段有)、5 mg/L、10 mg/L、20 mg/L和40 mg/L处理,统计愈伤组织诱导率、分化率、白化苗率、生根率,筛选出不同阶段的草铵膦临界选择压。每个处理设3次重复,下同。
1.3.2 外植体预处理 下胚轴分2种预处理:用解剖刀轻轻剥去约30%表皮,对照为不剥表皮处理;预培养设0 d和3 d。预处理后程序同“1.2”中农杆菌侵染转化程序。
1.3.3 农杆菌侵染和共培养 不同菌株侵染处理:以预培养3 d的下胚轴为受体,分别用携带有目标质粒的AGL1、C58c1、EHA105、GV3101和LBA4404侵染10 min。共培养程序同“1.2”所述。
侵染时间处理:以农杆菌C58c1侵染15 min、30 min和60 min,分别统计不同侵染时间对gus表达和抗性苗分化的影响。
1.3.4 乙酰丁香酮(AS) AS处理:将预培养3 d的下胚轴分别用上述的5种菌株侵染10 min,侵染结束后共培养于含100 μmol/L AS的共培养基,以不含AS为对照,25 ℃黑暗培养3 d。分析AS对gus表达率或表达频率及抗性苗分化率的影响。
1.4 转化体的筛选及抗性植株再生
共培养结束后下胚轴在含有羧苄青霉素(Carb)350 mg/L及PPT 5~10 mg/L的筛选培养基上培养3~7 周。分化出的抗性苗移至含有PPT 2 mg/L的生根筛选培养基(1/2 MS + 3%蔗糖+琼脂粉0.5%+ Carb 200 mg/L,pH 5.8) 诱导生根。
1.5 转化体的gus染色检测
参照王关林等[13]组织化学染色法检测培养30 d后抗性愈伤组织和抗性植株中gus表达率和表达频率。
gus表达率=gus染色阳性外植体数/总检测外植体数×100%
gus表达频率=检测外植体中gus染色阳性总点数/总检测外植体数
抗性苗率=抗性苗数/接种外植体数×100%
1.6 数据分析
利用Microsoft Excel 2003绘图,并用SPSS 17.0进行数据的显著性分析。
2 结果与分析
2.1 草铵膦(PPT)临界选择压的确定
如表1所示,在愈伤组织诱导和分化阶段,添加草铵膦致使愈伤组织诱导受到很大的抑制,草铵膦质量浓度为5 mg/L时愈伤组织诱导率为45.5%、分化率为0;10 mg/L时愈伤组织诱导率为4.16%、分化率仍为0;质量浓度为20和40 mg/L时愈伤组织诱导率和分化率均为0,因此胡麻愈伤组织诱导阶段草铵膦的筛选质量浓度为10 mg/L,愈伤组织分化阶段草铵膦的筛选质量浓度为5 mg/L。
胡麻分化苗伸长生长和生根阶段,只有不添加草铵膦的培养基上分化苗才能正常生长和生根(生根率98.5%),因此分化苗伸长生长和生根阶段草铵膦的筛选质量浓度为2 mg/L。

表1 草铵膦临界选择压的筛选Table 1 Appropriate mass concentration selection of phosphinothricin
2.2 受体预处理
根据下胚轴剥表皮预处理的gus表达率和抗性苗率(图2)得出,下胚轴剥表皮处理显著影响抗性分化苗率,其抗性苗率是未剥表皮细胞处理的20%。剥表皮处理对gus表达率的影响未达到统计学的显著水平,是未剥表皮细胞处理的54.6%,所以以下胚轴为受体的胡麻遗传转化中不宜对外植体进行去表皮处理。
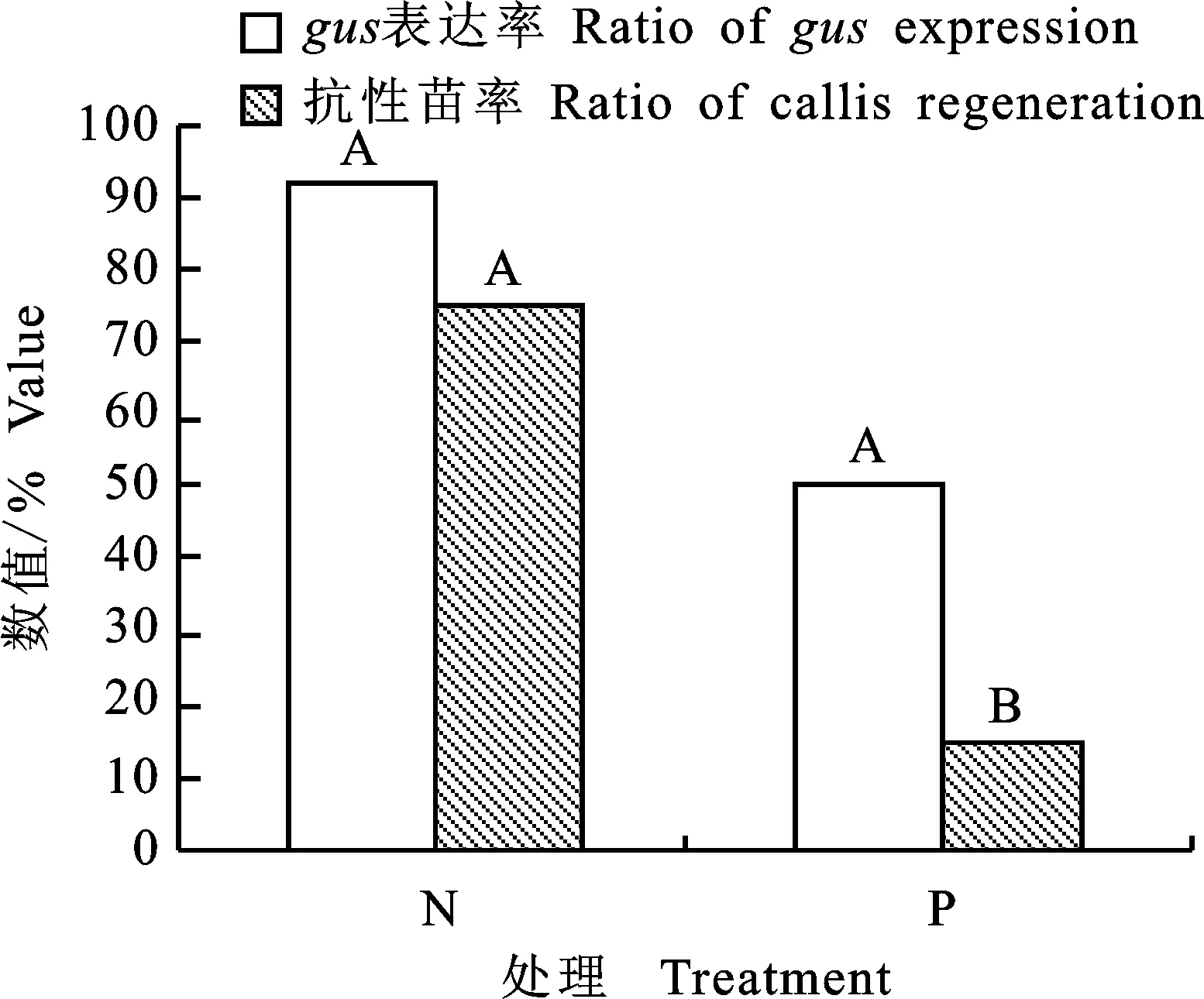
N.未做剥表皮处理的下胚轴 Common hypocotyl; P.剥表皮处理的下胚轴 Hypocotyl that removal of partial epidermal cell;图中不同大写字母表示P<0.01水平差异显著 Different capital letters indicate significant difference at level 0.01;下同 The same below
图2下胚轴剥表皮处理的gus表达率和抗性苗率
Fig.2Ratioofgusexpressionandcallisregenerationafterremovingepidermalcell
预培养0 d和3 d的下胚轴侵染30 d后转化愈伤组织gus染色检测都呈蓝色,预培养3 d的愈伤组织gus表达频率高于0 d处理,但不存在显著差异(图3)。
预培养时间对抗性苗率影响极显著。不同的外植体经农杆菌介导转化后诱导的愈伤组织质量和愈伤组织分化率有很大差异,抗性苗率存在极显著差异。预培养0 d处理的愈伤组织表面光滑、坚硬、不易分散,易玻璃化,分化率很低;而预培养3 d处理的胚性愈伤组织率高,愈伤组织表面呈许多小颗粒密集状,易分散,分化率很高。预培养3 d处理抗性苗率达60.3%,而0 d抗性苗率仅为5.2%(图3)。由此得出,下胚轴预培养3 d 对于获得高转化率至关重要。

图3 预培养0 d和3 d的gus表达频率和抗性苗率Fig.3 Frequency of gus expression and ratio of callis regeneration at different preculture time
2.3 农杆菌菌株及侵染时间
分别用携带有pCAMBIA3301质粒的AGL1、C58c1、EHA105、GV3101和LBA4404侵染胡麻下胚轴,相同转化条件下,侵染30 d后gus表达率都高达80%~100%,但各菌株侵染后愈伤组织的分化率差异很大,抗性苗率存在极显著差异。其中 C58c1侵染后分化的抗性苗最多,达73株,抗性苗率高达280.77%,其次为LBA4404和GV3101,分别为13(抗性苗率44.83%)和11株(抗性苗率40.74%),AGL1和 EHA105抗性苗低于10%(图4),因此确定C58c1作为后续胡麻遗传转化中的侵染菌株。
研究以OD600=0.5~0.6作为侵染浓度,侵染时间设15、30和60 min 3个处理。侵染30 d后各处理gus表达率均为100%,抗性苗率无显著差异,但处理间gus表达频率存在极显著差异,侵染60 min时gus表达频率最高,为7.5,其抗性苗率为60.3%(图5),因此将60 min作为最佳侵染时间。
2.4 乙酰丁香酮(AS)
在胡麻下胚轴的遗传转化中,添加AS后显著提高了C58c1和GV3101侵染gus表达频率(图6),添加AS处理的gus表达频率分别是不添加处理的16倍和10倍。
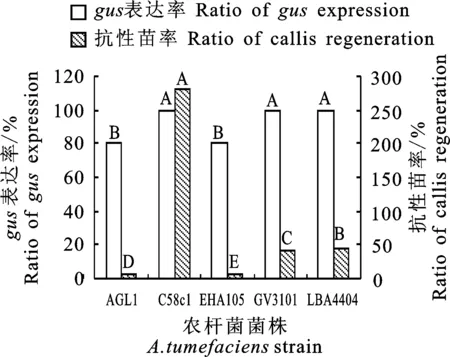
图4 不同侵染菌株的gus表达率和抗性苗率 Fig.4 Ratio of gus expression and callis regeneration mediated by different A.tumefaciens strains
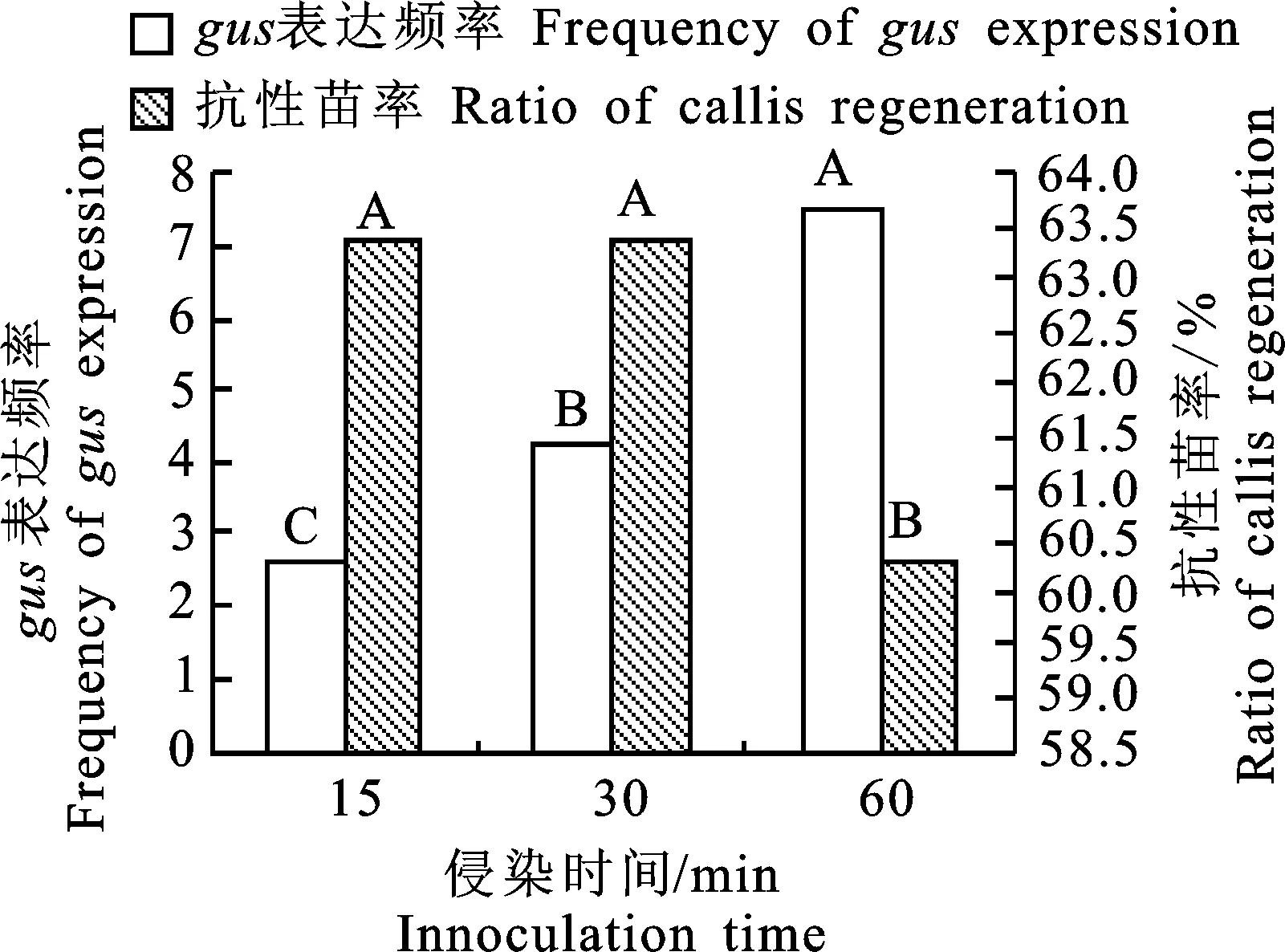
图5 不同侵染时间的gus表达频率和抗性苗率Fig.5 Frequency of gus expression and ratio of callis regeneration at different innoculation time

图6 共培养阶段使用AS时不同转化菌株的gus表达频率Fig.6 Frequency of gus expression when AS is added in co-culture media
2.5 转化植株的gus染色检测
将抗性愈伤组织进行不定芽分化和生根培养(图7),并对抗性苗的茎、根和叶分别进行gus染色检测,如图8所示,转化愈伤组织和转化植株的茎、根和叶中都检测到了gus基因的表达,说明外源基因在胡麻中成功转化并表达。
3 讨 论
根癌农杆菌只有在植物创伤部位生存16 h后才能诱发“肿瘤”,才能进行T-DNA的转移。因此,制造外植体创伤是实现农杆菌介导转化成功的必要条件,考虑到下胚轴只有前后端两个切口,而亚麻下胚轴再生体系中90%以上不定芽的分化部位位于两切口之间的胚轴上,所以Vrbová等[14-15]在农杆菌侵染前将下胚轴剥去50%~60%表皮细胞或用200 mg/L的纤维素酶预处理下胚轴,转化率分别提高了11.75%和1.6倍。本研究参考Vrbová 等[14-15]方法,将下胚轴剥去约30%表皮细胞以制造机械损伤,但去表皮后抗性苗分化率显著下降,抗性苗分化率是未剥表皮细胞处理的20%,gus表达率下降,是未剥表皮细胞处理的54.6%,推测同样处理得到相反结论的主要原因在于受体材料的不同,虽然同是亚麻下胚轴,但Vrbová等[14-15]所用的基因型为纤维用亚麻,纤维用亚麻表皮富含纤维素,农杆菌不易渗入,所以提高了剥去部分表皮后转化率。而本试验所用的‘陇亚10号’和‘定亚22号’都是油用亚麻品种,其表皮层薄,纤维素含量低,剥表皮对下胚轴造成了较大创伤,使不定芽分化率下降,抗性苗数量也急剧下降。
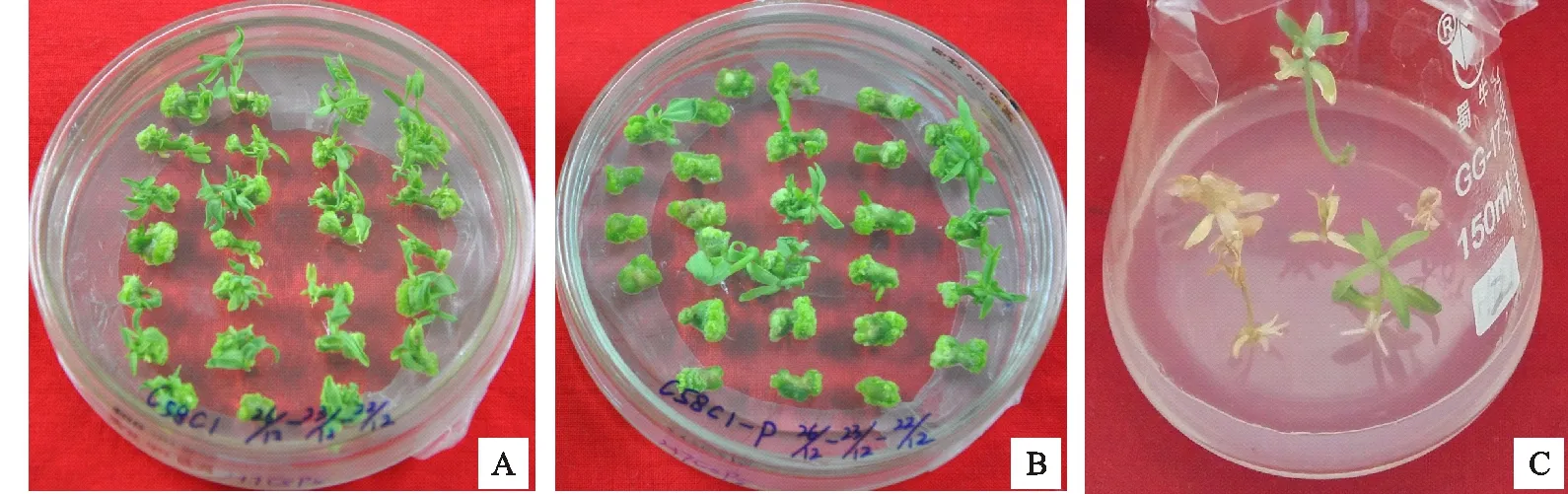
A.转化受体为未剥表皮处理的下胚轴愈伤组织分化 Regeneration of transgenic callis induced by hypocotyl inoculation withA.tumefaciensC58c1;B.转化受体为剥部分表皮处理的下胚轴愈伤组织分化 Regeneration of transgenic callis induced by removing hypocotyl partial epidermal cell;C.转化植株生根 Rooting of transgenic plants
图7抗性愈伤组织分化及转化植株生根
Fig.7Regenerationoftransgeniccallisandrootingoftransgenicplants
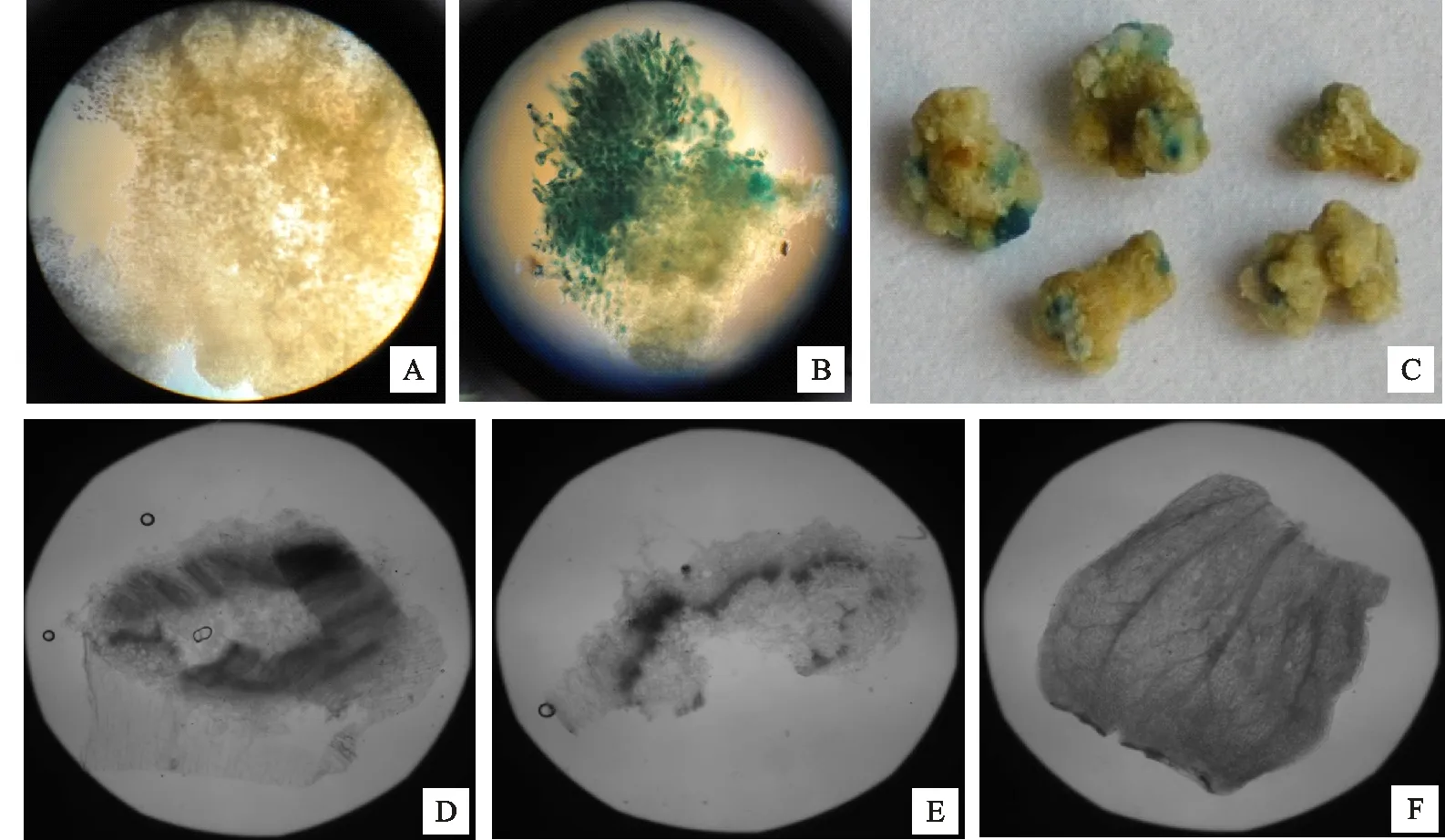
A.CK Control(Non-transgenic plant);B、C.转化愈伤 Transgenic callis;D.转化株茎 Stem of transgenic plant;E.转化株根部 Root of transgenic plant;F.转化株叶片 Leaf of transgenic plant
图8转化材料的gus活性检测
Fig.8gusexpressionintransgenicflax
农杆菌菌株与表达载体的组合共同影响T- DNA的转移效率。有研究指出,即使是同一农杆菌菌株介导的遗传转化,表达载体不同,转化效率也有差异[16]。本研究中将同一表达载体与不同的农杆菌菌株组合,筛选与pCAMBIA3301表达载体组合的高转化率农杆菌菌株。本试验中采用的5种农杆菌菌株来自于3类不同的农杆菌菌系,菌株对植物的侵染能力由该菌株农杆菌染色体基因的调控、农杆菌中的Ti质粒和vir基因的活化能力等因素决定。C58c1菌株为胭脂碱型,其染色体背景为C58,具有生长速度快,转化实验中易操作等特点。Wróbel等[17]曾用C58c1:pGV2260组合将PHB合成基因导入亚麻,此外,该菌株在小麦、大麦遗传转化中被广泛使用。AGL1和EHA105为农杆碱型,是具有超强侵染力的菌株,在单子叶植物、尤其是AGL1在禾本科作物的转基因研究中应用较多,但在本实验中,这2个菌株侵染的愈伤组织的分化率低。LBA4404属于章鱼碱型,普遍用于双子叶植物和部分单子叶植物的遗传转化中,是植物转基因中运用最广泛的菌株,Shisha等[18]曾利用LBA4404:pBI121组合将GFP-TUA6 基因成功导入白俄罗斯和乌克兰的纤维用亚麻品种。本研究中LBA4404侵染后抗性苗率为44.83%,是胡麻下胚轴转化体系中仅次于C58c1的又一高转化率菌株。
农杆菌侵染强度是侵染菌液浓度、侵染时间和共培养3个综合因子的组合,对遗传转化效率至关重要。Gurlitz 等[19]认为,植物细胞有一个可承受的农杆菌侵染强度的阈值,超过该阈值,植物遗传转化率下降。增加侵染菌液浓度、延长侵染时间或共培养时间都可加大农杆菌侵染强度。因此,本研究在固定侵染浓度和共培养时间的基础上探索适宜的侵染时间和乙酰丁香酮对转化率的影响,通过比较gus表达率/表达频率和抗性苗率筛选出了C58c1介导胡麻下胚轴遗传转化的侵染强度,这与周蕴薇等[20]在农杆菌介导的地被菊遗传转化体系研究中的分析方法一致。
4 结 论
胡麻转化因子中的草铵膦选择浓度、下胚轴预处理、农杆菌菌株、侵染时间,以及乙酰丁香酮都影响着胡麻的遗传转化效率。经过对上述各转化影响因子的参数优化筛选,说明胡麻下胚轴再生的不同阶段对草铵膦的敏感性不同,愈伤组织诱导、分化和再生苗生根阶段草铵膦选择压分别是10 mg/L、5 mg/L和2 mg/L;对胡麻下胚轴进行去表皮预处理和预培养都显著影响抗性苗分化率,对gus表达率无显著影响;农杆菌菌株和侵染时间同时影响gus表达率/频率和抗性苗率:AGL1、C58c1、EHA105、GV3101和LBA4404 5个菌株中C58c1为最优侵染菌株,侵染60 min时gus表达频率最高,在共培养阶段添加100 μmol/L乙酰丁香酮能显著提高转化愈伤组织的gus表达频率。
