pH响应型纳米药物载体的释药机制及性能研究进展
2018-08-01李祥子胡平静朱振铎朱国兴沈小平冯德香
李祥子 胡平静 朱振铎 朱国兴 沈小平*, 汪 茗 孙 玉 冯德香
(1江苏大学化学与化工学院,镇江 212013)
(2皖南医学院药学院,安徽省多糖药物工程技术研究中心,芜湖 241002)
0 引 言
当前,纳米材料的可控合成、功能化及其生物学评价已得到了人们的极大关注,并被广泛用于药物传输、磁共振造影、生物分离、荧光成像、光热治疗等生物医学领域[1-4]。纳米载体因其独特的纳米效应而有望成为药物或基因的靶向输送工具,进而为癌症的诊断和治疗带来新的机遇[5]。近年来,纳米载体的研究正在不断革新,脂质体、胶束、聚合物、枝晶、磁性纳米粒子及碳纳米管等类型的载体不断涌现。然而,纳米药物载体的研究仍然面临一些困难,如抗癌药物的过早释放会产生很强的毒副作用,非靶向性释药会降低病灶部位的抗癌效果,等等。而精准智能释药则是提高纳米载体抗癌效果的有效途径,这通常需要赋予纳米载体刺激响应性能。常见的刺激响应方式有 pH[6-8]、热[9-10]、红外光[11-12]以及生物分子[13-15]等,其中pH响应是实现智能释药的最主要策略。这是由于炎症组织(pH=6.5)和肿瘤组织(pH=6.5~7.2)的pH值通常低于正常组织(pH=7.4)[16]。不同细胞组分也存在跨膜pH梯度,如溶酶体pH=4.5~5.0,内涵体的pH=5.5~6.0,线粒体pH=8.0。这些微环境的差异为pH响应纳米载体的区域给药或定点治疗提供了前提。此外,对于肿瘤的治疗,一般是希望纳米载体在生理pH值下保持药物零泄漏,在肿瘤位置进行酸敏性释药。而对于口服给药,则希望纳米载体能在肠道的碱性环境中智能释药[17]。为达到这些目的,需对纳米载体进行分子设计,以便获得不同释放机制的pH响应型纳米药物载体。迄今为止,虽然已有少量关于聚合物胶束、碳纳米管载体、Fe3O4磁响应载体以及介孔硅载体的相关评述,但针对pH响应型药物载体释药机制及其体内外生物学评价,特别是这类载体的负载、释药以及细胞毒性等实验参数还未见系统评述。本文将针对各类pH响应型纳米载体的释药机制及性能进行较为全面地述评,以期为纳米药物载体的深入研究提供借鉴和参考。
1 pH响应型纳米载体的释药机制
1.1 共价键引发的pH响应释药机制
纳米材料的表面功能化,使之与药物分子以共价键方式相连是获得智能纳米药物载体的最常见途径,该类型纳米载体具有较高稳定性,可有效防止药物在生理条件下的提前释放。但为获得更佳的疗效,载体中的药物需在特殊酸性或碱性环境下得以控释,这便要求连接药物的共价键具有pH响应性能,常见具有pH依赖性的共价键有以下几种类型。
1.1.1 胺键引发型
亚胺键(C=N-)在酸性条件下易发生水解,利用亚胺键可对纳米载体进行表面氨基化修饰,使之与阿霉素(DOX)等分子中的羰基反应形成亚胺键,通过调节pH值可实现载体上DOX的酸敏性释放[18-19],其中安息香亚胺[20-21]和聚乙烯亚胺(PEI)[22]就是最典型的酸敏性亚胺。与亚胺键相似,腙键(-NHN=)也是常见的酸敏性共价键,其拥有pH响应性的关键仍是其内部的亚胺部分,且腙键中氨基较大的电子云密度,使其在酸性条件更易水解,故更多地被应用于酸敏性药物载体的构建[23]。为了更好地发挥腙键在纳米载体智能释药中的效能,通常需要对载体进行表面修饰。至今,聚胺(PAMAM)枝晶[24]、C60-PEI[25]、2-脱氧葡萄糖-PEG[26]、氨基化 β-NaYF4∶Gd3+/Tb3+[27]、肼[28]、透明质酸(HA)[29]、肽聚糖[30]等均已广泛用于载体的表面修饰,从而获得了不同特点和功能的酸敏性腙键。此外,纳米载体与药物分子间也可通过酸敏性的酰胺键相连[31-32]。最近,Li等[33]就利用酰胺键将熊果酸(UA)连接到介孔硅纳米球上获得UA@MSN-UA体系,通过pH响应的酰胺键引发快速释药(图1)。
1.1.2 缩醛(酮)引发型
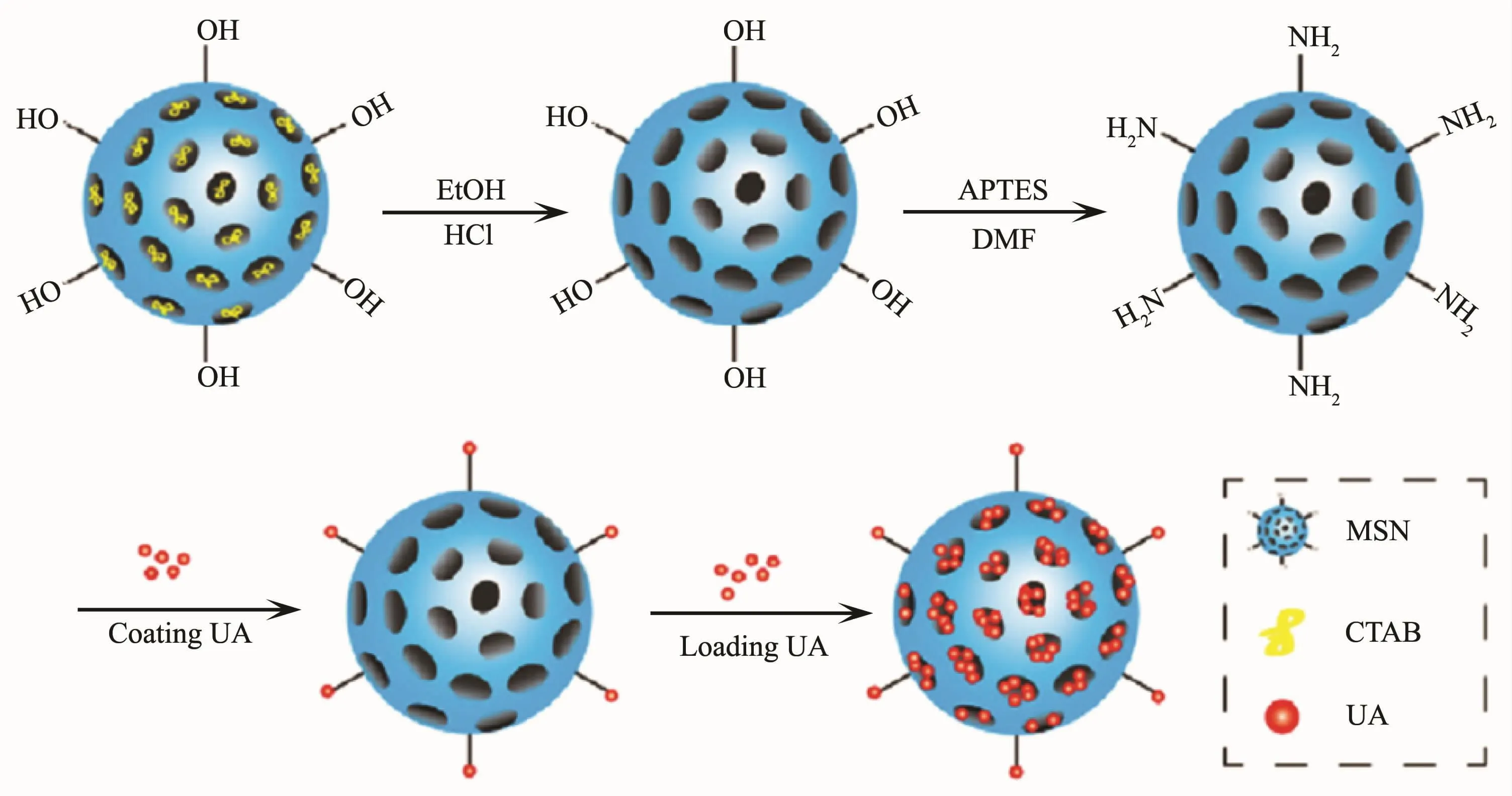
图1 UA@MSN-UA控释过程[33]Fig.1 Controlled-release process of UA@MSN-UA[33]
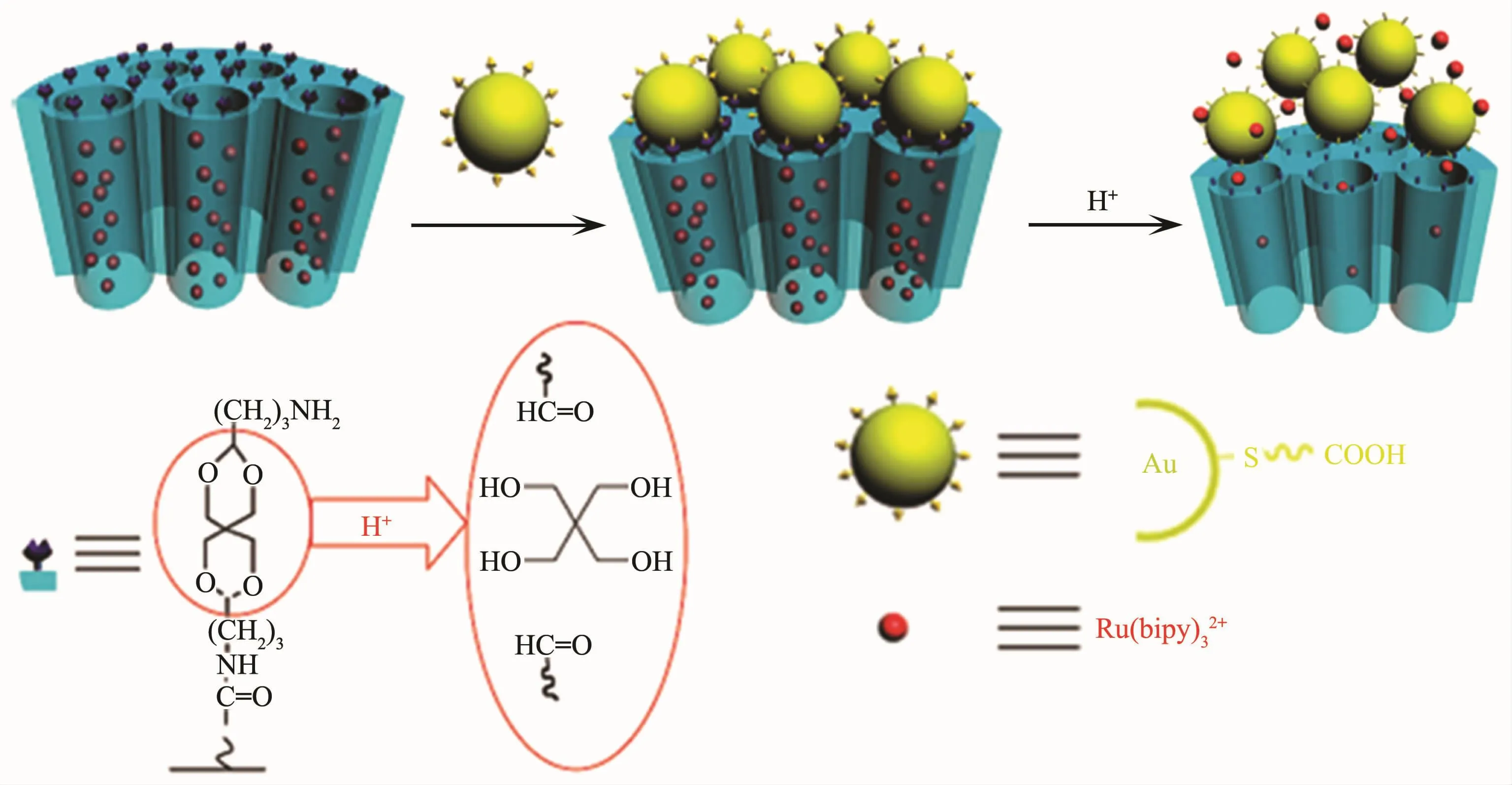
图2 金帽修饰介孔硅的控释[34]Fig.2 Controlled-release of gold-capped mesporous silica[34]
缩醛(酮)可由醛(酮)与醇按计量比 1∶2缩合而成,其在酸性条件下易水解,故可作为酸敏性分子用于药物载体pH响应“开-关”的构筑(图2)[34-35]。其中缩醛更为多见,如在弱酸环境下,两亲HAMAFA-b-DBAM聚合物分子中的缩醛键断裂,憎水部分转变为亲水部分,进而引发释药[36]。聚(N-琥珀酰亚胺酯)与DOX也可形成缩醛,在酸性条件下引发释药[37]。聚乙二醇(PEG)作为一种生物相容性良好的聚合物是形成缩醛的常用试剂,常用于纳米载体的表面修饰。例如,利用PEG与活性阴离子的开环聚合反应可获得一系列拥有不同憎水长度的两亲聚合物PEG-b-PEEGE,这些聚合物可在溶液中通过自组装方式形成形状可控的胶束,在pH 4.0时通过缩醛水解实现对尼罗红的控释[38]。
1.1.3 酯键引发型
药物分子可与纳米载体表面的官能团直接形成酯键,在特定环境下通过酯键水解断裂的方式实现对药物的控释。如Fang等[39]将可生物降解的聚(β-氨基酯)自组装到氧化铁纳米粒子表面,该酯在pH 5.5和6.4的弱酸环境下发生水解而释药。就酯键水解释药的调控而言,氨基磷酸酯可根据体系pH值对氨基类药物分子进行选择性控释,这是因为吡啶或羧酸盐等酸性基团可通过分子内的酸性机制促使氨基磷酸酯P-N键的水解,其水解速率受到胺的pKa影响,故而可用于抗体、小分子药物、药物洗脱支架以及染料等物质的控释[40]。也有研究发现,硫代丙酸酯具有很好的酸敏性水解性能,其不仅可通过核交联反应用于药物分子的共价键连接[41],而且还可作为介孔材料上的孔洞开关,用于孔内药物分子的控释。例如,Yang等[42]以β-硫代丙酸酯(乙二醇)(P2)作为介孔硅的孔洞开关,获得Fe3O4@mSiO2@P2药物载体。中性条件下β-硫代丙酸酯稳定并可防止孔洞内药物的逃逸,pH 5.8环境下因水解而断键,引发孔口的开放和药物的释放。此外,硼酯也可作为孔口开关用于酸敏性释药,其水解释药的速率还可通过pH值进行调控[43]。
1.1.4 配位键引发型
利用药物和纳米载体表面修饰基团的配位作用也可实现pH响应的药物释放。如Sasikala等[44]用聚(2-羟乙基丙烯酸甲酯-多巴胺甲基丙烯酰胺)共聚物修饰超顺磁氧化铁纳米粒子,并连接含共轭硼酸的硼替佐米药物,获得一种仿生智能磁性纳米平台(BTZ)。发现多巴胺中的儿茶酚基团可通过不可逆金属-配体交换或可逆金属-配体配位的方式与各种金属氧化物产生强烈的绑定作用,以致在儿茶酚和BTZ之间形成pH响应型的可逆配位键,这种配位键可在酸性环境下断裂而引发释药。Zhao等[45]为实现水溶顺铂的持续释放和长时间瘤内滞留,通过Pt-羧基配位键的形成合成出热/pH双敏感纳米凝胶,pH值降低会促使羧基的质子化,导致Pt-羧基配位键的大量断裂而释放顺铂。
1.1.5 其它共价键引发型
1,3,5-三氮杂金刚烷(TAA)是一种在中性或碱性条件下均可稳定存在的水溶性物质,但在pH<6.0的酸性环境下则迅速水解成三(氨基甲基)乙烷(TAE),其水解速度可通过芳环上取代基进行调节[46]。利用TAA可将超顺磁Fe3O4纳米粒子锚定到介孔硅的孔口处,获得MCM-TAA-Fe3O4组合体。利用TAA在内涵体微酸环境中水解,移除孔口处的Fe3O4纳米粒子,实现孔内地塞米松的控制性释放[47]。
1.2 分子间作用力引发的pH响应释药机制
除了共价键以外,静电作用、氢键作用、π电子作用及超分子作用等也是纳米载体智能释药的常见引发因素。这些分子间作用力的大小可通过纳米材料的表面化学状态及介质的pH值进行调控,具有种类多、响应快及易调节等优点,广泛用于药物载体的刺激性响应[48]。
1.2.1 静电作用引发型
在药物传递体系中,静电作用可用于吸附DOX、抗菌肽等阳离子药物或带正电的纳米粒子。在基因治疗方面,为实现对细胞的基因介导,静电作用也可将一些带负电的血浆酶及小干扰RNA(siRNA)等负载到带正电的载体上用于细胞转染。通过调节介质pH值可改变载体或药物分子的荷电情况,调节它们的静电作用,引发药物的刺激性释放[49]。
载体表面荷电状态的改变一般是通过包覆分子的质子化或去质子化得以实现。典型的pH响应物质就是聚丙烯酸 (PAA),其在酸性条件下发生质子化,会降低PAA和某些药物分子间的静电引力,引发释药[50-53]。若想更好地利用PAA的静电释药性能,还需对PAA或药物进行分子设计,如Pourjavadi等[54]就设计合成出聚乙二醇功能化的淀粉-聚丙烯酸共聚物,用其包覆聚酰胺修饰的Fe3O4纳米粒子,利用氨基对邻近丙烯酸的去质子化作用促进载药,酸性条件下PAA质子化,导致静电引力消失而释药。Salehi等[55]在研究聚甲基丙烯酸对DOX和甲氨蝶呤2种药物的pH响应性能时也发现,在pH 5.5的介质中,羧基水解会导致药物和载体都带正电,产生的静电斥力促使载体结构疏松而释药。此外,硅烷醇[56]、聚乳酸[57]、聚-L-赖氨酸[58]、海藻酸钠[59]、聚多巴胺[60]、维生素 B6[61]、聚合物中的咪唑环[62]、碳胶囊[63]、锂藻土(LAP)[64]等修饰物以及阿司匹林[65]、甲氨蝶呤[66]等药物分子均具有pH响应的电荷反转性能,故可通过静电作用的变化实现纳米载体的药物控释。针对这类电荷反转性能,Bigall等[67]通过在纳米珠表面引入3种不同氨基聚合物,获得了pH值可调的荷电表面,实现纳米珠在pH 3.5释放带正电的金纳米粒子,在pH 9释放带负电的siRNA(图3)。
1.2.2 氢键引发型
药物分子的结构中常含有氟、氧、氮等电负性较大的元素,易与表面功能化后的纳米载体形成氢键,当pH值变化时,该氢键又因结构的改变而被破坏,进而可实现对药物的负载和控释。为获得具有pH响应性能的氢键,一般需要设计出一些具有特定结构和功能的生物相容性物质,对纳米载体进行表面包覆。例如,丙烯酸分子本身的羧基容易与药物分子中的氨基形成氢键[68],并可进一步设计成N-异丙基丙烯酰胺-丙烯酸共聚合物[69]或嫁接到金纳米粒子上[70],从而获得更强的酸敏性响应性能。

图3 聚合修饰纳米珠在不同pH值时的释药状况[67]Fig.3 Release status of the polymer modified nanobeads at diffirent pHvalues[67]
多功能化氧化石墨烯(GO)纳米异质结因其优异的生物相容性,已在生物传感、成像、药物传递等生物医学领域引起了人们的广泛兴趣。GO表面拥有大量亲水含氧基团,经功能化后可获得酸敏性能。例如,石墨烯上的羧基可与5-氟脲嘧啶(5-FU)中的O、F、N原子形成氢键,在酸性环境中,5-FU上的-NH-可与H+结合形成-NH2+-,导致氢键断裂[71]。此外,磁性GO上的-OH和-COOH与DOX或EPI上的-OH和-NH2之间的氢键,在酸性环境中减弱也可促进释药[72]。若在GO基底上沉积磁性介孔硅,然后嫁接末端连有五亚乙基六胺的聚酰胺树枝状分子,其乙烯胺链间存在的众多氢键在pH 5.5时也会出现减弱[73]。最近,Zhang等[74]以己二酸二酰肼为连接剂合成出一种新型肝磷脂 (Hep)修饰的GO纳米载体,DOX与GO-ADH-Hep间的氢键在低pH值下减弱,可引发快速释药。另一方面,从药物分子而言,5-FU[75-76]、足叶草毒素[77]、万古霉素[78]等药物因其分子结构中就具有氢键,故而成为典型的氢键响应药物模型。
在实际分子间作用力的调控过程中,静电作用和氢键有时是共存的,发挥着协同的释药效果。此外,分子间的π-π堆积效应[79-80]、主客体作用[81]等在pH刺激响应过程中也发挥了积极作用。在今后纳米载体的研究过程中,多种分子间作用力对药物的协同控释将是一个重要研究内容。
1.3 物理结构引发的pH响应释药机制
1.3.1 聚合物溶胀引发型
聚合物一般具有结构可调、生理环境稳定等优点而常用作纳米载体的复合材料,其在酸性环境中可发生降解或溶胀,导致聚合物的物理结构因疏松而释药[82-83]。常见用于纳米载体复合的可降解聚合物包括聚丙烯酸类、壳聚糖类以及聚氨基酸类等。
丙烯酸类物质在pH值变化时会因自身分子间作用力的改变而发生物理结构的变化,进而对药物分子起到间接的物理包封和开关作用[84-85]。例如,Wen等[86]采用聚甲基丙烯酸包覆Fe3O4@mSiO2获得pH敏感凝胶微球,发现溶液pH值高于丙烯酸的pKa(4.28)时,羧基之间因氢键作用而使网状聚丙烯酸呈收缩状态,低于4.28时,羧基间的氢键减弱、亲水性增大,呈溶胀状态,故可通过聚丙烯酸水凝胶的体积相转变实现药物的控释。Pérez等[87]利用CBA作为交联剂,通过微乳液聚合法合成出基于聚-N-异丙基丙烯酰胺(NIPA)、HEAA和2AAECM的纳米凝胶(HGs)。酸性环境下,HEAA单体上的氨基质子化产生斥力,导致纳米凝胶的膨胀。Bardajee等[88]以淀粉修饰的GO、N-异丙基丙烯酰胺和丙烯酸组装成新型纳米凝胶。酸性条件下,丙烯酸单体上的羟基和羧基质子化,产生斥力导致纳米凝胶松弛而释药。Zhu等[89]结合电纺和UV光聚合技术合成出pH敏感的PLA/PAA核壳纤维。pH 5.0时,羧基解离产生强烈的静电斥力,促使PAA壳的溶胀而释药。除了以上酸响应的类型外,一些基于丙烯酸的衍生聚合物也可呈现出弱碱性响应特性[90]。如以甲基丙烯酸为原料,可分别与聚乙烯吡咯烷酮[91]或2-氨乙基甲基丙烯酸酯盐酸盐[92]反应获得不同的新型聚合物,可在pH 7.2或7.4的弱碱性条件下达到最大溶胀。Anirudhan等[93]利用丙烯酸嫁接壳聚糖包覆的磁性纳米粒子(CS-MNP),经乙二胺衍生化的β-环糊精修饰,获得一种新型药物传输体系 (DDS)。该体系在pH 1.2下处于坍塌状态,可阻止药物分子从聚合物网中扩散,pH值增加到7.4后,体系溶胀,水分子进入聚合物网,药物分子则可从聚合物网中扩散释放(图4)。 Treenate等[94]用丙烯酸羟乙酯壳聚糖(HC)和海藻酸钠(SA)组装得到的水凝胶能够用作口服药,其在肠液中的释放率会明显增加。不过SA浓度越高,越容易导致药物的突释,且单独的SA在肠液中的稳定性并不高。Medeiros等[95]通过自由基聚合法获得 PNVCL和poly(NVCL-co-AA)聚合物基质,pH 7.4时PAA上的羧基离子化导致聚合物因静电斥力而溶胀,进而加速了释药。
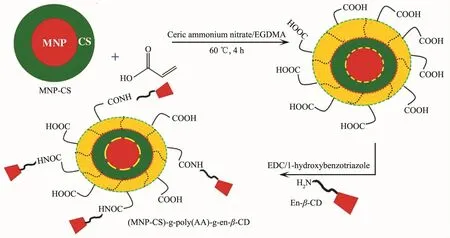
图4 环糊精修饰CS-MNP粒子的释药[93]Fig.4 Drug release of CS-MNP modified with cyclodextrin[93]
壳聚糖是一种生物相容性好、生物粘附性强及可生物降解的碱性亲水聚合物,其分子中氨基和羧基的pKa分别约为6.5和2.9,在pH=2.5~6.6的介质中,壳聚糖因其分子中氨基质子化而发生溶胀。因此,壳聚糖及其衍生物常用于pH响应纳米载体的构筑[96-102],其中壳聚糖的氨基在低pH值下质子化,还会产生较大渗透压,更有利于酸敏性释药[103]。此外,聚 L-谷氨酸[104]、聚 L-组氨酸[105-106]等聚氨基酸类的结构也随pH值的变化而发生溶胀,且具有水溶性好、可生物降解及无毒等优点,属于另一类常见pH敏感聚合物。
除了以上3类常见聚合物,还有其它一些pH响应聚合物被用于纳米载体的释药研究。例如,PEG修饰的树枝状聚苯胺(PAMAM)可从高pH值的“致密核”转变为低pH值的“致密壳”[107],聚丙烯氯化铵与聚苯乙烯磺酸钠双层膜因荷电变化而发生溶胀[108],NaAlg-g-PNIPAAm共聚珠的结构会因海藻酸质子化而变化[109],多段共聚(醚氨基甲酸乙酯)(PEU)在pH 9.2的碱性条件下发生膨胀而释药[110],基于纳米纤维(CNFs)和聚乙烯醇的水凝胶可在弱碱环境下因溶胀而释放顺铂[111]。
1.3.2 磷酸钙类引发型
基于磷酸钙的纳米载体因其优异的生物相容性而可被广泛用于药物、基因或siRNA的传递。早在1973年,Graham和van der Eb首次发现磷酸钙与DNA的磷酸酯具有很强的亲和力[112]。通过生物钙化技术可将磷酸钙包覆在纳米氧化铁的表面,利用磷酸钙的酸溶特点使得载体拥有酸敏性释药性能[113]。Li等[114]将双亲分子凝胶(AG)-氧化铁@磷酸钙纳米粒子与赫赛汀相连,获得AGIO@CaP-CD多功能纳米粒子。其中磷酸钙壳不仅可抑制DOX在细胞外pH环境下的过早释放,而且在酸性环境中磷酸钙壳会发生溶解,这使得该纳米粒子在被靶向细胞内吞后释放药物并产生疗效(图5)。
与磷酸钙类似,羟基磷灰石(HAp)作为骨骼的主要成分,在骨再生过程中起到了关键作用,是一种很有前景的生物材料。HAp在生理pH值下稳定,pH 5.0以下会发生明显溶解。当覆盖有HAp的纳米载体被细胞摄入后,HAp覆盖层就可在靶向致病细胞的内涵体和溶酶体内溶解为Ca2+和PO43-,并释放出负载的药物,表现出酸敏性能。Chen等[115]通过一种快速微波辅助法合成出含有HAp超细纳米带(UNs)和Fe3O4的磁性纳米复合物,该复合材料在弱酸环境下能逐步溶解,继而实现对多烯紫杉醇的持续释放。Zhao等[116]以HAp作为Fe3O4@mSiO2的孔口开关,酸性环境下通过HAp纳米帽的消融实现载体的酸敏性释药(图6)。Weerasuriya等[117]通过中空HAp纳米载体负载8-羟基喹啉铜,发现pH<2时HAp完全溶解,pH=2~7时HAp也会发生轻微溶解,这有利于对肿瘤组织进行靶向输药和定点释药。
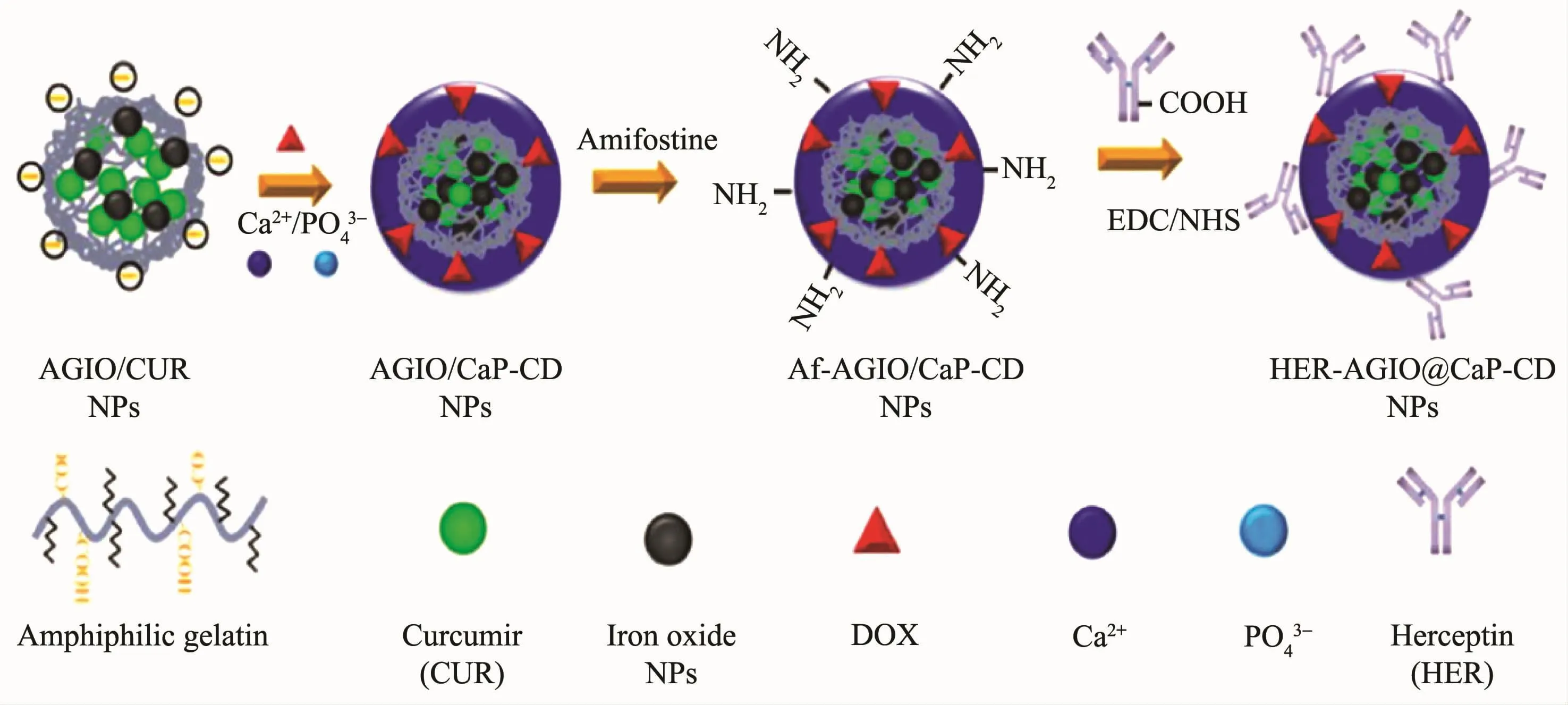
图5 HER-AGIO@CaP-CD纳米粒子合成示意图[114]Fig.5 Synthetic process of the HER-AGIO@CaP-CD nanoparticles[114]
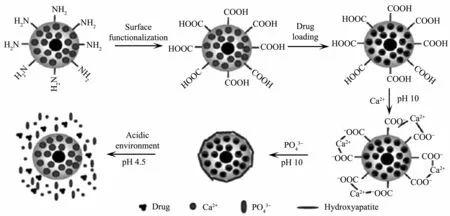
图6 羟磷灰石修饰Fe3O4@mSiO2的释药[116]Fig.6 Drug release of the Fe3O4@mSiO2modified by hydroxyl-apatite[116]
2 pH响应型纳米药物载体的性能
2.1 载药性能
良好的载药性能是纳米载体的重要特征之一,也是实现药物靶向传输和提高疗效的前提。纳米材料的表面化学修饰是改善载体载药性能的关键手段。一方面,可以通过引入氨基等基团增强对芳香性药物分子的负载。如Zohreh等[28]将肼基修饰到磁性纳米载体表面,使其对DOX的负载量达到327 mg·g-1。壳聚糖连接到Fe3O4纳米粒子后可为药物分子提供大量氨基,通过与顺-乌头酸酐相连接可提高对DOX的负载量[31-32]。再如,氧化铁纳米粒子经聚(β-氨基酯)修饰后,药物负载量可达 679 μg·mg-1[39]。Wang等[118]通过加热氢化法合成出亲水性碳纳米纤维(CNF),利用碳表面大量含氧亲水基团获得更优的DOX负载性能,且其负载性能因DOX和CNF的分子间作用而表现出pH依赖性。我们课题组以功能化的碳纳米管或石墨烯为载体,通过Au纳米粒子的再修饰,利用Au-S键实现了对蛋白质的稳定负载[119-120]。另一方面,还可通过对载体表面分子间作用力的设计提高其载药性能。例如,多孔碳纳米胶囊与药物分子间的π-π堆积和静电作用使其对DOX负载量高达1335 mg·g-1[63]。石墨烯与药物之间的π-π堆积和氢键作用可使其负载达到饱和(2.65 mg·mgGR-1),包封率达 88.3%[121]。
随着现代纳米医学和生物技术的迅速发展,人们发现中空多孔材料因拥有高的表面积和大的内容积而在提高载药能力等方面表现出独特优势[64,122-123],其中集诊断和治疗功能于一体的超顺磁纳米腔已成为人们的研究热点之一。如yolk-shell结构[121,124]、FePt 纳米胶囊[125]、中空磁性核壳结构[126]、Fe3O4@C 纳米胶囊[127]、MnOx-碳纳米胶囊(图7)[128]以及有机磁性MOFs结构[129]等都表现出良好的载药性能。中空材料不仅可通过物理吸附的方式将药物分子负载到材料的孔道中,而且还可用于构筑一些适用于内部输药的控释体系,以期获得更高的药物负载率。例如,介孔硅(MSNs)具有化学惰性、孔尺寸可调、孔体积大、表面积高、毒性低以及易修饰等特点,在过去几十年内已广泛用于药物传输体系。目前研究主要集中在具有刺激响应的有序MSNs设计,该结构不仅可有效提高载药容量,而且可在多孔硅孔口处覆盖拥有刺激性响应性能的超分子[130-132]、聚合物(图8)[133-134]、纳米粒子[135]或硼酸酯[136]等。 这些“控制帽”或“纳米阀”不仅可减少药物在传输过程中的过早释放,而且可通过pH刺激下的水解或分子间作用力的变化引发释药。为探索新型高负载率的中空纳米载体,我们课题组对磁性金属纳米管的合成、复合及性能进行了系列研究,发现这些磁能纳米管具有内外双活性表面,其中Ni@C纳米管对DOX的包封率可达99%以上,Ni纳米管经包覆后,细胞毒性得到明显改善,进而为磁性管状载体的深入研究奠定了基础[137-140]。
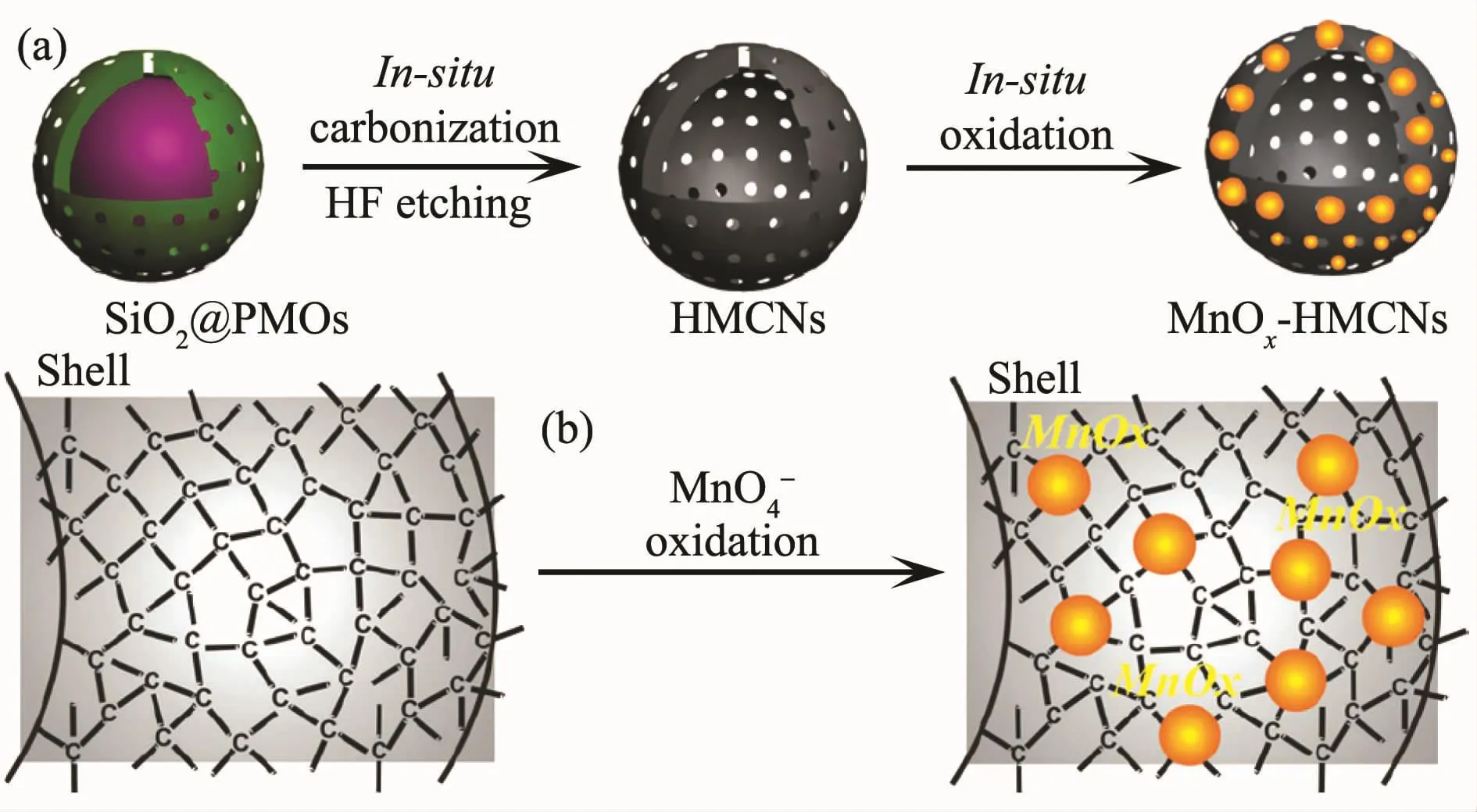
图7 MnOx-HMCNs的合成及形成机理[128]Fig.7 Synthetic procedure and formation mechanism for the MnOx-HMCNs[128]
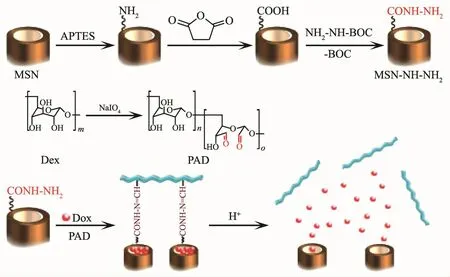
图8 HER-AGIO@CaP-CD纳米粒子的释药过程[134]Fig.8 Drug release process of the HER-AGIO@CaP-CD nanoparticles[134]
除了载体的表面修饰和结构设计外,负载条件对载体的载药性能也有一定的影响,表S1(Supporting Information)给出了一些常见pH响应纳米载体的载药条件。一般而言,纳米粒子越大,越容易被免疫系统清除。100 nm的纳米粒子在人体具有较为理想的分布和较好的清除/集聚行为[127]。从表S1可以看出,pH响应型的纳米载体的尺寸范围一般从几个纳米到几百个纳米不等。用于负载的药物包括DOX、布洛芬、罗丹明6G、硼替佐米、表阿霉素、多西他奇、吉西他滨、地塞米松、5-氟嘧啶、顺铂、紫杉醇、雷帕霉素、溴代噻唑及双氯芬酸等,其中DOX最常见。负载DOX时,因载体合成难易程度及后期缓释模式的不同,载体的用量可从几毫克到几百毫克变化,负载时通常用纯水或PBS为媒介。其中以纯水为媒介时,相同载体在不同pH值下亦表现出不同的DOX负载率,弱碱性水溶液或中性PBS溶液(pH=7.4)更有利于DOX的负载。为获得相对更高的药物负载率,DOX的负载一般更易在中性pH值时进行,其浓度一般在1.5 mg·mL-1以内,体积多为几个毫升,载体对药物的包封率(EE)一般可达70%以上,而负载率(LE)一般小于50%。由于载体类型、负载条件均存在差异,药物包封率和负载率的高低也不易直接进行比较,但可为纳米载体载药条件的筛选提供参考。
2.2 体外释药性能
pH响应型纳米药物载体的最大释药特点就是可通过调节媒介的pH值实现载体的智能释药,其释药的pH响应点一般在2.0、5.0和7.0,可大致对应于胃酸、肿瘤组织及正常组织的pH值,这为纳米载体在靶向输药和定点治疗等方面的应用提供了可能。
在pH响应释药过程中,纳米载体的结构及药物的溶解性共同影响了载体的体外释药性能。如24 h内,NaAlg-g-PNIPAAm共聚珠在pH 1.2时的最大释放率为7%,而pH 7.4时最大释放率增大至82%。这可归因于共聚珠本身构造的变化以及IM药物的溶解性增大[109]。Wu等[50]用丙烯酸修饰的多功能磁性介孔硅纳米球研究DOX释放时发现,载体外层聚合物有助于24 h内的DOX缓释,而载体的介孔结构可导致24~30 h内的DOX突释。然而,Wang等[63]在研究pH 5.0时多孔碳纳米胶囊释放DOX行为时发现,刚开始时DOX的释放率依赖于pH值,16 h后的释放量与时间呈线性关系,认为DOX的释放可分为pH控制突释期和多孔胶囊扩散缓释期。Anirudhan等[93]在研究壳聚糖包覆、环糊精修饰的磁性纳米载体的释药性能时发现,pH 7.4时,药物的24 h释放率达50.7%,48 h达86.8%。认为药物的前期突释可归因于载体表面的物理绑定,而后期缓释是来源于孔洞和环糊精的药物扩散,这是因为药物和环糊精间的主客体作用的改变需要较长时间。Ghorbani等[66]研究了一种双响应核交联纳米凝胶对甲氨蝶呤的释放,发现24 h内,pH 7.4时释放率42%,而pH 5.3时释放率为64%,认为载体的物理诱捕及其对药物离子吸附可有效阻止药物的突释。最近,Roozbahani等[64]将锂藻土纳米粒子用于地塞米松(DEX)的释放,发现 DEX 在 pH=3、7、13时,释放率分别为 (43.3±9.4)%、(59.4±1.7)%和 (35.6±5.2)%,认为这种突释是由于锂藻土边缘处药物的释放所致,而DEX总释放需3 d才能达到平衡。由上可知,纳米载体的释药行为与其微观结构、包覆成分、修饰组分、包覆次序等均有关系,突释和缓释的先后顺序及产生的原因也会有所差异。
除了载体结构和药物性质,释药模式也会对载体释药性能的评价产生很大影响。传统模式是将荷药载体直接分散到媒介中,通过测量媒介中药物的吸光度评估释药性能[24,44,76,92,99,115,141]。当媒介体积较大时,可直接移取少量媒介进行检测;当媒介体积较少时,需在检测后将检测液倒回原体系或补充新鲜媒介,以维持总体积不变。这种方式相对简单,但一般需要的载体量较多。另一种模式是将荷药载体制成片状,再进行释药研究。例如,通过药物淋洗装置用磷酸缓冲液淋洗荷药载体,120 h后pH 7.4和5.0的累积释放率分别可达73.7%和96.8%[45]。Dey等[90]在研究片状载体释药时还发现,药片首先吸水发生水合和溶胀,然后药片中的聚合物发生松弛,最后药片中的药物从水合聚合物结构中释放到媒质中。
为减少纳米载体在体外释药研究中的损失,同时提高释药研究的效率,近年来逐步兴起了“透析袋式”释药模式,即将少量荷药纳米载体封闭于透析袋中,然后将整个透析袋置于一定体积的媒介中振荡,通过检测透析袋外媒介中药物浓度评价载体的释药性能。然而,我们在磁性管状纳米载体的体外释药研究过程中也发现,除了载体的表面修饰和结构设计外,透析袋规格、缓释介质pH值、缓释介质浓度、替换液体积以及振荡速度等条件对载体释药性能的评价均有一定的影响。根据我们的研究结果,并结合近年来常见透析袋式释药参数(表S2),发现影响载体体外释药性能的因素主要有以下4个方面:(1)透析袋的规格。透析袋内外会产生“区域浓度”及渗透压力[103],在一定程度上“延缓”了袋内药物向袋外释放,延长了载体的释药时间。影响透析袋“延缓”效应的内在因素是其截留分子量(NMWC)——透析袋孔径大小的量度。一般透析袋的孔径越大,袋内外的物质交换就越快,载体释药效率就越高。然而,为了避免纳米载体穿过透析袋,透析袋的孔径又不能太大。鉴于目前所合成纳米载体的尺寸,透析袋的截留分子量一般介于3 500~15 000 Da,其中以3 500 Da为主。(2)透析袋内外媒介参数。袋外媒介体积越大,越有利于载体释药,一般为5~100 mL。而袋内载体媒介体积为1~10 mL,其中2 mL最为常见。从24 h释放率还可以看出,缓冲介质的pH值也会影响到载体的释药性能,考虑到正常组织和肿瘤组织的微环境,pH值大多为5.0、6.5及7.4,一般pH值越低,释放率相对越大,表明载体具有良好的酸敏性释药性能。(3)替换液体积。为了方便检测、减少误差,“透析袋式”释药采用提取少量袋外媒介进行检测,并添加相同体积的新鲜媒介,通过计算袋外媒介中药物的累积释放率评估载体的释药性能。媒介的替换体积在0.2~15 mL之间,其中大多为1~3 mL。通常替换体积越大,越有利于载体释药。(4)替换时间及振荡速度。通常袋外媒介的替换频率越高,载体的释药速度也就越快。此外,释药时的振荡速度越大,越有利于袋内外“区域浓度”的平衡,载体释药速度也越快。所以,对于纳米药物载体,若释药方式和条件不尽相同,其释药性能也不好直接比较。
2.3 体外细胞毒性
良好的生物相容性是纳米载体进行生物医学应用的前提条件。体外MTT细胞活力实验则是评估纳米载体生物相容性的重要手段。纳米材料的成分不同,其生物相容性也有很大差别。目前公认生物相容性较好的无机材料有介孔硅、氧化铁、羟磷灰石及石墨烯等,毒性低的有机修饰物常有壳聚糖、环糊精及聚合物等。这些无机材料和有机修饰物之间的组装是获得更多低毒高效纳米载体的重要途径[71,116,142]。表S3列出了常见pH响应型纳米载体的体外毒性实验参数。从表S3数据可以看出,载体体外细胞毒性实验使用的细胞株多为 Hela、HepG2、MCF-7、NIH3T3等,各载体在实验时所用浓度随其成分的不同而有较大差别,但在各自最大实验浓度时,细胞的24 h存活率均超过60%,多为85%以上。可见,各载体在其实验浓度范围内均表现为无毒或低毒,这不仅为其生物应用奠定基础,同时也为其它pH响应纳米载体的毒性研究提供参考。
pH响应纳米载体的一个独特优势就是可在肿瘤微酸环境中智能释药,可延长药物在生物体系的血循环,增加肿瘤位置的药物集聚[61]。表S3还统计出常见荷药载体的体外抗肿瘤效果。不难看出,用于载体研究的抗癌药物多为DOX。相比纯DOX,荷药载体一般具有更低的半致死浓度,表明纳米载体和DOX可以起到协同的抗癌效果,这一点也可通过免疫印迹的分析结果得以证实[26,30]。
随着纳米载体研究的不断深入,流式细胞技术也逐渐用于纳米载体的毒性研究。例如,Li等[33]利用流式细胞技术研究了UA@MSN-UA对Hela细胞的循环分布及凋亡性能,结果表明,相比纯熊果酸(UA),UA@MSN-UA能通过细胞周期阻滞的方式抑制HepG2细胞增殖,表现出更强的诱导HepG2细胞凋亡作用。类似地,Chen等[77]研究也发现,相对于纯的足叶草毒素(PPT),负载PPT后的壳聚糖纳米粒子可通过激活细胞凋亡信号通路诱导细胞凋亡。此外,利用荧光辅助流式细胞技术还可评估载体的细胞摄入情况[29,143]。
2.4 体内抗癌性能
相比体外抗肿瘤研究,纳米载体的体内抗癌性能研究更为复杂,影响因素也相对较多。鉴于肿瘤组织的弱酸环境,pH响应纳米载体的体内抗癌性能主要体现在载体修饰前后、荷药前后及其与单纯药物的比较研究。如Zhu等[26]通过体内急毒性实验证实了腙键修饰的聚精氨酸/脱氧葡萄糖量子点(9R/DGQD)具有良好的生物相容性。通过病理学研究、器官指标、肿瘤体积及动物体重等评估了材料的体内抗癌活性。结果表明,该量子点经过DG-PEG和9R修饰后,毒副作用降低,并可有效抑制皮下肿瘤组织的生长。Deng等[35]将负载DOX的mPEG-b-(PCL-g-P(DA30-co-DMAEMA20))胶束经尾静脉注入荷瘤Balb-c小鼠体内,12 d后可发现4T1肿瘤的体积明显变小,20 d后仍能保持良好的抗肿瘤药效,小鼠的体重并未发生明显变化。Ma等[56]将金纳米帽修饰的磁核介孔硅复合纳米材料(Au NRs-MMSNEs)通过静脉注射输入荷瘤鼠体内,发现0.5 h后该纳米材料可快速分散到整个肿瘤组织,经808 nm光照射5 min,局部温度可达55℃,可获得良好的抗肿瘤效果。Sharma等[61]研究了维生素B6修饰的核电反转型DOX-B6-SA-NP纳米粒子在细胞内的DOX传递,发现相对于纯的DOX,该荷药纳米粒子表现出更高的药物疗效和更低的细胞毒性。Zhang等[74]将石墨烯-己二酸二酰肼-肝磷脂/DOX纳米粒子(GO-ADHHep/DOX)静脉注射到小鼠体内,发现该复合纳米粒子相比纯DOX表现出更长的滞留时间,这可归因于DOX与GOADH-Hep之间的强烈相互作用。Li等[114]将DOX-AGIO@CaP-CD双药物纳米粒子从尾静脉注射到荷瘤鼠体内,发现该纳米粒子可有效抑制小鼠体内肿瘤的生长,这是因为赫赛汀配体的抗原-抗体反应可加强细胞对该纳米粒子的摄入。
2.5 体内分布性能
pH响应纳米载体进入动物体内后,其体内分布会受到多种因素的影响。常见的有以下3种情况:(1)生理性分布。纳米载体经静脉注射到动物体后,很容易被体内的网状内皮系统(RES)识别,故而会优先集聚于肝脏和脾这两个重要的网状内皮系统器官。肾脏作为重要的消除器官也有利于纳米载体的循环聚集。因此,纳米载体的体内分布及毒性研究一般都选择肝脏、脾、肾脏等器官,通过这些器官的病理性改变评估纳米载体的体内安全性。(2)磁场导向分布。对于磁性pH响应多功能纳米载体,外磁场可实现体内载体的靶向分布。有研究表明,无外磁场时,纳米粒子主要集聚在肝脏中,有磁场时,纳米粒子更多地集中在肿瘤细胞位置,肝脏、肺、脾脏和肾脏中集聚量明显降低。但磁场使用时间过长也会导致载体的释药变缓,从而限制了载体中药物在肿瘤中的分布[114]。(3)靶向性分布。靶向性分布主要是针对于荷瘤鼠的抗癌研究。一方面,肿瘤组织因其高通透性和滞留效应(EPR)会促使纳米载体的被动靶向,加之纳米材料具有良好的穿刺和滞留性能,使得纳米载体更有利于在肿瘤位置的集聚。例如,相比纯DOX,GO-ADH-Hep/DOX纳米粒子被肝脏和脾摄入的更多,表明血循环过程中发生了RES系统的摄入。而心脏、肺和肾脏的摄入含量相对较低,这有利于降低载体的毒副作用[74]。另一方面,可通过特殊的分子识别实现纳米载体的主动靶向分布。例如,叶酸具有稳定性高、低成本以及非免疫源性的优点,可以连接很多分子,在人体乳房、卵巢、肺、肾及其它各种癌中过表达。经其修饰的纳米载体可主动靶向分布到肿瘤细胞,已成为一种最有前景的癌细胞靶向试剂[6,36-37,73,81,106,126]。对此,我们课题组分别利用叶酸修饰的海藻酸钠/植物甾醇聚合物 (FPA)、生物素/淀粉(FBP)以及NIR光活性纳米粒子,研究了其靶向叶酸过表达受体癌细胞的行为。结果发现,经叶酸修饰后的纳米粒子对KB细胞表现出更高的荷药载体摄入率和更低的细胞半抑制浓度(IC50),这是因为叶酸受体可调控细胞的内吞作用,并可有效减少纳米载体的毒副作用[144-146]。此外,脱氧葡萄糖也可以通过调节肿瘤低氧区的靶向效应,有效提高聚精氨酸/脱氧葡萄糖修饰量子点的主动靶向性,使修饰后的量子点在肿瘤位置可滞留48 h。(4)代谢性分布。纳米载体除了静脉注射以外,还可通过皮下注射及口服灌胃方式输入动物体内,但不同的输入方式会产生不同的代谢效果,进而影响到载体的体内分布。例如,Dou等[147]通过药物代谢动力学研究发现,经皮下注射的载体,其药物可在小鼠体内滞留13 d,并出现轻微的集聚现象,这主要是因为该载体的体内释放要取决于载体扩散和水解两种因素。通过载脂蛋白E敲除小鼠的动脉粥样硬化研究发现,皮下注射的纳米粒子更易被传输到动脉粥样硬化斑。而相同剂量载体经口服灌胃,会在血液和主动脉中被快速分布和清除,72 h就被完全清除。
3 总结与展望
pH响应型纳米载体是当前国内外生物医学领域的一个研究热点,近年来也取得了很好的进展,基于共价键、分子间作用力及载体结构变化的pH响应机制逐步清晰化和明确化,pH响应型纳米载体的定向传输及智能释药研究正不断深入,新型pH响应型纳米载体正在不断涌现。载体的细胞毒性及抗癌性能已逐渐从体外细胞水平转向活体研究,流式细胞、免疫印迹、免疫组化、活体成像等生物医学技术也已逐步用于载体的生物学评价。
在纳米载体的研究领域,化学、材料学、生物化学及免疫学等多学科融合的趋势正在逐步增强,pH响应型纳米载体已在癌症诊断和治疗等方面表现出独特的优势和潜在的应用前景。但相关技术仍处于基础研究阶段,仍有不少关键技术有待进一步研究:(1)研究方法缺少“金标准”。pH响应型纳米载体的负载、缓释及细胞毒性等研究,都是建立在各自实验的基础上,还没有相对统一和公认的衡量方法,不同载体之间的可比性不强。(2)体内研究有待深入。与体外环境不同,pH响应型载体在体内会受到体内血循环、体内代谢及器官分布等多种因素的影响,其体内传输、控释及治疗效果均有待深入评估。(3)多药物负载是个发展趋势。具体表现在,同一载体负载两个以上药物,实现多药物协同治疗和多药物按需释放等;载体携带多个基因片段或抗体,实现基因介导或免疫治疗等特殊功能。(4)多孔性载体是个重要内容。基于介孔硅、有机MOF结构、纳米胶囊以及纳米管的多孔载体,具有更大的负载性能和可控的释药途径,有可能成为今后pH响应型纳米载体的首选对象。为此,我们也正在对磁性管状纳米载体进行进一步的研究。总之,良好的生物相容性、智能的靶向性、超高的负载率、智能的释药性等依然是pH响应型纳米载体研究的主要内容,集多种性能于一体的纳米载体仍然是一个重要挑战。
Supporting information is available at http://www.wjhxxb.cn
