松果菊苷通过上调miR-34a减轻心肌细胞缺血再灌注损伤
2018-07-28蔡华张领李满生李新峰
蔡华,张领,李满生,李新峰
作者单位:1 467000 平顶山,河南省平顶山市第二人民医院心内三科
急性心肌梗死(AMI)为导致心血管病患者死亡的重要原因,挽救濒死心肌的关键在于及时疏通梗死动脉、恢复心肌血液供应发现心肌缺血一定时间后恢复血流灌注会造成心肌损伤加重,易引起心肌顿抑、心功能不全、心律失常等,即为心肌缺血再灌注损伤(IRI)[1,2]。在及时恢复冠状动脉血流的同时如何避免IRI发生成为心脏缺血治疗的难点。microRNAs(miRNAs)是一类由21~23个碱基组成的内源性非编码小RNA,可通过促进mRNA降解或抑制mRNA翻译来调控靶基因表达[3]。研究证实[4,5],miRNAs在心血管系统中大量表达,已发现多个miRNAs在IRI中发挥重要作用,其中miR-34a具有调控心肌细胞纤维化、肥大、凋亡等作用,暗示miR-34a在IRI过程中发挥重要作用。松果菊苷(ECH)是从植物管花肉苁蓉中提取出的苯乙醇苷类化合物,研究发现其对神经细胞、内皮细胞的缺氧性损伤有显著保护作用[6]。本研究利用H9c2心肌细胞模拟IRI,探讨松果菊苷对心肌细胞IRI的保护作用及miR-34a表达的影响。
1 材料与方法
1.1 细胞株与主要试剂、仪器 鼠胚胎H9c2心肌细胞株购自美国ATCC细胞库。注射用盐酸地尔硫卓,规格:50 mg,批准文号:国药准字H20063738,购自浙江亚太药业股份有限公司。松果菊苷(ECH)购自上海源叶生物技术有限公司;DMEM高糖培养基和0.05% EDTA-胰蛋白酶液均购自美国Gibco公司;Annexin V-FITC Apoptosis Detection Kit购自美国BD公司;细胞乳酸脱氢酶(LDH)、肌酸激酶(CK)、超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒购自南京建成生物工程有限公司;MirVanaTM miRNA提取试剂盒购自美国Ambion公司;Taqman microRNA反转录试剂盒、Taqman Universal PCR Master Mix及miR-34a、U6引物购自美国Applied Biosystems公司。Bio-Rad 680酶标仪购自美国Bio-Rad公司;EPICSXL流式细胞仪购自美国Beckman Couhe公司;实时荧光定量PCR仪购自美国Beckman Couhe公司。
1.2 IRI模型建立 取出液氮冻存的心肌细胞后解冻复苏,接种于含10%血清的DMEM培养基中,置于条件为37℃、5% CO2的孵育箱中培养;待细胞融合度达80%~90%时,更换成不含10%血清的DMEM培养基,并置于条件为37℃、95% N2、5%CO2的孵育箱中培养10 h;接着再次更换成含10%血清的DMEM培养基,并置于条件为37℃、5%CO2的孵育箱中常规培养2 h。
1.3 含药血清制备 挑选本室SD雄性大鼠36只,体重250±50 g,随机分为对照组、模型组、阳性药物(盐酸地尔硫卓)组以及松果菊苷低、中、高剂量组,每组6只。松果菊苷低、中、高剂量组大鼠分别通过尾静脉注射2.5 mg/kg、5 mg/kg、10 mg/kg的ECH生理盐水溶液,阳性药物组大鼠通过尾静脉注射1 mg/kg的盐酸地尔硫卓溶液,对照组、模型组大鼠通过尾静脉注射等量生理盐水。各组大鼠给药后1~1.5 h,经股动脉抽取血液,室温静止、离心得到血清,血清过滤除菌,56℃水浴灭活补体30 min,备用。
1.4 药物处理 对照组心肌细胞用含10%对照血清DMEM培养基培养;模型组造模时用含10%对照血清DMEM培养基培养;阳性药物组造模时用含10%盐酸地尔硫卓血清DMEM培养基培养;ECH各处理组造模时用含10%对应浓度的ECH血清DMEM培养基培养。
1.5 MTT法检测细胞存活率 将心肌细胞按每孔1×104个接种至96孔板,每组设置5个复孔,根据前述方法建立IRI模型;每孔加入20 μl 5 g/l的MTT磷酸缓冲液,37℃继续培养4 h;小心弃去上清,向每孔加入150 μl DMSO,振荡20 min使结晶充分溶解;用酶标仪在450 nm波长处检测各孔的吸光度(OD)。细胞存活率(%)=OD值(处理组)/OD值(对照组)×100%。
1.6 流式细胞仪检测细胞凋亡率 心肌细胞按每孔1×104个接种至96孔板,每组设置5个复孔,根据前述方法建立IRI模型;收集各组H9c2细胞,用0.01 mol/l磷酸缓冲液漂洗;加入100 μl 1×Binding Buffer悬浮细胞;接着加入5 μl Annexin V-FITC染色液,混匀后加入5 μl PI染色液,混匀,室温避光放置15 min;加入400 μl 1×Binding Buffer,混匀后置于冰上;于1 h内用EPICSXL流式细胞仪采集并分析数据。
1.7 细胞培养上清液LDH、CK、SOD、MDA含量测定 收集各组培养心肌细胞的上清液,2000 rpm离心20 min后取上清液,接着分别按照试剂盒说明书测定上清液中LDH、CK、SOD、MDA含量。
1.8 qRT-PCR检测细胞miRNA-34a水平 收集各组心肌细胞,按照MirVanaTM miRNA提取试剂盒说明书提取细胞miRNA,用微量紫外分光光度计检测其纯度及浓度。取25 ng RNA,用Taqman microRNA反转录试剂盒合成cDNA。合成cDNA后,用Taqman Universal PCR Master Mix检测miR-34a表达,首先配制20 μl qRT-PCR体系:10 μl Taqman Master Mix、1 μl Taqman miRNA assay Mix、1.5 μl cDNA、7.5 μl ddH2O;混匀后在实时荧光定量PCR仪上扩增,反应条件:50℃2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min,进行40个循环。选取U6为内参照,采用2-ΔΔCTCTU6)±SD;ΔΔCT =(ΔCT目的miRNAΔCTU6)±SD。
1.9 统计学分析 本研究利用SPSS 20.0统计软件进行数据处理,计量资料采用均数±标准差(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 ECH对IRI心肌细胞存活率的影响 模型组、阳性药物组和ECH各剂量组心肌细胞IRI后细胞存活率较对照组显著降低,差异有统计学意义(P<0.05)。阳性药物组和ECH中、高剂量组心肌细胞存活率较模型组显著升高,差异有统计学意义(P<0.05);ECH低剂量组心肌细胞存活率较模型组亦升高,但差异无统计学意义(P>0.05)。ECH中、高剂量组心肌细胞存活率与阳性药物组间的差异无统计学意义(P>0.05)(表1)。
表1 ECH对IRI心肌细胞存活率的影响(n=5,±s)

表1 ECH对IRI心肌细胞存活率的影响(n=5,±s)
注:ECH:松果菊苷;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性药物组比较,cP<0.05
组别 剂量(mg/kg) 细胞存活率(%)对照组 - 98.75±2.36模型组 - 68.04±3.86a阳性药物组 1 82.35±5.17ab ECH低剂量组 2.5 73.16±4.30ac ECH中剂量组 5 78.32±4.78ab ECH高剂量组 10 82.13±5.05ab
2.2 ECH对IRI心肌细胞凋亡的影响 流式细胞仪结果显示,模型组、阳性药物组和ECH各剂量组心肌细胞IRI后细胞凋亡率较对照组显著升高,差异有统计学意义(P<0.05)。阳性药物组和ECH中、高剂量组心肌细胞凋亡率较模型组显著降低,差异有统计学意义(P<0.05);ECH低剂量组心肌细胞凋亡率较模型组亦降低,但差异无统计学意义(P>0.05)。ECH高剂量组心肌细胞凋亡率较阳性药物组间显著降低,差异有统计学意义(P<0.05)(图1、表2)。
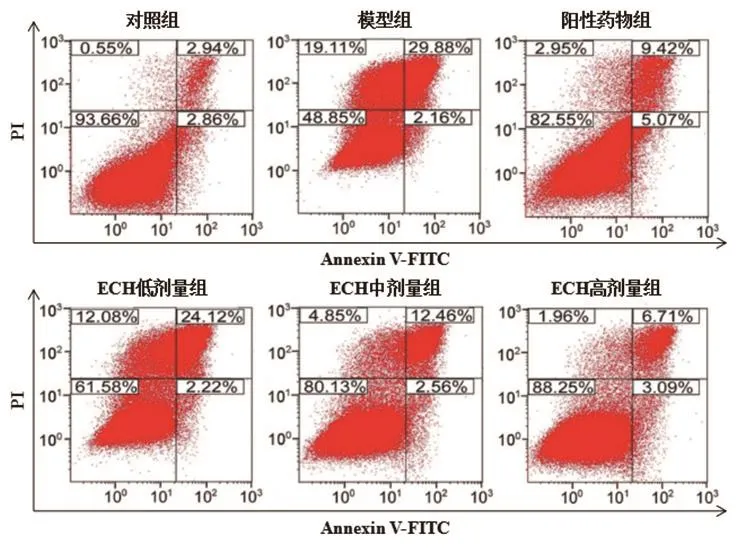
图1 ECH对IRI心肌细胞凋亡的影响
表2 ECH对IRI心肌细胞凋亡的影响(n=5,±s)

表2 ECH对IRI心肌细胞凋亡的影响(n=5,±s)
注:ECH:松果菊苷;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性药物组比较,cP<0.05
组别 剂量(mg/kg) 细胞凋亡率(%)对照组 — 4.24±0.82模型组 — 34.05±4.18a阳性药物组 1 17.88±3.13ab ECH低剂量组 2.5 27.91±5.16ac ECH中剂量组 5 18.04±4.95ab ECH高剂量组 10 12.06±3.02abc
2.3 ECH对IRI心肌细胞生成LDH、CK、SOD、MDA的影响 模型组、阳性药物组和ECH各剂量组心肌细胞IRI后生成LDH、CK、MDA量较对照组显著升高(P<0.05),SOD活力较对照组显著降低(P<0.05)。阳性药物组和ECH中、高剂量组心肌细胞生成LDH、CK、MDA量较模型组显著降低(P<0.05),SOD活力较对照组显著升高(P<0.05);ECH低剂量组心肌细胞生成LDH、CK、MDA量与模型组间的差异无统计学意义(P>0.05),SOD活力与模型组间的差异亦无统计学意义(P>0.05)。ECH高剂量组心肌细胞生成LDH、CK、SOD、MDA与阳性药物组间的差异均无统计学意义(P>0.05);ECH中剂量组心肌细胞生成LDH、CK、SOD与阳性药物组间的差异均无统计学意义(P>0.05)(表3)。
2.4 ECH对IRI心肌细胞miRNA-34a表达水平的影响 qRT-PCR结果显示,模型组、阳性药物组和ECH各剂量组心肌细胞IRI后细胞miRNA-34a表达水平较对照组显著升高(P<0.05)。阳性药物组和ECH各剂量组心肌细胞miRNA-34a表达水平较模型组显著升高(P<0.05)。ECH中、高剂量组心肌细胞miRNA-34a表达水平与阳性药物组间的差异无统计学意义(P>0.05)(表4)。
3 讨论
心肌IRI常发生在心脏缺血一段时间再次恢复血液供应时,临床症状为梗死面积扩大、收缩舒张功能降低等,其发病机制尚未研究清楚,主要表现在能量代谢异常、Ca2+超载、氧自由基损伤等[1,2,7]。目前其防治方法集中在减小梗死面积上,但许多药物与方法仅延迟了心肌损伤。ECH存在于大量抗衰老中药中,如管花肉苁蓉、马先蒿、地黄、列当、玄参等,尤其是管花肉苁蓉中,其含量可高达30%,为这些中药的重要抗衰老成份[6,8]。近期研究发现[9,10],ECH主要具有抗氧化、抗炎、抗癌、保护神经、保护肝脏、改善免疫力及学习记忆等方面的作用,暗示ECH可能对心肌IRI具有一定的保护作用。
表3 ECH对IRI心肌细胞生成LDH、CK、SOD、MDA的影响(n=5,±s)
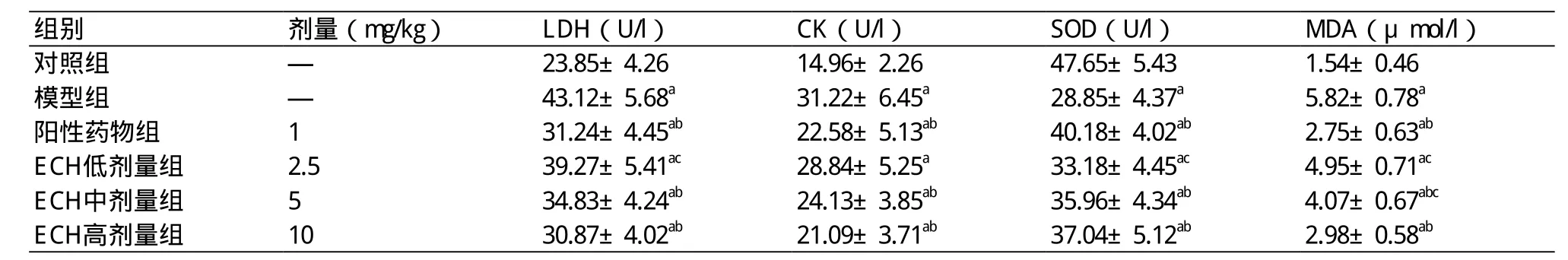
表3 ECH对IRI心肌细胞生成LDH、CK、SOD、MDA的影响(n=5,±s)
注:ECH:松果菊苷;LDH:乳酸脱氢酶;CK:肌酸激酶;SOD:超氧化物歧化酶;MDA:丙二醛;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性药物组比较,cP<0.05
组别 剂量(mg/kg) LDH(U/l) CK(U/l) SOD(U/l) MDA(μmol/l)对照组 — 23.85±4.26 14.96±2.26 47.65±5.43 1.54±0.46模型组 — 43.12±5.68a 31.22±6.45a 28.85±4.37a 5.82±0.78a阳性药物组 1 31.24±4.45ab 22.58±5.13ab 40.18±4.02ab 2.75±0.63ab ECH低剂量组 2.5 39.27±5.41ac 28.84±5.25a 33.18±4.45ac 4.95±0.71ac ECH中剂量组 5 34.83±4.24ab 24.13±3.85ab 35.96±4.34ab 4.07±0.67abc ECH高剂量组 10 30.87±4.02ab 21.09±3.71ab 37.04±5.12ab 2.98±0.58ab
表4 各组心肌细胞miRNA-34a的相对表达水平(n=5,±s)

表4 各组心肌细胞miRNA-34a的相对表达水平(n=5,±s)
注:ECH:松果菊苷;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与阳性药物组比较,cP<0.05
组别 剂量(mg/kg) miRNA-34a对照组 — 1.77±0.26模型组 — 3.24±0.32a阳性药物组 1 5.15±0.38ab ECH低剂量组 2.5 4.06±0.44abc ECH中剂量组 5 4.83±0.32ab ECH高剂量组 10 5.08±0.45ab
本研究发现ECH预处理的心肌细胞经过IRI后,较模型组表现出更多的细胞存活、更少的细胞凋亡,且中剂量ECH的作用效果与阳性药物盐酸地尔硫卓相当,说明ECH对心肌细胞IRI后具有良好的保护能力。心肌梗死发生时,缺氧可造成ATP产生减少、自由基生成却过多,进而引起细胞膜脂质过氧化、膜蛋白变性以及DNA损伤[11,12]。细胞内清除自由基的主要酶为SOD,其在心肌IRI时受到明显抑制,造成自由基大量积累,同时造成心肌细胞膜脂质的过氧化产物MDA生成过多,从而引发细胞损伤,细胞膜被破坏后,LDH、CK从细胞中释放,因此细胞培养液中的LDH、CK含量可体现出心肌细胞的损伤程度[13,14]。本研究发现模型组心肌细胞LDH、CK释放量加大,而ECH和盐酸地尔硫卓可促进SOD表达,促进氧自由基的清除,抑制了MDA的大量产生,从而减轻胞膜损伤、减少LDH和CK的外流,进一步证实ECH可保护心肌细胞IRI时的损伤程度。
miRNA在动植物界广泛存在,为细胞病生理活动必不可少的调节器,可经过识别靶mRNA 3’UTR结构域与靶mRNA互补结合,抑制靶mRNA翻译并促进其降解,调节靶基因的表达。miRNA在病理生理方面的作用决定了其可能为调控心肌细胞凋亡的重要分子[3,4,15]。研究发现[5,16,17],miRNA与心室重塑、心力衰竭过程有关,如miR-34a、miR-21、miR-133等。miR-34a属于miR-34家族(包括miR-34a、miR-34b、miR-34c),位于lp36上,是被p53直接调控的miRNA分子,Bcl-2是其直接靶基因。研究发现[18-20],miR-34a既能促进癌细胞凋亡起到抗癌作用,又能在心肌IRI过程中减少心肌细胞凋亡而减轻心肌损伤。miR-34a可通过作用于p53、Notch、Wnt等信号通路调控细胞的增殖、分化,有研究发现过表达miR-34a可促进心肌细胞肥大、纤维化、凋亡,抑制miR-34a可减少心肌细胞肥大、纤维化、凋亡,有助于改善心室重塑,这一步体现了miR-34a功能的双重性。本研究发现,心肌细胞IRI后生成LDH、CK、MDA量较对照组显著升高,SOD活力较对照组显著降低,说明心肌细胞IRI后出现明显损伤。阳性药物组和ECH中、高剂量组心肌细胞生成LDH、CK、MDA量较模型组显著降低,SOD活力较对照组显著升高,说明ECH可减轻心肌细胞IRI后的损伤程度。心肌细胞IRI后细胞miRNA-34a表达水平较对照组显著升高,而ECH或盐酸地尔硫卓预处理过的心肌细胞miRNA-34a表达水平较模型组显著更高,这表明ECH对心肌细胞IRI的保护机制可能与miR-34a表达上调有关。
综上所述,本研究发现ECH可显著提高IRI后心肌细胞的存活率、降低其凋亡率,上调miR-34a表达,说明ECH对心肌细胞IRI后具有显著保护作用,其机制可能与miR-34a表达上调有关。然而心肌IRI的发生发展机制复杂,ECH的具体作用机理还需进一步探究。
