MEF 2A基因沉默对小鼠主动脉内皮细胞ICAM-1、VCAM-1表达的影响
2018-07-28李松森牛晓华张守彦王学慧
李松森,牛晓华,张守彦,王学慧
作者单位:1 471000 洛阳,洛阳市中心医院心血管内科;2 453100新乡,新乡医学院第一附属医院心血管内科
冠状动脉粥样硬化性心脏病(冠心病,CHD)是指冠状动脉粥样硬化引起的血管阻塞,或者冠状动脉(冠脉)发生功能性改变导致心肌缺血性坏死而引发的心脏疾病,是全球范围内致死和致残率最高的疾病之一,尤其在发展中国家,CHD大大增加了社会的医疗负担[1]。动脉管壁发生慢性炎症反应以及动脉粥样硬化斑块的破裂是CHD发生的主要病理基础[2]。随着对动脉粥样硬化(AS)研究的深入,基因突变和基因多态性研究与AS的发病关系成为心血管疾病领域的研究热点之一[3]。我们认为,从血管炎性反应和内皮细胞完整性相关基因入手,更有利于对AS发生、发展的机制以及防治策略的探讨。肌细胞增强因子2A(MEF 2A)是本世纪初最新发现的且受到普遍关注的AS相关基因[4]。有研究证实,MEF 2A在血管内皮细胞上呈高表达,与维持血管内皮功能和血管重塑密切相关,但是具体的作用机制,尤其是MEF 2A对于信号通路及细胞因子的调控作用中一直存有较大争议[5]。本项研究通过特异性沉默小鼠MACE主动脉内皮细胞MEF 2A基因的表达,观察MACE细胞生物学行为的变化以及对多种细胞因子的影响,同时与ApoE-/-小鼠主动脉内皮细胞细胞因子变化进行对比,为MEF 2A作为AS的潜在治疗靶点提供新的思路。现报告如下:
1 材料与方法
1.1 实验动物、细胞及分组 ApoE-/-小鼠,8只,SPF级,雄性,20~22 g,购自维通利华实验动物有限责任公司,动物许可证号:SCXK(京)2006-0009。饲养在本实验室SPF动物房内,自由饮水进食。MACE小鼠主动脉内皮细胞,购自深圳华拓生物。将细胞株接种至含有10%FBS胎牛血清的DMEM培养基中,置于37℃,5%CO2细胞培养箱中进行培养。实验分组:①MACE细胞空白对照组;②MACE细胞慢病毒阴性对照组(MACE-NC组);③MEF 2A RNAi A、B、C、D组,选择沉默率最高的靶点;④ApoE-/-小鼠主动脉内皮细胞组。
1.2 实验方法
1.2.1 内皮细胞的分离和培养 ①将小鼠颈椎脱臼处死,置于75%乙醇溶液中浸泡2 min;②将小鼠置于超净工作台中,采用手术刀逐层剖开小鼠胸部和腹部正中皮肤和肌肉组织,确定主动脉;③分离主动脉弓,并于主动脉壁作一切口,分离动脉被膜,完整取出胸腹腔主动脉段,立即放入含有DMEM培养液的培养皿中,冲洗4~5次;④采用无菌眼科剪将主动脉尽量剪碎,将血管内皮朝下,放入细胞培养皿中,置于37℃,5% CO2细胞培养箱中进行培养;⑤48 h后观察细胞生长形态,更换细胞液,继续培养。
1.2.2 细胞复苏 将冻存在液氮或者-80℃超低温冰箱中的细胞冻存管取出,置于37℃恒温水浴中1 min,离心,弃上清,加入PBS冲洗后,再次离心,弃上清;加入DMEM培养基,将细胞重悬,用吸管将细胞置入培养瓶中,加入5~7 ml新鲜培养液,置于37℃,5%CO2细胞培养箱中培养。
1.2.3 细胞传代 24~48 h更换细胞培养液,48 h传代一次。用吸管弃去培养液,加入1 ml 0.25%胰蛋白酶,在显微镜下观察细胞解离程度,弃去胰蛋白酶,加入新鲜DMEM培养基,用吸管反复吹散贴壁细胞,将细胞吹打均匀后,分装至2~4瓶培养瓶中,加入适量培养基,继续置于培养箱中培养,待用。
1.2.4 MEF 2A RNA干扰慢病毒载体的建立(1)从NCBI数据库中查找MEF 2A的碱基序列,选择MEF 2A基因A、B、C、D4个不同位点按照发夹结构模式进行RNAi,序列如下:①靶点A:5'-GCAAGCTGGAATTCTCCTTTG-3';②靶点B:5'-GGGTCTTAGTATATTTCTTGG-3';③靶点C:5'-GGCTCTCAGTGCGATTCTTGA-3';④靶点D:5'-GCAACACTCTCCAGGATCACA-3';⑤阴性对照:5'-TTCTCCGAACGTGTCACGT-3'。(2)RNAi构建:①Oligo DNA退火;②酶切载体 LV3 pGLV/H1/GFP+Puro;③连接 LV3 pGLV/H1/GFP与DNA oligo片段;④转染stb13细菌并检测病毒滴度和DNA序列。
1.2.5 慢病毒转染 将MACE细胞接种至6孔板中,待细胞汇合率为50%~60%时加入采用无血清的DMEM培养液稀释的慢病毒液(MOI=10~30)。8 h后,更换细胞培养液,加入含有10%FBS的DMEM培养液。
1.2.6 提取总RNA ①将低温保存的组织标本取出,置于研钵中,加入液氮,迅速研磨至细粉状;②加入1 ml预冷的Trizol,将组织标本充分溶解后,用吸管置于预冷的EP管中,充分混合均匀,静置5~10 min;③加200 ul氯仿,震荡30 s,静置5~10 min;④12 000 rpm离心,取上清;⑤加入500 μl异丙醇,震荡30 s,静置5~10 min;⑥12 000 rpm离心,弃上清;⑦加入1 ml 75%乙醇,震荡30 s,12 000 rpm离心,弃上清;⑧将EP管倒置于滤纸上,将RNA充分干燥;⑨加入20 μl DEPC水溶解沉淀,分装,置于-80℃保存备用。采用凝胶电泳检测RNA分子量;采用分光光度计检测RNA浓度。
1.2.7 RNA反转录 根据试剂盒说明书操作进行。将cDNA保存至-20℃保存备用。
1.2.8 实时反转录酶-聚合酶链式反应(RTPCR) 将20 μl反应体系置于37℃恒温水浴60 min,85℃ 5 s,加入去离子水至100 μl,各反应孔取2 μl进行PCR。冰浴中配制20 μl PCR反应体系,95℃ 20 s预变性,95℃ 5 s,60℃ 30 s,循环45次。
1.2.9 蛋白免疫印迹 ①提取蛋白样品;②蛋白样品凝胶电泳;③转膜;④封闭;⑤加入一抗孵育;⑥加入二抗孵育;⑦显影;⑧采用化学发光法检测膜上的蛋白表达条带,采用FluorChem FC3凝胶成像数码分析系统进行定量分析,以积分光密度(IOD)表示灰度值。
1.3 主要试剂及仪器 (1)主要试剂:DMEM高糖细胞培养基和胰蛋白酶-EDTA细胞消化液(0.25%),美国GIBCO;FBS胎牛血清和链霉素-青霉素双抗,美国ThermoFisher;Trizol试剂,美国Invitrogen;焦炭酸二乙酯(DEPC),美国Fluka;MEF 2A、细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)及纤溶酶原激活物抑制剂-1(PAI-1)PCR引物由上海生工生物工程有限公司合成并提供;DAB试剂盒,BCA蛋白浓度测定试剂盒,北京中杉金桥生物技术有限公司;cDNA反转录试剂盒、蛋白提取试剂盒,RNA酶抑制剂,美国Takara;ICAM-1、VCAM-1及PAI-1 ELISA试剂盒,武汉艾美捷科技有限公司;ICAM-1、VCAM-1及PAI-1抗体,美国Abcam。(2)主要仪器:HERcell1501型CO2细胞培养箱,美国Thermo Forma;Eppendorf 5427 R台式高速冷冻离心机,德国 Eppndorf;DI-CJ-2ND超净工作台,北京东联哈尔仪器制造有限公司;实时定量PCR仪,美国Bio-Rad;iMake多功能酶标仪,日本Bio-Rad公司;CX41倒置光学显微镜和OLS4100激光共聚焦显微镜,日本OLYMPUS;电子分析天平,上海玉研科学仪器有限公司;Amersham电泳仪,瑞典Bioscience;恒温水浴摇床和YCZ-40D型转移电泳槽,北京六一仪器厂;FluorChem FC3凝胶成像数码分析系统,美国ProteinSimple。
1.4 统计学处理 采用SPSS 19.0统计学软件进行处理;计量资料以平均数±标准差(±s)表示;对各组间变量行t检验或方差分析;计数资料以百分比表示,采用χ2检验,多组均数比较采用方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 MACE细胞和ApoE-/-小鼠主动脉内皮细胞MEF 2A基因的表达 经RT-PCR方法检测,ApoE-/-小鼠主动脉内皮细胞MEF 2A基因的表达水平明显低于未经任何处理的MACE细胞,P<0.05(表1,图1)。
2.2 MEF 2A 基因沉默率检测 MACE细胞转染4 d后,通过RT-PCR检测结果显示,A、B、C、D4个靶点进行RNA干扰,能明显抑制MEF 2A基因的表达,与MACE细胞空白对照组和RNAi阴性对照组表达结果比较,有统计学差异,P<0.05。其中B位点基因沉默率最高(表2,图2)。
2.3 各组细胞ICAM-l、VCAM-1和PAI-1的表达情况 经ELISA检测,MEF 2A B位点基因沉默组MACE细胞和ApoE-/-小鼠主动脉内皮细胞培养上清中,ICAM-1、VCAM-1、PAI-1的表达水平明显升高,与空白对照组和阴性对照组比较,有统计学差异,P<0.05(表3)。另外,经RT-PCR方法和western blot方法检测,MEF 2A RNAi组MACE细胞和ApoE-/-小鼠主动脉内皮细胞中ICAM-1、VCAM-1、PAI-1 mRNA和蛋白表达水平明显上调,与空白对照组和阴性对照组比较,有统计学差异,P<0.05(表4~5)(图3~4)。
2.4 MEF 2A mRNA与ICAM-1、VACM-1、PAI-1 mRNA表达的相关性 经Pearson相关性分析结果显示,MEF 2A表达量与ICAM-l、VCAM-1和PAI-1的表达量呈现负相关性(r=-0.985,-0.805,-0.959,P均<0.05)。即MEF 2A表达量越低,ICAM-l、VCAM-1和PAI-1的表达量越高(表6)。
3 讨论
表1 RT-PCR检测各组细胞MEF 2A mRNA表达情况(±s)
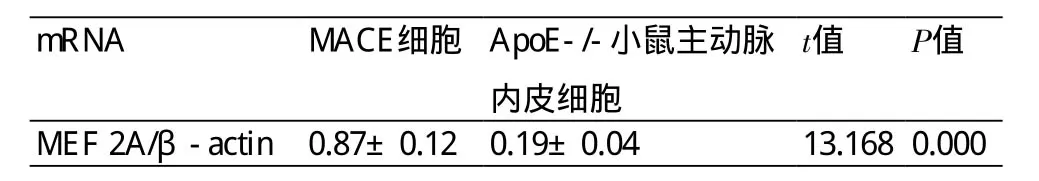
表1 RT-PCR检测各组细胞MEF 2A mRNA表达情况(±s)
注:MEF 2A:肌细胞增强因子2A;β-actin:β-肌动蛋白
mRNA MACE细胞 ApoE-/-小鼠主动脉内皮细胞t值 P值MEF 2A/β-actin0.87±0.120.19±0.04 13.1680.000
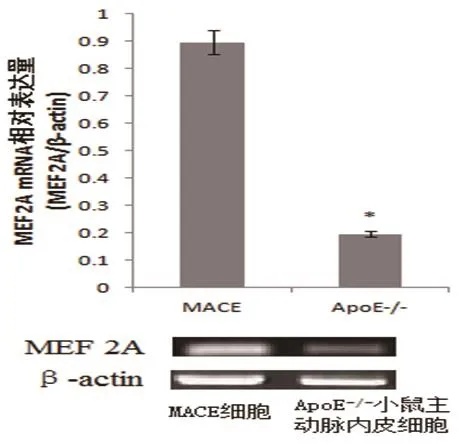
图1 RT-PCR检测两组细胞MEF 2A基因表达情况(*与MACE细胞比较,P<0.05)
表2 RT-PCR检测各组MACE细胞MEF 2A mRNA表达情况(±s)
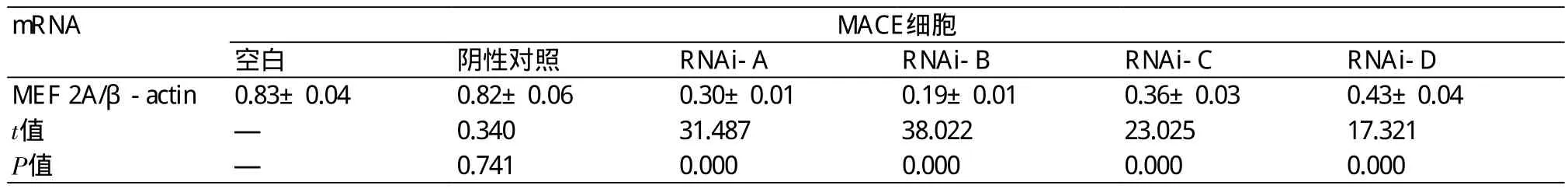
表2 RT-PCR检测各组MACE细胞MEF 2A mRNA表达情况(±s)
注:MEF 2A:肌细胞增强因子 2A;β-actin:β-肌动蛋白;RNAi-A,B,C,D是基因沉默的四个靶点
mRNA MACE细胞空白 阴性对照 RNAi-A RNAi-B RNAi-C RNAi-D MEF 2A/β-actin0.83±0.04 0.82±0.06 0.30±0.01 0.19±0.01 0.36±0.03 0.43±0.04 t值 — 0.340 31.487 38.022 23.025 17.321 P值 — 0.741 0.000 0.000 0.000 0.000
动脉粥样硬化斑块形成和破裂造成动脉阻塞或者管径狭窄是引起一系列心血管疾病的病理基础[6]。在正常生理情况下,内皮细胞空间结构完整连续,可维持血管正常的收缩、舒张平衡状态,调节血管平滑肌细胞的增殖、迁移、分化等,保证血管正常的通透性,为黏附因子抑制因子提供作用空间,形成完整的血液-动脉屏障,避免血液中有害物质损伤血管平滑肌细胞[7,8]。当血管内皮受到多种炎性因子刺激时,结构和功能受损,导致脂质大量集聚,血管通透性改变;促使血管平滑肌大量增殖,形成血栓和血小板黏附,导致动脉粥样硬化斑块的形成[9]。
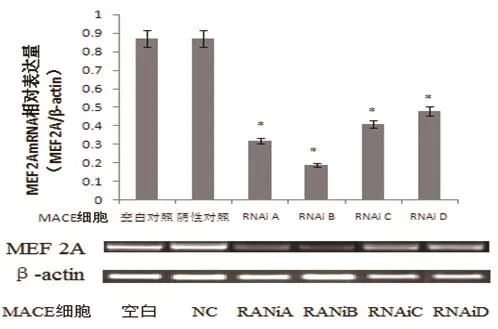
图2 RT-PCR检测各位点MEF 2A基因沉默率(*与MACE细胞空白对照组比较,P<0.05)
尽管对于AS的临床研究日益深入,但核因子-κB(NF-κB)仍是目前靶向治疗研究中最成熟的靶点蛋白[10],它可以调节多种参与炎症反应的细胞因子的表达过程,包括ICAM-1、VCAM-1等细胞黏附因子以及趋化因子等[11]。ICAM-1和VCAM-1都属于免疫球蛋白超家族成员之一,是内皮细胞、血管平滑肌细胞表面主要的表达受体之一,当内皮细胞功能受损,ICAM-1表达上调,导致表面黏附性发生改变,促使单核细胞进入内皮细胞下层形成巨噬细胞,巨噬细胞大量吞噬脂质分泌细胞外基质,形成泡沫细胞,当泡沫细胞破裂时,易导致血栓生成[12]。VCAM-1是促进白细胞和血管内皮细胞黏附的重要分子,AS发生早期,白细胞黏附于动脉硬化部位内膜表面,通过胞间连接进入内膜[13],因此,ICAM-1和VCAM-1高表达是AS发病早期的病变机制。
除此以外,PAI-1与AS的形成也密切相关。PAI-1是血管内皮细胞表面表达的serpins超家族成员之一,属于纤溶酶原激活物主要的抑制分子,可抑制纤维蛋白降解,发挥抗纤溶作用[14]。研究显示,PAI-1不仅可促使动脉粥样硬化斑块的形成,还与血管平滑肌细胞增殖及微血管形成有关。探讨影响ICAM-1、VCMA-1和PAI-1表达的相关基因,对于研究AS的发病机制十分重要。
表3 ELISA检测各组细胞培养上清中ICAM-l、VCAM-1和PAI-1的表达情况(±s)
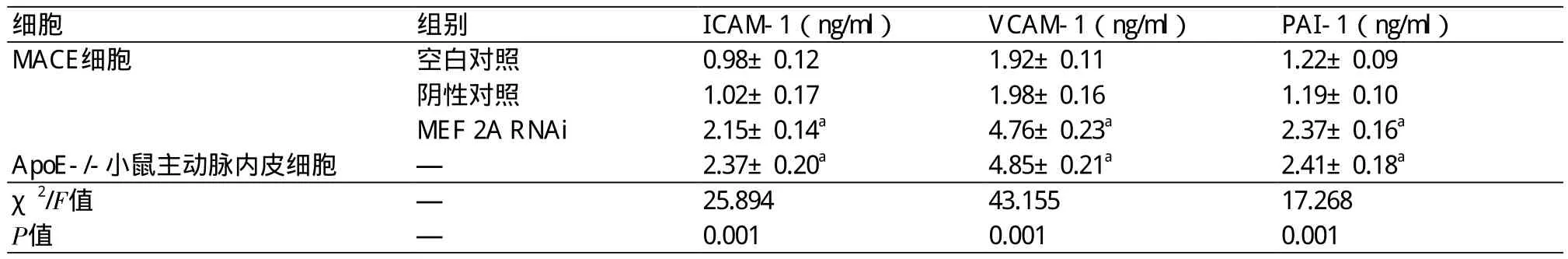
表3 ELISA检测各组细胞培养上清中ICAM-l、VCAM-1和PAI-1的表达情况(±s)
注:ICAM-1:细胞间黏附分子-1;VCAM-1:血管细胞黏附分子-1;PAI-1:纤溶酶原激活物抑制剂-1;与空白对照组比较,aP<0.05
细胞 组别 ICAM-1(ng/ml) VCAM-1(ng/ml) PAI-1(ng/ml)MACE细胞 空白对照 0.98±0.12 1.92±0.11 1.22±0.09阴性对照 1.02±0.17 1.98±0.16 1.19±0.10 MEF 2A RNAi 2.15±0.14a 4.76±0.23a 2.37±0.16a ApoE-/-小鼠主动脉内皮细胞 — 2.37±0.20a 4.85±0.21a 2.41±0.18a χ2/F值 — 25.894 43.155 17.268 P值 — 0.001 0.001 0.001
表4 RT-PCR检测各组细胞ICAM-l、VCAM-1和PAI-1 mRNA的表达情况(±s)
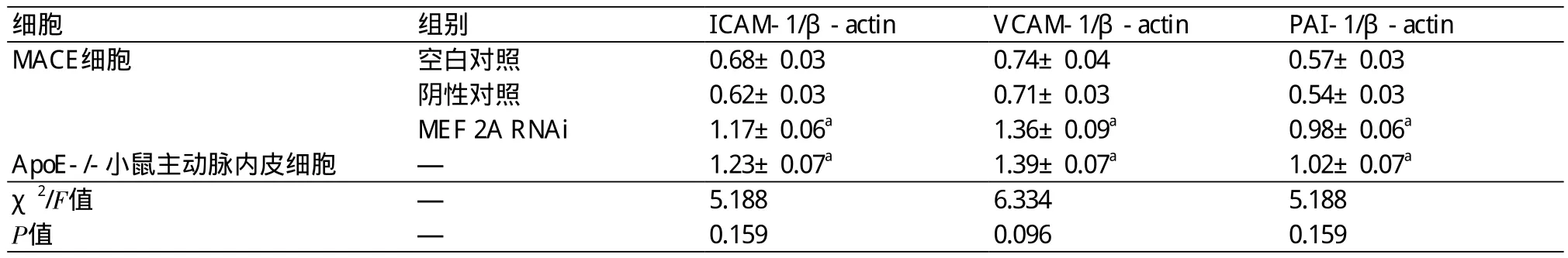
表4 RT-PCR检测各组细胞ICAM-l、VCAM-1和PAI-1 mRNA的表达情况(±s)
注:ICAM-1:细胞间黏附分子-1;VCAM-1:血管细胞黏附分子-1;PAI-1:纤溶酶原激活物抑制剂-1;MEF 2A:肌细胞增强因子2A;β-actin:β-肌动蛋白;RNAi:RNA干扰;与空白对照组比较,aP<0.05
细胞 组别 ICAM-1/β-actin VCAM-1/β-actin PAI-1/β-actin MACE细胞 空白对照 0.68±0.03 0.74±0.04 0.57±0.03阴性对照 0.62±0.03 0.71±0.03 0.54±0.03 MEF 2A RNAi 1.17±0.06a 1.36±0.09a 0.98±0.06a ApoE-/-小鼠主动脉内皮细胞 — 1.23±0.07a 1.39±0.07a 1.02±0.07a χ2/F值 — 5.188 6.334 5.188 P值 — 0.159 0.096 0.159
表5 Western Blot检测各组细胞ICAM-l、VCAM-1和PAI-1 蛋白的表达情况(±s)
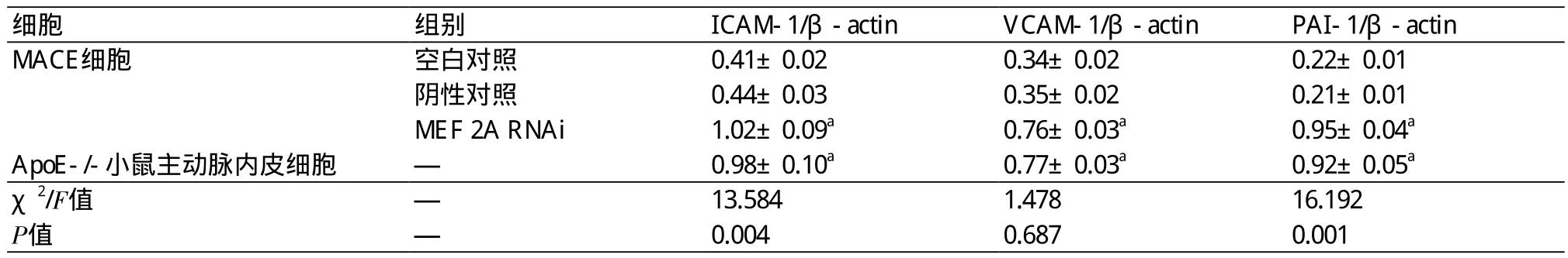
表5 Western Blot检测各组细胞ICAM-l、VCAM-1和PAI-1 蛋白的表达情况(±s)
注:ICAM-1:细胞间黏附分子-1;VCAM-1:血管细胞黏附分子-1;PAI-1:纤溶酶原激活物抑制剂-1;MEF 2A:肌细胞增强因子2A;β-actin:β-肌动蛋白;RNAi:RNA干扰;与空白对照组比较,aP<0.05
细胞 组别 ICAM-1/β-actin VCAM-1/β-actin PAI-1/β-actin MACE细胞 空白对照 0.41±0.02 0.34±0.02 0.22±0.01阴性对照 0.44±0.03 0.35±0.02 0.21±0.01 MEF 2A RNAi 1.02±0.09a 0.76±0.03a 0.95±0.04a ApoE-/-小鼠主动脉内皮细胞 — 0.98±0.10a 0.77±0.03a 0.92±0.05a χ2/F值 — 13.584 1.478 16.192 P值 — 0.004 0.687 0.001
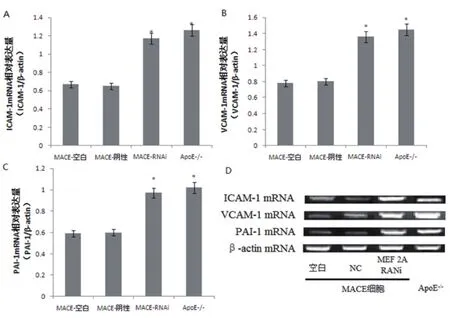
图3 RT-PCR检测各组细胞ICAM-l、VCAM-1和PAI-1 mRNA的表达情况(*与MACE细胞空白对照组比较,P<0.05)
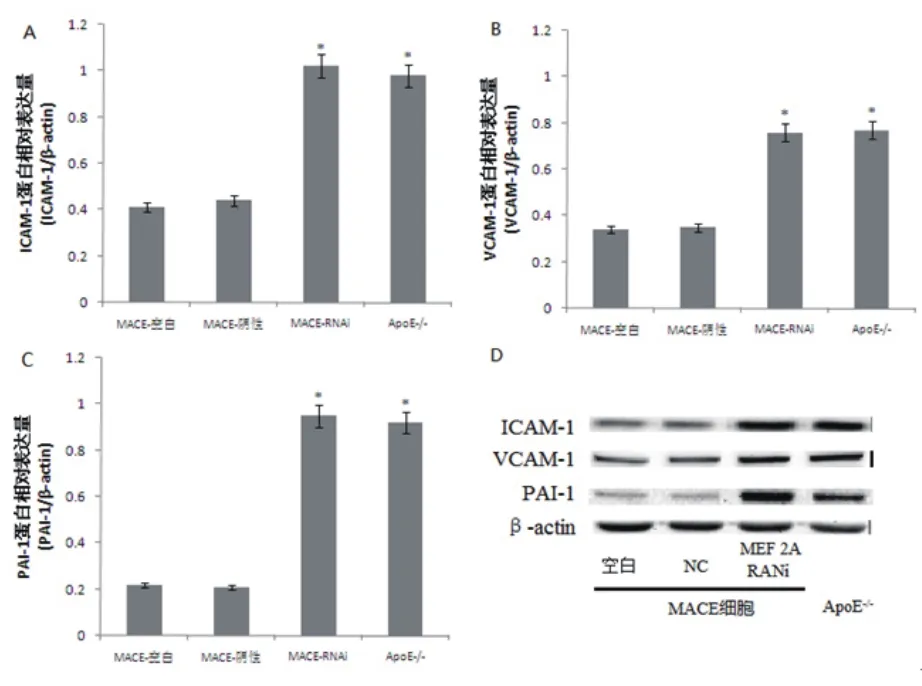
图4 RT-PCR检测各组细胞ICAM-l、VCAM-1和PAI-1蛋白的表达情况(*与MACE细胞空白对照组比较,P<0.05)
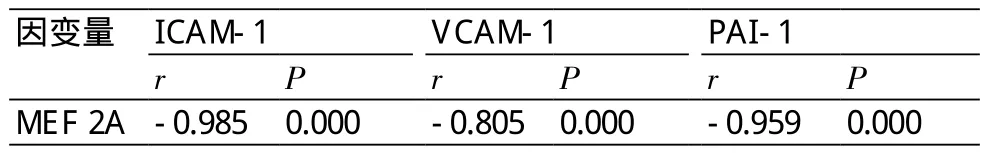
表6 ICAM-l、VCAM-1和PAI-1 mRNA与MEF 2A mRNA相关性分析
MEF 2A是作用于钙离子信号通路的重要转录因子,通过激活内皮细胞活性维持血管内皮的完整性和通透性[15]。既往研究证实,MEF 2A 蛋白的表达可减少细胞的增殖和毛细血管的形成,并且通过激活下游转录因子调控血流介导的内皮完整性。本项研究通过采用RNA干扰技术沉默MACE细胞MEF 2A基因的表达,且与ApoE-/-小鼠主动脉内皮细胞进行对比,探讨其作用于AS可能的机制。ApoE-/-小鼠在喂养普通饲料时即可自发形成动脉粥样硬化,是实验室研究AS发病机制最典型的动物模型。结果显示,MEF 2A基因沉默可明显上调ICAM-1、VCMA-1和PAI-1的表达,与ApoE-/-小鼠主动脉内皮细胞ICAM-1、VCMA-1和PAI-1的表达水平基本一致,高于MACE细胞对照组的表达,P<0.05。提示MEF 2A在AS中低表达属于疾病发生的早期事件,在AS发生过程中发挥着重要作用。与国外研究结果一致。综上所述,MEF 2A作为一类新发现的维护血管内皮稳定性的重要生物活性物质,与AS的形成密切相关,其可能通过负性调控血管内皮细胞ICAM-1、VCMA-1和PAI-1等黏附因子的表达,参与动脉粥样硬化的发生和发展过程,其具体机制需进一步研究。
