香椿种子无菌苗再生体系的建立
2018-07-27杨超臣朱天然曹丽仙李建安
杨超臣,张 婷,朱天然,曹丽仙,李建安
(中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
香椿Toona sinensis楝科Meliaceae香椿属Toona(Endl.)Roem,是我国珍贵的速生用材树种,素有“中国桃花心木”之美誉,也是园林绿化的优良树种,同时也是兼具营养价值、食用价值、药用价值的木本蔬菜,主要采食其嫩叶和芽[1]。香椿作为木本蔬菜的栽培方式主要是设施栽培和矮化密植栽培[2],其常规育种方法是根蘖繁殖和种子繁殖。由于香椿根系深,根量少,根蘖繁殖率低,且香椿种子自然条件下萌发率低。组织培养作为一种高效的无性繁殖技术,可以实现种质资源创新和良种工厂化培育,现常与其他育种技术相结合,如:基因工程、原生质融合和花药培养等,是品种选育和种质资源创新的重要技术手段[3]。近年来,较多学者对香椿组培进行大量研究,但主要以带芽茎段[4]、叶片[5]作为初代培养材料,以香椿种子为初始培养材料的研究报道较少。本研究以成熟香椿种子在无菌条件下萌发的幼苗为外植体,研究不同基本培养基和不同植物生长调节剂对丛芽诱导、增殖、壮苗及生根的影响,建立了完整的组培快繁体系,为香椿的工厂化育苗提供理论基础,以期为遗传转化提供可能。
1 材料与方法
1.1 试验材料
香椿Toona sinensis成熟种子来自河南农业科学院,常温避光下保存,试验在中南林业科技大学经济林培育与保护教育部重点实验室进行。
1.2 试验方法
1.2.1 无菌苗的获得
试验材料预处理:挑选大小均匀一致、籽粒饱满的成熟香椿种子,然后用洗衣粉浸泡10 min,在流水下冲洗2 h,再用40 ℃温水浸泡催芽,浸种12 h后暗培养24 h。然后经75%无水乙醇表面灭菌1 min后用无菌水冲洗4~5次。用以下3种材料灭菌处理:1%NaClO(有效成分)、0.1%HgCl2、10%H2O2,无菌水冲洗4~5次,充分去掉残余的消毒液,然后将灭菌好的种子放在无菌滤纸上吸干水分,转接至WPM培养基上。每个处理接种20瓶,每瓶1粒种子,重复3次,培养15 d后统计污染率、萌发率。
1.2.2 培养基的筛选
把预处理的种子用1% NaClO灭菌处理20 min。分别接种在WPM、MS、1/2MS培养基上,并添加不同浓度GA3(0、3、5 mg·L-1)。每个处理接种15瓶,每瓶2粒种子,重复3次。统计萌发所用时间、成苗率,以胚根露出超过种子长度为萌发标准,观察培养40 d后的幼苗生长情况。
1.2.3 丛生芽的诱导
选取培养45 d后长势一致的香椿无菌苗为材料,切成长度为2.0 cm带芽茎段,接入含有6-BA(0.5、1.0、2.0 mg·L-1)、NAA(0.05、0.1、0.5 mg·L-1)、GA3(1.0 mg·L-1)的培养基中进行丛芽诱导培养,45 d后统计丛芽诱导率、增殖倍数。每处理接种20个带芽茎段,重复3次。
1.2.4 无菌苗壮苗培养
以培养45 d的香椿丛芽为材料,培养基中添加6-BA(0.5、1.0 mg·L-1)、IAA(0.05、0.1、0.5 mg·L-1)、GA3(2.0 mg·L-1),优化出壮苗培养基,45 d后统计苗高及生长情况。每处理接种20瓶,每瓶1~2个单芽,重复3次。
1.2.5 生根培养
以壮苗后的单个芽苗为材料,切取生长健壮(高度4 cm左右)的单个芽苗接种在含有IBA(0.1、0.5、1.0、2.0 mg·L-1)、NAA(0、0.1、0.5 mg·L-1)的生根培养基上,45 d后统计生根率、生根条数及根系生长情况。每处理15瓶,每瓶1~2个芽苗,重复3次。
1.2.6 炼苗移栽
将生根45 d的试管苗打开瓶盖在人工气候室中炼苗2 d,保持其湿度为65%左右。去掉根部的培养基,然后移栽到园土∶草炭土∶珍珠岩体积比为2∶2∶1的混合基质中,移栽初期保持盆内微环境相对湿度为75%~85%。30 d后统计移栽成活率[6]。
1.2.7 培养条件
培养基中均添加30 g·L-1蔗糖和7 g·L-1琼脂,添加植物生长调节剂后调pH值为5.8。121 ℃高温灭菌20 min。培养条件为:温度25±2 ℃、光照周期12 h/d、光照强度为30 μmol·m-2s-1、相对湿度为60% ~70%。
1.3 数据处理与统计分析
利用Excel 2016、SPSS 22.0 软件进行数据处理、统计分析,数据均为“平均数±标准偏差”格式,采用Duncan’s新复极差测验法(P<0.05)进行显著性分析。在结果统计中所涉及的测定项目计算公式如下:萌发率(%)=萌发的种子数/(接种的种子数-污染的种子数) ×100%;污染率(%)=污染种子数/种子总数×100%;成苗率(%)=成苗数/(接种的种子数-污染的种子数)×100%;增殖倍数=增殖后获得的单芽个数/接种的外植体数;生根率(%)=生根的苗数/接种的芽苗数×100%;平均生根条数=每处理生根的总根数/生根的总苗数。
2 结果与分析
2.1 不同灭菌处理对香椿种子萌发和污染情况的影响
由表1可知,A1~A13处理污染率明显低于A14处理,说明各灭菌材料的不同处理时间都有灭菌作用,并且各处理的灭菌效果有差异,1%NaClO和0.1%HgCl2处理时随着处理时间的延长,污染率降低,而10%H2O2处理时并没有这种趋势,其中处理A9的污染率最低,为3.33%。A1~A13处理萌发率明显低于A14处理,说明灭菌处理对种子萌发有一定的伤害作用,其中除对照外,处理A12的萌发率最高,为87.37%。由表1知,相同灭菌时间下,0.1%HgCl2的灭菌作用要明显好于1%NaClO和10%H2O2,但0.1%HgCl2处理的种子萌发率远远低于1%NaClO和10%H2O2,并达到显著水平(P<0.05)。因此,处理A4的灭菌效果最好,即用1%NaClO处理20 min,香椿种子污染率为25.00%,萌发率为82.32%。
2.2 不同培养基及添加不同GA3浓度对种子萌发的影响
不同培养基、不同GA3浓度的添加影响种子的初始萌发时间、成苗率和幼苗生长状况,见表2。由表2可知,在同等激素水平下,以WPM和1/2MS作为基本培养基,成苗率差异不显著(P>0.05),但都显著高于MS培养基(P<0.05)。同一种培养基时,随着添加GA3浓度的增加,初始萌发时间缩短,但浓度过高会使根系浮在培养基表面,不利于幼苗生长。因此,在WPM或1/2MS培养基上添加3.0 mg·L-1GA3,可以缩短香椿种子萌发时间,有利于幼苗生长(B4或B5组)。

表1 不同消毒剂和消毒时间对香椿种子消毒效果的影响†Table 1 Effect of different disinfection and sterilizing time on seeds of Toona sinensis

表2 不同培养基及添加不同GA3浓度对种子萌发的影响Table 2 Effects of different medium and GA3 concentration on seed germination
2.3 不同植物生长调节剂对丛生芽诱导的影响
由表3可知,在只添加GA3的C1组中,不能诱导出香椿丛芽,当6-BA浓度为0.5 mg·L-1时,诱导出的香椿丛芽数量多而小,生长缓慢。当培养基中添加1.0 mg·L-16-BA+0.1 mg·L-1NAA,并附加1.0 mg·L-1的GA3时,丛芽增殖倍数达到4.82,丛芽粗壮,生长旺盛(见图1C)。随着6-BA浓度的增加, 丛芽增殖倍数降低, 并有愈伤产生,不利于后期壮苗培养。因此,适合香椿丛芽诱导的最佳培养基为:MS+1.0 mg·L-16-BA+0.1 mg·L-1NAA+1.0 mg·L-1GA3(C5组)。
2.4 不同植物生长调节剂对香椿试管苗壮苗培养的影响
由于丛芽诱导的无菌苗较瘦弱, 进行壮苗培养有利于得到健壮芽苗。由表4可知,只添加2.0 mg·L-1GA3的D1组可以促进芽苗生长,但芽苗细弱,添加6-BA和IAA后,芽苗基部都有膨大现象(D2~D7组)。当6-BA浓度一定时,随着IAA浓度的增加,苗高有所降低,当IAA浓度达到0.5 mg·L-1时有愈伤产生。当6-BA为1.0 mg·L-1时,芽苗有增殖现象发生,不利于壮苗培养。因此,香椿无根苗壮苗的最佳培养基为:MS+0.5 mg·L-16-BA+0.05 mg·L-1IAA+2.0 mg·L-1GA3(D2组)。
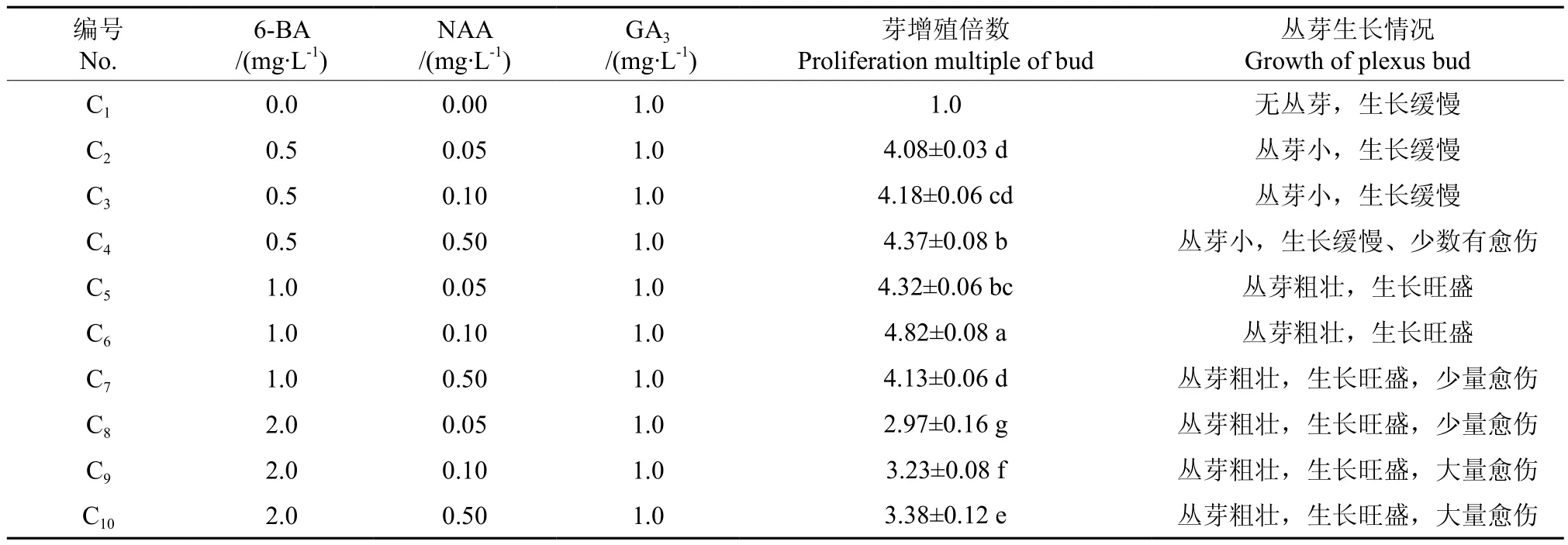
表3 不同植物生长调节剂对丛生芽诱导的影响Table 3 Effects of plant growth regulators on the induction of cluster buds

表4 不同植物生长调节剂对香椿试管苗壮苗培养的影响Table 4 Effects of different plant growth regulators on seedling culture of Toona sinensis
2.5 不同植物生长调节剂对生根的影响
由表5可知,当培养基中(E1组)没有添加任何植物生长调节剂,芽苗的生根率和生根条数都为0。当培养基中只添加IBA时,随着IBA浓度的增加,生根率和平均生根条数增大,当IBA浓度为2.0 mg·L-1时,10 d后有白色根系产生,45 d后生根效果最佳,生根率为78.16%,平均生根条数为4.8,根系发达(见图1F、1G)。当培养基中加入2.0 mg·L-1IBA时,随着NAA浓度增加生根率逐渐下降,并且根系分化不明显,芽苗基部产生愈伤并有玻璃化现象产生,不利于后期炼苗移栽(见图1H)。因此,MS+IBA 2.0 mg·L-1为生根的最适培养基(E5组)。将生根45 d的试管苗打开瓶盖在人工气候室中炼苗2 d,保持其湿度为65%左右。去掉根部的培养基, 然后移栽到园土∶草炭土∶珍珠岩体积比为2∶2∶1的混合基质中,移栽初期保持盆内微环境相对湿度为75%~85%。30 d后统计移栽成活率达到77.5%(见图1I)。
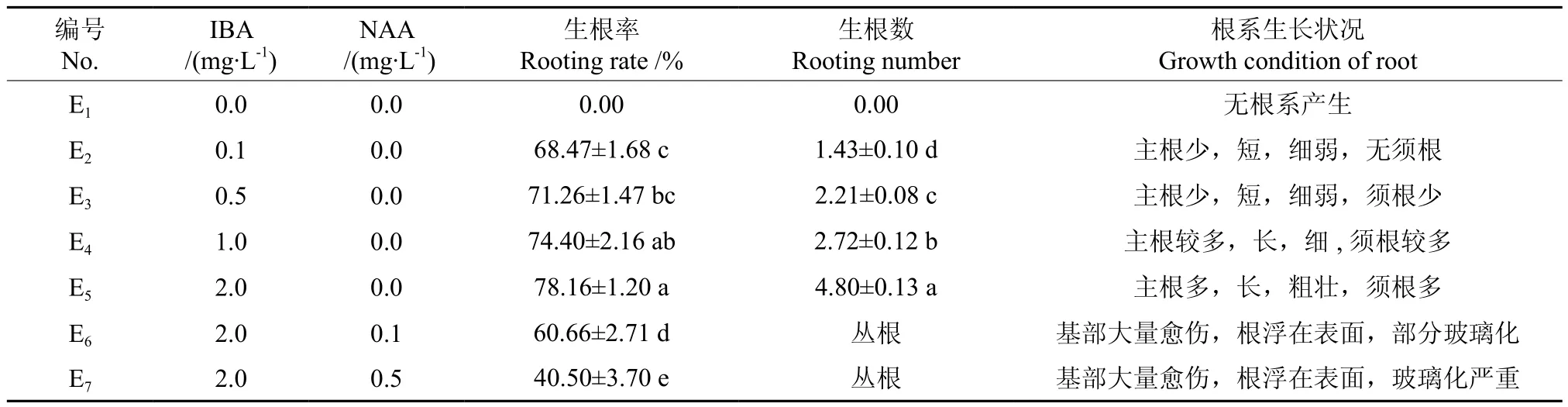
表5 不同植物生长调节剂对生根的影响Table 5 Effects of plant growth regulators on the percentage of rooting
3 结论与讨论
在植物组织培养中,菌类污染是实验成功与否的关键因素之一。根据不同种子选择合适的消毒材料、消毒时间是降低组织培养中外植体菌类污染和快速、高效地获得无菌材料的关键步骤,常用的消毒剂有:酒精,溴水,次氯酸钠,过氧化氢,升汞,抗生素和高锰酸钾等,其中升汞被认为是目前消毒效果最好的。本试验在对香椿种子灭菌处理时发现3种材料都有灭菌的作用。虽然升汞对香椿种子灭菌效果最好,但种子萌发效果明显低于次氯酸钠和双氧水,这与江涛等[7]在毛竹种子组培灭菌试验中研究结果一致。培养基对植物组织培养有一定的影响,1/2MS培养基是油桐种胚再生体系建立的较佳培养基[8]。WPM培养基是最适合美国流苏离体胚萌发启动的基本培养基[9]。吴俊长等[10]发现将珙桐种胚接种于WPM培养基上,外表面2 d后形成少许致密氧化物,些许褐化,后期生长快速。本试验中,1/2MS和WPM培养基对香椿种子的成苗率影响差异不大,但都显著高于MS培养基,可能原因是MS培养基中无机盐含量高影响种子的萌发。
增殖倍数的高低反映了植物快速繁殖的速度和效率,是工厂化育苗时预估苗木生产总量的重要指标,在丛生芽的诱导培养中,6-BA的使用比较常见,但常与其他植物生长调节剂一起使用[11]。本试验中,随着培养基中添加6-BA浓度的升高,香椿芽苗的增殖倍数呈先增大后减小的趋势,与大花型红花蝴蝶兰组培增殖结果一致[12];随着NAA浓度的增加,芽膨大变形成为绿色半透明的畸形苗,基部出现愈伤并有玻璃化现象产生,与百合科巴迪亚寿组培增殖结果一致[13]。有学者研究表明,增殖倍数过高会引起组培苗的弱化, 生长势变差[14]。本试验中当6-BA浓度为0.5 mg·L-1时,增殖倍数显著高于6-BA浓度为2.0 mg·L-1,但丛芽小,生长缓慢。
由于丛芽诱导的无菌苗较瘦弱,在培养中添加细胞分裂素和生长素进行壮苗,有利于得到健壮芽苗。已有学者进行大量研究,迷人杜鹃在0.5 mol·L-12-ip+0.1 mol·L-1NAA 的培养基上壮苗效果最佳[15]。堇叶紫金牛的最佳壮苗培养基为1.0 mg·L-1KT+0.5 mg·L-1NAA[16]。本试验结果表明:当培养基中添加较低浓度的6-BA(0.5 mg·L-1)时,IAA浓度降低更有利于壮苗培养,可能原因是随着培养时间的延长,芽苗体内的激素在逐渐升高,过高的激素对芽苗的生长有抑制作用[17-18];高浓度的生长素和细胞分裂素组合会使芽苗增高效果减弱并有愈伤产生,这与田奥磊等在武夷岩茶壮苗生长培养试验中研究结果一致[19]。在进行生根诱导培养时,IBA和NAA是最广泛应用的植物生长调节剂。本试验结果表明:培养基中添加IBA的浓度越高,生根率越高,芽苗根系生长情况越好,这与陈珂在红椿生根培养试验中结果一致[20]。当IBA浓度为2.0 mg·L-1时,随着NAA激素浓度的提高,生根率降低,根部愈伤组织增多,与晏姝等在南洋楹和郭树义等在乌腺金丝桃组培生根试验中研究结果一致[21-22]。
目前,香椿组织培养常以叶片、带芽茎段为起始外植体,许丽琼等[5,23]以叶片为起始外植体诱导香椿组培苗时发现,获得无菌叶片时容易出现褐化现象。梁明勤等[24]以带芽茎段为起始外植体发现,在生根培养时添加1 g·L-1AC 的处理不仅生根率高,而且芽苗粗壮。马勤[25]研究发现以带芽茎段为起始外植体进行组织培养时受到取材的限制,其中以6月中旬—7月下旬的当年生半木质化的非休眠期腋芽茎段为最佳。本研究以种子获得无菌苗为起始外植体建立香椿的组培快繁技术体系,可以不受取材时间的限制,并且以种子为起始外植体诱导的香椿无菌苗,其下胚轴和子叶更易诱导出愈伤组织,可为下一步香椿组织培养的间接发生体系打下基础。后续将对叶片和下胚轴诱导愈伤组织及其诱导分化成芽这一部分内容进行研究,为其规模化生产提供多途径的技术依据。
