熏蒸浸提法测定碱性土微生物生物量碳初探①
2018-07-27刘雨晴朱小琴胡会峰张金波
刘雨晴,朱小琴,胡会峰*,张金波
熏蒸浸提法测定碱性土微生物生物量碳初探①
刘雨晴1,2,朱小琴2,胡会峰2*,张金波1
(1南京师范大学地理科学学院,南京 210023;2中国科学院植物研究所植被与环境变化国家重点实验室,北京 100093)
为探究熏蒸浸提法测定碱性土壤微生物生物量碳(microbial biomass carbon,MBC)的最优熏蒸时间和浸提液浓度,本研究采用9种熏蒸时间、2种K2SO4浸提液浓度对不同有机质含量的碱性土壤MBC进行了测定。结果表明:①对于碱性土壤,熏蒸时间的选择与土壤有机质含量有关,土壤有机质含量越高,MBC提取值达到稳定的熏蒸时间越长。建议测定高有机质土壤(≥60 g/kg)MBC时熏蒸时间不少于24 h;测定中、低有机质土壤(≤30g/kg)MBC时熏蒸时间不少于18 h。②土壤有机质含量影响K2SO4浸提液的提取效率,测定高、中有机质土壤MBC时需要0.5 mol/L K2SO4浸提液进行提取;在低有机质土壤MBC测定中,0.25 mol/L K2SO4浸提液即可。③对于未知有机质含量的碱性土壤建议氯仿熏蒸时间至少为24 h,K2SO4浸提液浓度为0.5 mol/L。
氯仿熏蒸;熏蒸时间;碱性土;有机质;微生物生物量碳
土壤微生物是土壤生态系统的重要组成部分,直接参与土壤中能量和养分的循环转化[1-2]。土壤微生物生物量是指除了植物根系和体积大于5×103µm3的土壤动物以外的所有活有机体的量,是土壤养分的储存库,是植物所需营养物质的重要来源[3-4]。因此,如何准确提取并测定土壤微生物生物量,尤其是土壤微生物生物量碳(microbial biomass carbon, MBC)对土壤微生物生态系统研究具有重要的意义。目前,MBC测定方法主要有直接镜检法、熏蒸培养法[5]、熏蒸浸提法[6-7]、成分分析等方法,其中熏蒸浸提法因其操作简单、测量快速、适用土壤范围较广等优点,得到广泛应用。但是,熏蒸浸提法本身并不完善,曾有研究发现浸提效率受到土壤含水率[8]、土壤质地[9]、转换系数ec[10]以及浸提过程中土液比等因素的影响。因此,优化土壤MBC的提取方法对其精确测定具有重要的意义。
之前的研究表明,熏蒸时间和浸提液浓度是影响MBC测定的重要影响因素[11-12]。熏蒸浸提法由Brooks于1985年提出,研究发现酸性土壤微生物生物量氮在氯仿熏蒸24 h后,其提取值即达到稳定状态,但在熏蒸5 d后达到最大值。因此,24 h的熏蒸时间也沿用到土壤MBC的提取和测定[12]。Witt等[13]和Haubensak等[14]的研究结果表明,酸性土壤MBC的提取值在氯仿熏蒸24 h时达到相对稳定,但并非最大值。而Haubensak等[14]与Ross和Tate[15]研究不同熏蒸时间(1 ~ 5 d)对山毛榉林强酸性表层土MBC值的影响,发现MBC值不会随着熏蒸时间的增加而发生显著变化。Haney等[11]研究不同浓度的K2SO4(0 ~ 0.5 mol/L)浸提液对不同pH土壤MBC的浸提影响,发现高pH土壤下不同浓度的K2SO4浸提液的碳提取效率存在波动。同时,考虑到K2SO4溶解度较小的特点,一些研究采用较低浓度的K2SO4浸提液提取MBC。已有的文献设计的熏蒸时间间隔不均匀且试验过程中难以维持持续且长久的氯仿蒸汽,并且,碱性土壤中的Ca2+易与浸提液中高浓度SO2– 4离子产生沉淀反应,从而影响提取效率。此外,目前的研究多集中于酸性土壤,而土壤pH是影响K2SO4浸提液提取MBC的关键因子之一[11],因此熏蒸浸提法测定碱性土壤MBC的适用条件还有待研究。本文选取3种不同有机质含量的碱性土壤,采用9种熏蒸时间、2种浸提液浓度对土壤进行MBC的提取、测定和比较,探究不同熏蒸时间和浸提液浓度对熏蒸浸提法测定碱性土壤MBC的影响,以进一步优化碱性土壤MBC的测定方法。
1 材料与方法
1.1 供试土壤
供试土壤样品采自北京植物园及其周边(39°48′ N,116°28′ E)。根据土壤中有机质的含量,将其分成高有机质土壤(> 40 g/kg)、中有机质土壤(20 ~ 40 g/kg)和低有机质土壤(< 20 g/kg),土壤基本理化性质见表1。
1.2 土壤样品采集与预处理
去除土壤表面枯枝落叶层后,每个样点采集表层土壤,采回土样放置于-20℃冰箱保存备用。试验时剔除样品中可见的动植物残体和石砾,充分混合均匀后过2 mm筛,分别用于测定土壤理化性质和土壤预培养。
1.3 土壤理化性质的测定
土壤有机质采用硫酸-重铬酸钾法测定;pH采用电极法在1∶2.5土水比下测定;全氮采用元素分析仪测定;碱解氮测定采用碱解扩散法测定。
1.4 土壤预培养
将土样含水量调节至40% 的田间持水量,置于25℃培养箱中预培养一周,同时在培养箱中分别放置盛有水和0.5 mol/L NaOH溶液的烧杯,以保持培养箱中的湿度和吸收微生物呼吸产生的CO2。
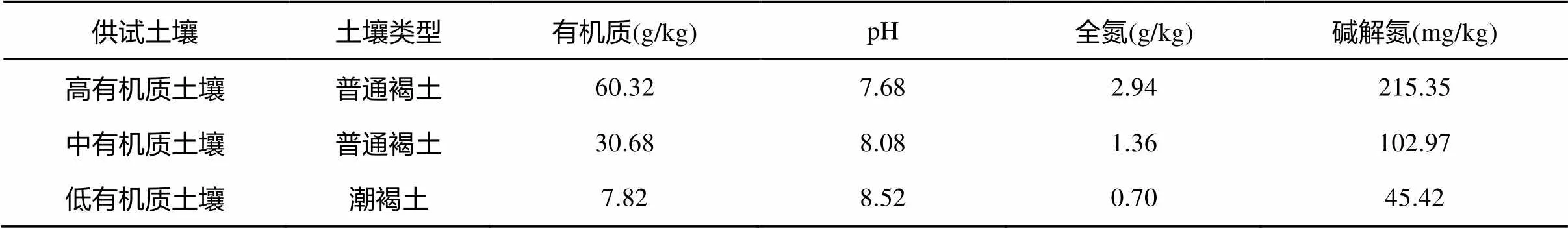
表1 土壤理化性质
1.5 试验设计及土壤MBC的测定
试验设计如表2所示,共设置18个处理(9个氯仿熏蒸时间×2个浸提浓度),每个处理3个重复。具体步骤如下:称取相当于10 g烘干土重的湿土,放入聚乙烯瓶,并置于真空干燥器中,同时放入盛有过量去乙醇氯仿(加入少量沸石)和盛有50 ml 1 mol/L NaOH溶液的烧杯。另外,在干燥器底部放入湿润的滤纸。干燥器密封后抽真空至氯仿沸腾并保持3 min,关闭干燥器在25℃的黑暗条件下按试验设计放置相应的时间。待熏蒸结束后,取出盛有氯仿和NaOH的烧杯并反复抽气,直到土壤中闻不到氯仿气味为止。随后分别向熏蒸和未熏蒸土样中加入0.25 mol/L或0.5 mol/L K2SO4溶液,振荡30 min(25℃,200 r/min)后用中速滤纸过滤,浸提液保存在-20℃冰箱中待测。用总有机碳分析仪(multi N/C 3100, Analytic Jena AG)测定浸提液中的MBC含量,并用0.45对测定结果进行校正[16]。
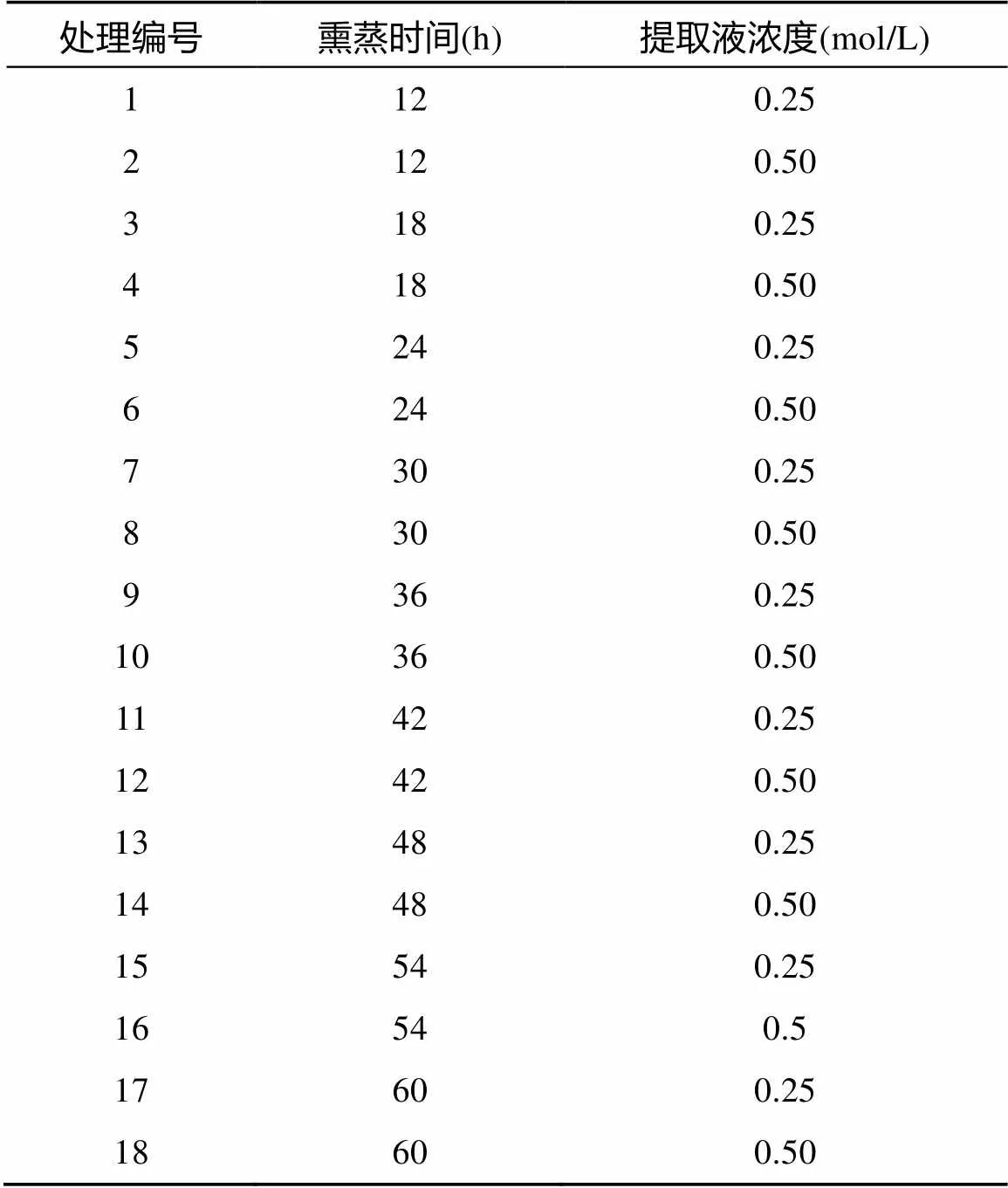
表2 不同熏蒸时间和K2SO4浸提液浓度的试验设计
1.6 数据处理
在IBM Statistics SPSS 18.0中采用检验和双因素方差分析对处理间差异进行显著性检验。
2 结果
2.1 熏蒸时间对MBC提取和测定的影响
对于高有机质土壤(图1),在24 h熏蒸处理后,0.25 mol/L K2SO4浸提液提取的MBC值开始增高;随着熏蒸时间的增长,0.25 mol/L K2SO4浸提液提取MBC值保持稳定;当54 h熏蒸处理时,MBC值达到最大,而60 h熏蒸处理MBC值明显降低。采用0.5 mol/L K2SO4浸提液提取,在18 h氯仿熏蒸处理后其提取的MBC值开始明显升高;至24 h时达到较高点,随后随着熏蒸时间的增长,MBC值在330 ~ 430 mg/kg波动;当熏蒸时间超过54 h后,MBC值开始降低。因此,建议测定高有机质土壤MBC时熏蒸时间超过24 h。

(A:0.25 mol/L K2SO4;B:0.5 mol/L K2SO4)
对于中有机质土壤(图1),在氯仿熏蒸12 h后,0.25 mol/L和0.5 mol/L K2SO4提取MBC值均开始明显增高,并且分别在18 h和24 h氯仿熏蒸处理后保持稳定;随着熏蒸时间的增长,MBC值在300 ~ 400 mg/kg波动。因此,测定中有机质土壤MBC建议熏蒸时间超过18 h即可。
对于低有机质土壤(图1),在18 h氯仿熏蒸处理后,0.25 mol/L和0.5 mol/L K2SO4提取MBC值都发生波动变化;并且,随着熏蒸时间的增长,MBC值在80 ~ 120 mg/kg 波动。因此,测定低有机质土壤MBC建议熏蒸时间在24 ~ 30 h。
2.2 浸提液浓度对MBC提取和测定的影响
如表3所示,对高有机质土壤,当熏蒸时间<24 h时,0.25 mol/L K2SO4浸提液提取的MBC值高于0.5 mol/L K2SO4溶液,差异不显著,但表明0.25 mol/L K2SO4溶液的MBC提取效率更高;当熏蒸时间≥24 h时,0.5 mol/L的K2SO4溶液的MBC提取效率更高,且在24、54、60 h时产生显著差异(<0.05)。对中有机质土壤,不同浓度K2SO4浸提液在不同熏蒸时间下MBC提取的效率没有明显规律,且仅在熏蒸时间为36 h时,高浓度K2SO4浸提液的浸提效率更高。与中有机质土壤相似,在不同熏蒸时间下,没有明显的规律存在于不同浓度K2SO4浸提液对低有机质土壤MBC的提取,且所有的熏蒸时间下提取效率没有显著差异。

表3 不同浸提液浓度对土壤MBC的影响
注:表中数据为平均值±标准差;同列不同小写字母和大写字母分别表示处理间差异达到<0.05和<0.001显著水平,ns表示处理间差异不显著。
如表4所示,双因素方差分析结果表明高有机质土壤中MBC的测定受到熏蒸时间、K2SO4浸提液浓度以及它们之间交互作用的显著影响(<0.05);中有机质土壤MBC的测定受到熏蒸时间和熏蒸时间× K2SO4浓度的显著影响(<0.05);而低有机质土壤MBC只受到熏蒸时间的显著影响(<0.001)。

表4 熏蒸时间和K2SO4浓度对土壤MBC影响的双因素方差分析
注:表中数据表示熏蒸时间和K2SO4浸提液浓度对MBC影响的值,*表示影响达到<0.05显著水平,**表示影响达到<0.01显著水平,***表示影响达到<0.001显著水平。
3 讨论
本研究结果表明,碱性土壤最优熏蒸时间和浸提液浓度的选择与土壤有机质含量有关,熏蒸时间对于不同有机质含量土壤MBC的测定有极显著效应,K2SO4浸提液浓度对高有机质土壤有极显著效应。土壤有机质含量越高,MBC值达到稳定的熏蒸时间越长。可能的原因是有机质含量越高,土壤中微生物数量和种类越多,群落更复杂,氯仿蒸汽完全杀死微生物所需的时间也就更长[8]。24 h熏蒸处理后,碱性土壤MBC值达到稳定,但并非最大,与Witt等[13]和Haubensak等[14]在酸性土壤的研究结果一致。随着熏蒸时间的增长,MBC值发生波动变化是因为熏蒸过程中MBC的含量存在动态平衡。一方面,微生物细胞被氯仿破坏并溶解增加MBC的含量;另一方面,死亡的微生物部分生物量碳被矿化成CO2,同时,未被熏蒸杀死的微生物在新陈代谢中将可溶性生物量碳降解转化为其他不可溶代谢产物[17-18]。另外,不同微生物类群对氯仿熏蒸时间响应的不同,导致MBC变化的速率不同,从而造成MBC值的波动。此外,熏蒸时间过长导致土壤中的氯仿残留,也可能引起MBC值产生变化[19]。
K2SO4浸提液浓度显著影响高有机质土壤的MBC含量,而在较低有机质含量的土壤中,K2SO4浸提液浓度对MBC值的提取没有显著影响。高浓度的浸提液有较高的离子强度能够更多地溶解被氯仿破坏的有机碳,在高有机质土壤中,MBC含量较高,所需的离子浓度越大,因此浸提液浓度会显著影响MBC的提取和测定;而较低有机质含量的土壤中MBC含量较低,低浓度的浸提液就足够高效地提取MBC,所以浸提液浓度对MBC的提取和测定没有显著影响。同时,熏蒸时间和K2SO4浸提液浓度对于高、中有机质土壤MBC测定存在显著的交互影响。然而,碱性土壤MBC在提取过程中,Ca2+易在高浓度的K2SO4溶液中形成K2Ca(SO4)2白色沉淀[11],可能对K2SO4浸提液提取可溶性有机碳造成影响,同时,提取过MBC的溶液易析出白色晶体,可能是因为温度的变化和K2SO4溶解度较低导致K2SO4晶体析出。因此,更多电解质溶液浓度梯度需要在今后的研究中深入探讨。
4 结论
1) 对于碱性土壤,建议测定高有机质土壤MBC时熏蒸时间不少于24 h;测定中、低有机质土壤MBC时熏蒸时间不少于18 h。
2) 土壤有机质含量影响不同浓度K2SO4浸提液的浸提效率,测定高、中有机质土壤MBC需要0.5 mol/L K2SO4浸提液;在低有机质土壤MBC测定中使用0.25 mol/L的K2SO4浸提液即可。在大部分情况下,浸提液浓度对MBC提取效率的影响不显著,但0.5 mol/L K2SO4浸提液提取的MBC值略高于0.25 mol/L K2SO4浸提液(>0.05)。
3) 在实际科研工作中,在未知土样有机质含量情况下测定MBC,从熏蒸提取效率和试验周期综合考虑,建议碱性土壤氯仿熏蒸时间至少为24 h,K2SO4浸提液浓度为0.5 mol/L。
[1] 王慧, 桂娟, 刘满强, 等. 稻草和三叶草分解对微型土壤动物群落的影响[J]. 土壤学报, 2015, 52(5): 1124-1134
[2] 吴云当, 李芳柏, 刘同旭. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展[J]. 土壤学报, 2016, 53(2): 277-291
[3] 刘钊, 魏天兴, 朱清科, 等. 黄土丘陵沟壑区典型林地土壤微生物、酶活性和养分特征[J]. 土壤, 2016, 48(4): 705-713
[4] 孔涛, 张德胜, 徐慧, 等. 盐碱地及其改良过程中土壤微生物生态特征研究进展[J]. 土壤, 2014, 46(4): 581-588
[5] Jenkinson D S, Powlson D S. The effects of biocidal treatments on metabolism in soil—V : A method for measuring soil biomass[J]. Soil Biology and Biochemistry, 1976, 8(3): 209-213
[6] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(19): 703-707
[7] Zhao J, Ni T, Li Y, et al. Responses of bacterial communities in arable soils in a rice-wheat cropping system to different fertilizer regimes and sampling times[J]. Plos One, 2014, 9(1): e85301
[8] Ross D J. Estimation of soil microbial C by A fumigation- extraction procedure: Influence of soil moisture content[J]. Soil Biology and Biochemistry, 1989, 21(6): 767-772
[9] Alessi D S, Walsh D M, Fein J B. Uncertainties in determining microbial biomass C using the chloroform fumigation–extraction method[J]. Chemical Geology, 2011, 280(1–2): 58-64
[10] Joergensen R G. The fumigation-extraction method to estimate soil microbial biomass: Calibration of thevalue[J]. Soil Biology and Biochemistry, 1996, 28(1): 25-31
[11] Haney R L, Franzluebbers A J, Hons F M, et al. Molar concentration of K2SO4, and soil pH affect estimation of extractable C with chloroform fumigation–extraction [J]. Soil Biology and Biochemistry, 2001, 33(11): 1501-1507
[12] Brookes P C, Kragt J F, Powlson D S, et al. Chloroform fumigation and the release of soil nitrogen: The effects of fumigation time and temperature[J]. Soil Biology and Biochemistry, 1985, 17(6): 831-835
[13] Witt C, Gaunt J L, Galicia C C, et al. A rapid chloroform-fumigation extraction method for measuring soil microbial biomass carbon and nitrogen in flooded rice soils[J]. Biology and Fertility of Soils, 2000, 30(5): 510-519
[14] Haubensak K A, Hart S C, Stark J M. Influences of chloroform exposure time and soil water content on C and N release in forest soils[J]. Soil Biology and Biochemistry, 2002, 34(11): 1549-1562
[15] Ross D J, Tate K R. Microbial C and N in litter and soil of a southern beech () forest: Comparison of measurement procedures[J]. Soil Biology and Biochemistry, 1993, 25(4): 467-475
[16] Wu J, Joergensen R G, Pommerening B, et al. Measurement of soil microbial biomass C by fumigation extraction an automated procedure[J]. Soil Biology, 1990, 22(8): 1167-1169
[17] Alessi D S, Walsh D M, Fein J B. Uncertainties in determining microbial biomass C using the chloroform fumigation-extraction method[J]. Chemistry Geology, 2011, 280(1/2): 58-64
[18] Zelles L, Palojarvi A, Kandeler E, et al. Changes in soil microbial properties and phospholipid fatty acid fractions after chloroform fumigation[J]. Soil Biology and Biochemistry, 1997, 29(9/10): 1325-1336
[19] 陈国潮. 土壤微生物量测定方法现状及其在红壤上的应用[J]. 土壤通报, 1999(6): 284-287
Preliminary Study of Fumigation Extraction in Microbial Biomass Carbon of Alkali Soil
LIU Yuqing1,2, ZHU Xiaoqin2, HU Huifeng2*, ZHANG Jinbo1
(1 School of Geography Science, Nanjing Normal University, Nanjing 210023, China; 2 State Key Laboratory of Vegetation and Environmental Change, Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China)
In order to provide the scientific bases for the precise determination of soil microbial biomass (MBC), 9 chloroform fumigation time and 2 K2SO4concentrations were performed to explore the optimal fumigation time and extracted concentration for alkaline soil MBC determination. The results showed that in alkaline soils, fumigation time is significantly correlated with soil organic matter (SOM) concentration. Higher SOM concentration needs longer fumigation time to obtain stable MBC content. Fumigation time for high SOM (≥60g/kg) is at least 24 hours, while that of middle and low SOM (≤30g/kg) is at least 18 hours. SOM concentration influences K2SO4extraction efficiency, the high and middle SOM concentration soils need 0.5 mol/L K2SO4solution to extract, 0.25 mol/L K2SO4solution is enough to extract the MBC contents for low SOM soil. Thus, for a given soil with unknownSOM concentration, the recommended fumigation time and K2SO4concentration is at least 24 h and 0.5 mol/L separately.
Chloroform fumigation; Fumigation time; Alkaline soil; Organic matter; Microbial biomass carbon
国家重点基础研究发展计划项目(973计划)(2015CB954201;2014CB954303)资助。
(huifhu@ibcas.ac.cn)
刘雨晴(1994—),女,四川攀枝花人,硕士研究生,主要研究方向为土壤生态学。E-mail:yuqingliunjnu@163.com
10.13758/j.cnki.tr.2018.03.028
S154.3
A
