3种园林植物的土壤元素及酶活性对盐胁迫的响应
2018-07-27邹晓君郑欣颖列志旸
邹晓君,郑欣颖,列志旸,薛 立
(华南农业大学 林学与风景园林学院,广东 广州 510642)
土壤是植物生长的基质,其养分含量反映土壤肥力水平[1],对植物生长发育具有重要影响[2-3],而土壤酶参与土壤中的各种化学反应、生物化学过程和物质循环,其活性是土壤生物性能中最稳定和最敏感的指标[4],体现土壤微生态环境功能的多样性和稳定性[5]。土壤含盐量是土壤理化性质的重要指标之一[6],土壤盐浓度过高会使土壤板结,影响土壤通透性和水分渗透,严重时会导致土壤膨胀积水和出现厌氧现象[7]。高盐分浓度还会抑制土壤中的微生物活动和数量,降低酶活性和有机质分解率,导致土壤活性养分库减小[8-9],直接影响植物生长。当前,由于再生水灌溉和全球气候变暖造成的海平面上升加速了沿海地区土地的盐渍化,许多滨海园林植物不适应在盐渍化地生长而枯萎死亡,影响滨海景观和生态效益的发挥。
目前,关于盐胁迫的土壤研究多集中于林木和作物,如张建锋等[10]发现盐胁迫的柳树Salix viminalis新无性系苗木的土壤酶活性随盐浓度的提高而下降,对土壤的理化性状产生了抑制作用;弋良朋等[11]发现7种盐生植物的土壤Na+含量富集程度较其他营养离子高,滨海盐生植物盐角草Salicornia europaea、盐地碱蓬Suaeda salsa、中亚滨藜Atriplex centralasiatica和芦苇Phragmites communis对土壤酶活性影响不同[12];路海玲等[13]报道,棉田土壤的有机质、碱解氮、全氮、速效钾、有效磷均随盐浓度的升高而逐渐下降,但罕见盐胁迫对园林植物土壤影响的报道。大红花Hibiscus rosasinensis、龙船花Ixora chinensis和鹅掌藤Schef flera arboricola是我国南方滨海3种重要的园林植物,前人对这3种植物在盐胁迫下的叶片和土壤养分[14]、光合特性[15]、生物量[16]和器官元素[17]、龙船花的生理[18]和鹅掌藤的荧光特性[19]进行过研究,尚未见到盐胁迫对这些植物的土壤特性影响的报道。笔者将以上3种园林植物置于人工模拟盐环境中,研究盐胁迫对其土壤化学性质及酶活性的影响,以期为滨海园林植物的土壤管理提供参考。
1 材料与方法
1.1 试验地概述
试验地位于广州市华南农业大学林学与风景园林学院圃(113°18′E,20°06′N),属亚热带季风气候,年降水量1 714. 4 mm,集中于夏季。最热月和最冷月平均温度分别为28.7℃(7月)和13.5℃(1 月)[20]。
1.2 试验材料
选用1年生大红花、龙船花和鹅掌藤实生苗作为试验材料,2016年5月进行移栽处理,栽入规格为口径10 cm、高12 cm的塑料花盆,每盆定值一株。土壤为以3∶1比例混合配制的黄心土和荷兰土,土壤的有机质、全氮、全磷、全钾和全钠含量分别为77.14、2.00、0.91、14.17和1.38 g·kg-1,碱解氮、有效磷、速效钾和速效钠分别为 146.68、45.65、134.88 和 71.92 mg·kg-1。3 种园林植物的基本特征见表1。
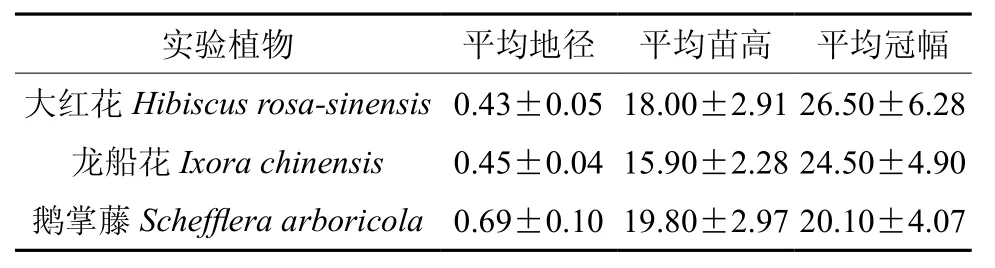
表1 3种园林植物的基本特征(平均值±标准差)Table1 General characteristics of landscape seedlings of three species (mean±SD) cm
1.3 实验方法
盐分质量分数参考冯蕾等[21]的NaCl溶液加入法,设置3个盐质量分数:对照(CK)、0.3 %和0.6%。NaCl质量分数为盐分和土壤干质量之比,即n=(w1/w)×100%(n为NaCl质量分数;w1为NaCl质量;w为盆内干土质量),对照浇同样量的无离子水。其中,把定量的NaCl纯溶液浇到相应的花盆中,每个梯度NaCl纯溶液分3次浇灌,每隔1 d浇1次。每一浓度处理15个重复,3种植物共135个样品。为恒定盆中的盐分总量,花盆底部用托盘承接。试验期间,苗木放置于楼顶玻璃温室,所处的温度、光照条件一致,同时每株苗木每天浇水50 mL,每天1次,并将盘内渗出水分及时返盆。样品处理30 d后,经不同质量分数处理的每种植物各取3个土壤样品,测定土壤pH值、有机质、全N、碱解N、全P、有效P、全K、速效K、全N、碱解N、过氧化氢酶、磷酸酶和脲酶含量。
将水和土样按2.5∶1比例混合后用玻璃电极法测定土壤pH值;用高温外热重铬酸钾氧化-容量法测定有机质;用火焰原子吸收分光光度法测定全Na;利用乙酸铵提取样品后,采用火焰原子吸收分光光度法测定交换性Na;用开氏-蒸馏滴定法测定全N;用碱解扩散法测定碱解N;利用氢氧化钠碱熔法将土壤样品溶融后提取待测液,采用钼锑抗比色法测全P;利用盐酸-氟化铵提取土壤样品后,采用钼锑抗比色法测有效P;用火焰原子吸收分光光度法测全K;利用乙酸铵提取土壤样品后,采用火焰原子吸收分光光度法测速效K。用容量法测定过氧化氢酶;用磷酸苯二钠比色法测定磷酸酶;用比色法测定脲酶活性。每个样品3次重复,结果取测定的算术平均值。
采用软件SAS 9.3及Microsoft Excel 2003进行数据统计分析。
2 结果与分析
2.1 土壤化学性质
不同盐质量分数下各植物土壤pH值存在显著差异(P<0.05)(见表2)。与对照相比,0.3%和0.6%盐质量分数下,大红花的土壤pH值分别减少了12%和16%,龙船花增加了7%和16%,鹅掌藤减少了1%和增加2%(见图1)。
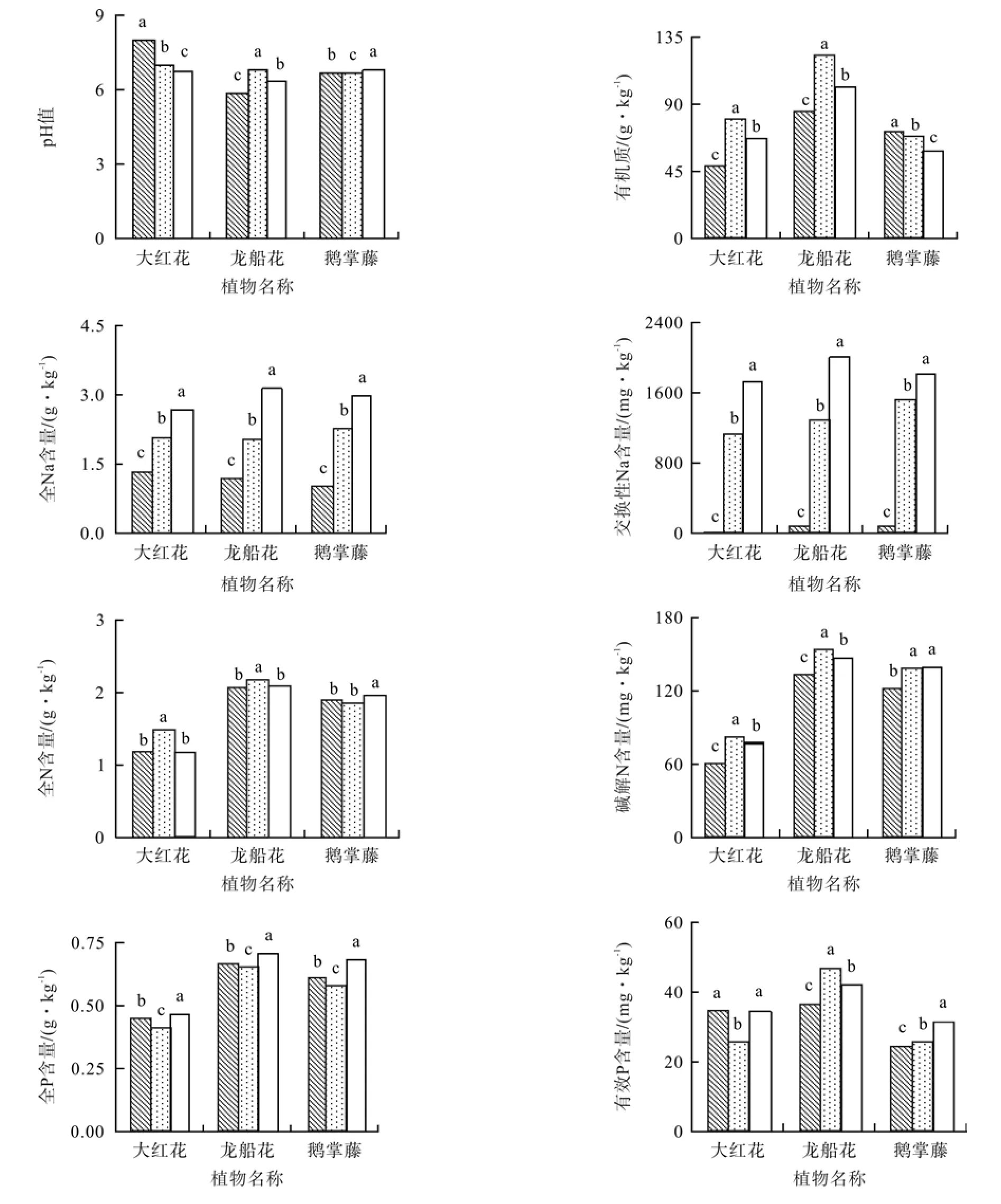
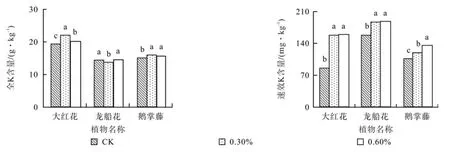
图1 盐胁迫下3种园林植物的土壤化学性质Fig.1 Soil chemical properties of landscape plants of three species under salt stress
除鹅掌藤外,大红花和龙船花的土壤有机质(SOM)均随盐质量分数升高而显著高于对照。与对照相比,0.3%和0.6%盐质量分数处理的大红花土壤有机质分别增加了64%和38%,龙船花增加了45%和20%,鹅掌藤减少了3%和15%。
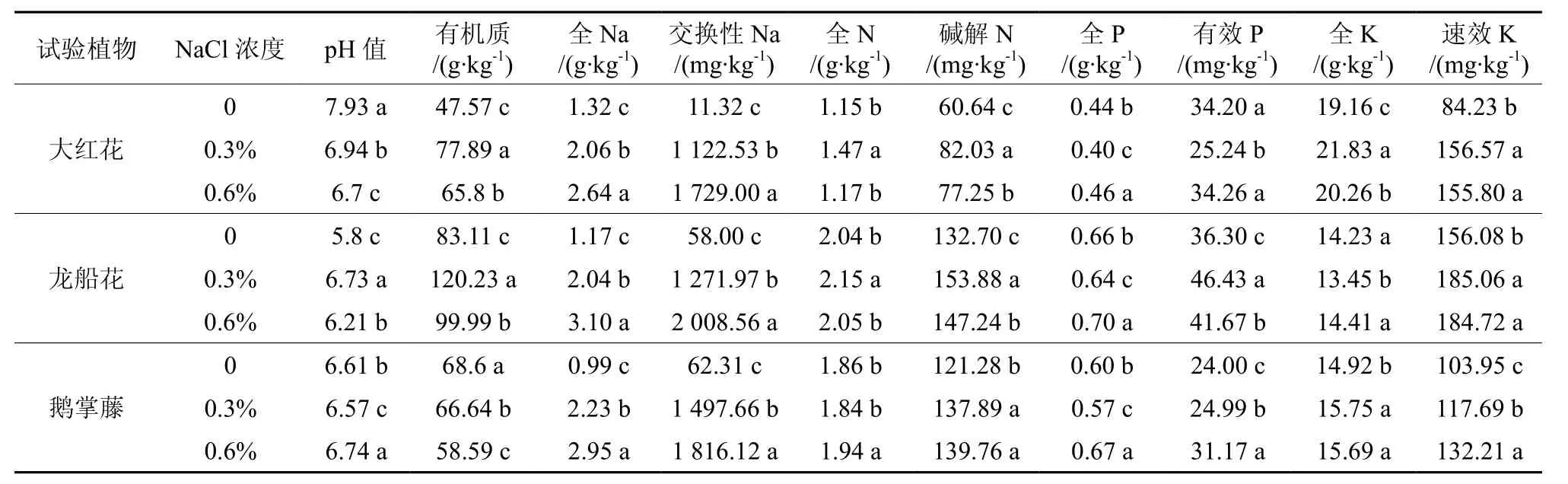
表2 盐胁迫下3种园林植物的土壤化学性质†Table2 Soil chemical properties of landscape plants of the three species under salt stress
3种植物的土壤全Na(TNa)和交换性Na(ENa)含量均随盐质量分数升高而显著增加(P<0.05),且交换性Na增幅较全Na高。与对照相比,0.3%和0.6%盐胁迫的大红花、龙船花和鹅掌藤的土壤全Na分别增加了56%和101%、74%和164%、125%和199%;大红花、龙船花和鹅掌藤的土壤交换性Na分别增加了98倍和152倍、21倍和34倍、23倍和28倍。
大红花和龙船花土壤全N(TN)含量均随盐质量分数升高而高于对照:与对照相比,0.3%和0.6%盐质量分数处理的大红花、龙船花土壤全N含量分别增加了28%和2%、6%和1%,鹅掌藤分别减少了1%和增加4%;大红花、龙船花和鹅掌藤的土壤碱解N含量分别增加了35%和27%、16%和11%、14%和15%。
与对照相比,各植物的土壤全P(TP)含量在低盐质量分数时减少,高盐质量分数时增加;0.3%盐胁迫下的大红花、龙船花和鹅掌藤的土壤全P含量分别减少了9%、3%和4%;0.6%盐胁迫下的大红花、龙船花和鹅掌藤的土壤全P含量分别增加了4%、6%和13%。除大红花外,龙船花和鹅掌藤的土壤有效P(AP)含量随盐质量分数升高而显著高于对照(P<0.05):0.3%和0.6%盐胁迫的大红花土壤有效P含量分别减少了26%和0%,而龙船花和鹅掌藤分别增加了28%和15%、4%和30%。
除0.3%盐质量分数胁迫的龙船花外,各植物的土壤全K(TK)和速效K(AK)含量随盐质量分数升高而显著高于对照(P<0.05)。与对照相比,0.3%和0.6%盐胁迫的大红花和鹅掌藤的土壤全K含量分别增加了14%和6%、6%和5%,龙船花减少了6%和增加1%;0.3%和0.6%盐胁迫下的大红花、龙船花和鹅掌藤的土壤速效K含量分别增加了86%和85%、13%和27%、19%和18%。
2.2 土壤酶活性的变化
各植物的土壤过氧化氢酶(CAT)活性随盐质量分数升高存在显著差异(P<0.05)(见表3)。与对照相比,0.3%和0.6%盐胁迫下大红花的土壤过氧化氢酶分别增加了4%和2%,龙船花增加了6%和减少12%,鹅掌藤减少了19%和21%(见图2)。
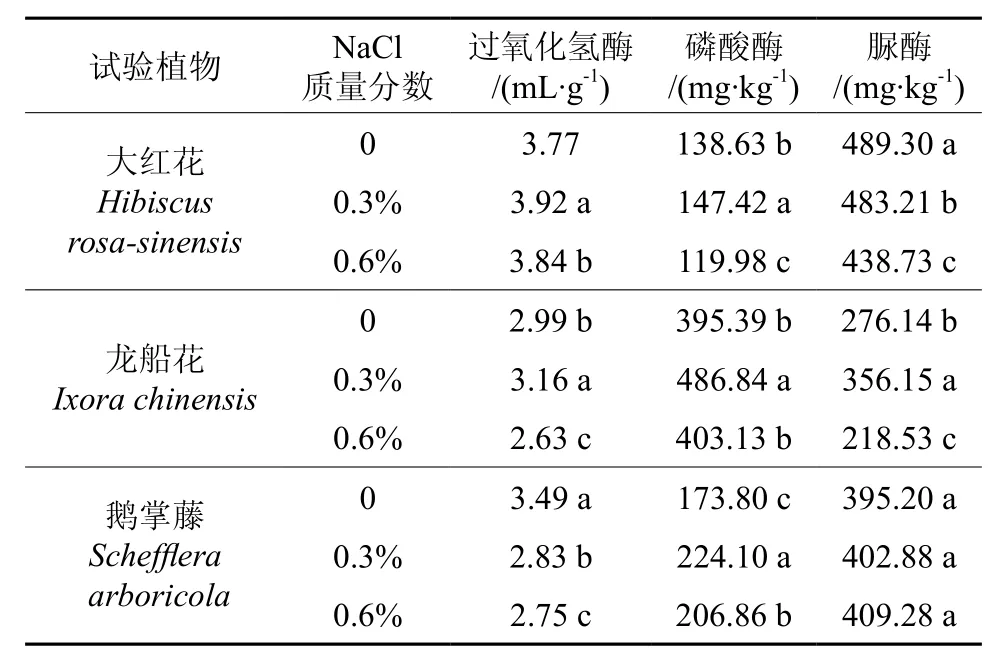
表3 盐胁迫下3种园林植物的土壤酶活性Table3 Soil enzymatic activity of landscape plants of three species under salt stress

图2 盐胁迫下3种园林植物的土壤酶活性Fig.2 Soil enzymatic activities of landscape plants the of three species under salt stress
除0.6%盐质量分数的大红花外,各植物的酸性磷酸酶(ACP)活性随着盐质量分数的升高而显著高于对照:0.3%和0.6%盐胁迫的大红花的酸性磷酸酶活性分别增加了6%和减少了13%,龙船花增加了23%和2%,鹅掌藤增加了29%和19%;
随着盐质量分数的增加,各植物的土壤脲酶(Urease)活性变化不同:0.3%和0.6%盐胁迫的大红花土壤脲酶活性分别减少了1%和10%,龙船花增加了29%和减少了21%,鹅掌藤增加了13%和27%。
2.3 土壤化学性质、土壤酶之间的相关性
由表4可以看出,NaCl质量分数与全Na和交换性Na呈极显著正相关;pH值与全N、碱解N和全P呈显著负相关;有机质与有效P呈显著正相关关系、与速效K呈极显著正相关;全Na与交换性Na呈极显著正相关;全N与碱解N呈极显著正相关,全N及碱解N与全P呈极显著正相关,与全K呈极显著负相关;全P与全K呈极显著负相关。由表5可知,脲酶分别与过氧化氢酶呈显著正相关关系,与磷酸酶呈极显著负相关,而NaCl质量分数与土壤酶之间相关性不明显。
3 结论与讨论
3.1 讨 论
3.1.1 盐胁迫对植物土壤化学性质的影响
土壤pH值影响土壤营养元素的转化和循环过程,一定程度决定土壤肥力的供给情况,是指示土壤质量的重要指标之一[22]。本研究中,与对照相比,0.3%和0.6%盐胁迫下的大红花和0.3%盐胁迫的鹅掌藤土壤pH值不同程度地降低,这可能是由于植株吸收Na+大于Cl-,即阳离子吸收总量大于阴离子,植物为了维持正常生长和电荷稳定而分泌H+,而OH-分泌量较小,土壤pH值下降,这与弋良朋等[23]对盐生植物的分析一致,也可能与土壤微生物和根系呼吸作用增强以及根系分泌的苹果酸、柠檬酸等有机酸有关[24-25],而0.3%和0.6%盐胁迫的龙船花和0.6%盐胁迫的鹅掌藤的土壤pH值呈现不同程度的升高的原因可能是由于植物根系吸收土壤氮素以硝态氮的形式(NO3-)为主,其消耗质子的还原过程会促进根系分泌OH-或HCO3-[26-27],使土壤碱化。土壤有机质是土壤中各种动植物残体、微生物及其分解与合成的各种有机形态的合称,是评价土壤肥力水平高低的重要指标之一[28]。在本研究中,与对照相比,大红花和龙船花经盐处理后土壤有机质均显著增加,且低盐胁迫下增幅大于高盐胁迫,这可能是由于低盐胁迫可促进根系分泌物增加,为土壤细菌和放线菌提供营养和能源,使微生物数量增加,从而促进土壤有机质含量升高[29];而高盐胁迫会致使根系分泌物浓度过高而造成自毒效应,影响土壤养分的有效化过程,使土壤有机质含量下降[30]。鹅掌藤的土壤有机质含量随土壤盐质量分数升高而减少,这与路海玲等[14]对棉田的土壤有机质含量的研究结论一致,这可能与植物生理生态特性有关。
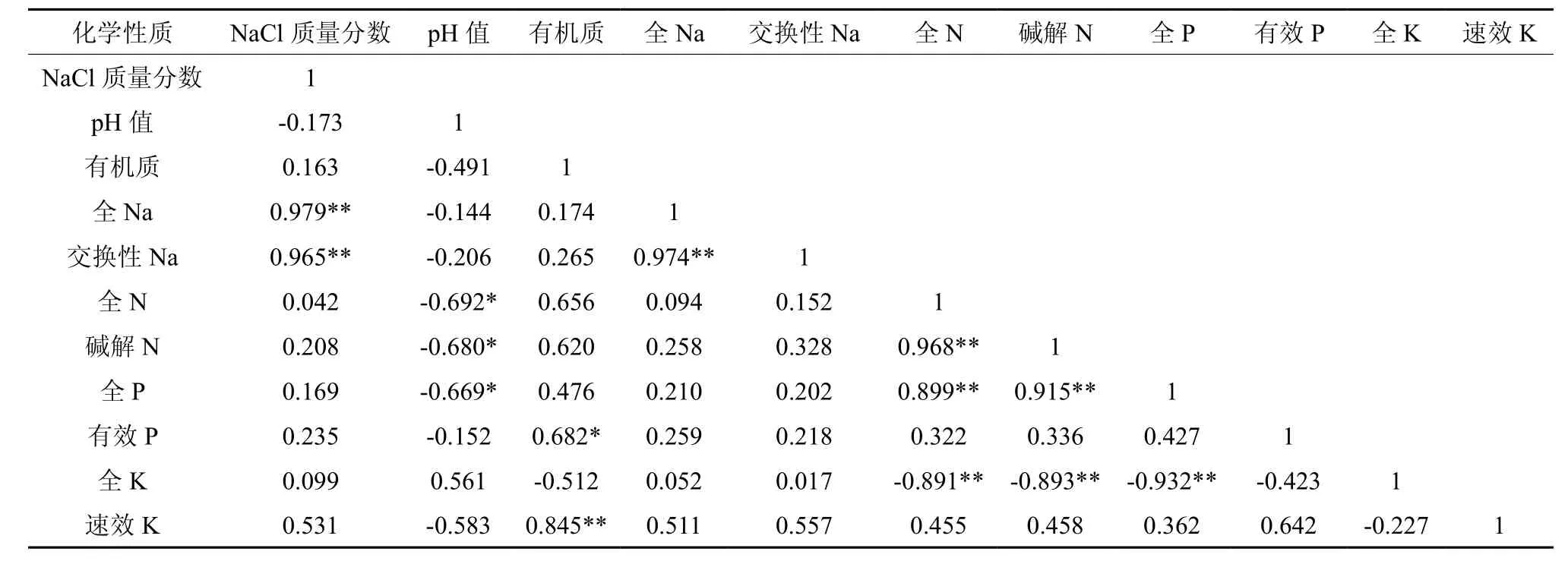
表4 土壤化学性质的相关性†Table4 Correlations among soil chemical properties
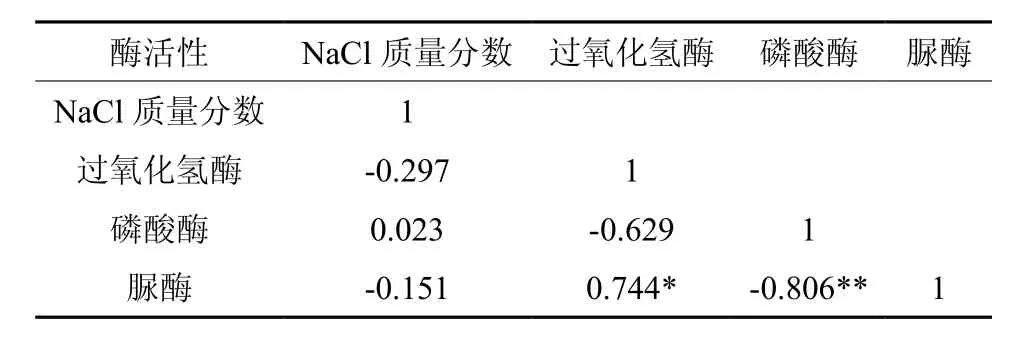
表5 土壤酶活性的相关性Table5 Correlations among soil enzymatic activities
钠普遍存在于高等植物。适量的Na+可维持植物的正常生长,有利于促进土壤颗粒紊凝,稳定土壤结构[31],但过量的Na+可能影响土壤pH值,破坏土壤固有的理化性质,改变土壤水分和盐分运动特征而引起土壤污染[32],严重时还会影响植株的存活率[33]。本研究中各植物的土壤全Na和交换性Na含量随着盐质量分数的增加而显著增加,相关性分析也表明NaCl质量分数与全Na和交换性Na呈极显著正相关关系,这会降低植物对钾的吸收,导致钾营养失调,同时影响植物蛋白质的新陈代谢[34]。此外,交换性Na的增幅远远大于全Na,土壤的交换性钠的过量积累可使胶体的扩散双电层厚度和电动电位增加[35],造成土壤颗粒收缩,影响土壤渗透性,导致根系呼吸微弱和代谢作用受阻,不利于土壤养分吸收。此外,不同植物的交换性Na和全Na增幅差距较大,表明植物之间土壤Na增量的差异主要取决于植物本身的生理特性,且不同植物根系对Na吸收速率存在差异[13]。
氮是组成植物遗传物质和蛋白质的重要元素,植物营养主要来源于土壤氮素,分析土壤氮含量是评价土壤肥力水平和拟定氮肥合理施用的重要依据[36]。本研究中,与对照相比,大部分植物盐胁迫后的土壤全N和碱解N含量均增加,可能是盐胁迫导致土壤质地较粘重,土壤胶体多呈凝絮状态,有利于土壤粘粒与有机质结合,促进粘土矿物对NH4+的吸收和固定,使N含量增加[37-38];且植物根系和根际微生物在生理活动过程中也可以分泌出一定量的含N有机物。此外,由于几乎所有土壤氮都储存于有机质中,所以本研究中土壤全N和碱解N含量与有机质含量的变化规律相似,均随盐质量分数的增加而基本呈现先升高后降低的规律,这与Xue等[39]的研究结果相同。
磷是植物生长发育不可缺少的营养元素,以多种方式参与植物体内各种生理生化过程,是植物生产力的限制性养分元素,控制着陆地生态系统的生态过程[40]。本研究中,0.6%盐胁迫的各植物土壤全P含量均大于0.3%盐胁迫;除大红花外,龙船花和鹅掌藤的土壤有效P含量显著增加,表明低盐胁迫下植物能够吸收较多的有效P,导致土壤全P降低,但高盐胁迫影响了植物的吸收能力,从而保留更多的P于土壤中[41]。总体来看,有效P增幅大于全P增幅,这是由于土壤盐分的增加使土壤质地粘重,有机质增加。粘土矿物或有机物所吸持的吸附态磷(主要为H2PO4-、HPO42-)含量增加,致使根际磷酸酶活性增加,加快了土壤有机磷化合物持续矿化水解成无机态磷[13,42],从而促进有效P的增加;也可能是由于腐烂分解的有机物只是暂时固定土壤有效P,腐解后产生的有机酸根离子通过离子置换释放AlPO4、FePO4和草酸结合铝/铁离子等中的磷酸根离子,产生土壤有效P增加速率高于土壤的固磷速率的结果。
钾素是多种酶的活化剂,可提高蛋白质活性,是重要的土壤肥力指标[43]。本研究中,除0.3%盐胁迫的龙船花外,各植物的土壤全K含量均显著高于对照,且3种植物的土壤速效K含量也显著增加。这可能是由于土壤含盐量增加使植物体内的Na+含量大幅度增加,植物生长量随之下降,所以吸收的K量降低[23];此外,也可能是由于土壤Na+含量较高,Na+与K+之间出现拮抗作用而直接影响植物对K+的吸收,导致土壤速效钾含量升高,这与张立芙等[44]对黄瓜土壤养分特性的研究结果一致。
3.1.2 盐胁迫对植物土壤酶活性的影响
土壤酶是具有蛋白质性质的高分子生物催化剂,可促进土壤生物化学过程的物质循环与能量转化,主要包括枯落物的分解、腐殖质和有机化合物的分解与合成、土壤养分的固定与释放以及各种氧化还原反应[6,45],是土壤生态系统中保持物质和能量转化联系的纽带,可客观反映土壤肥力水平高低。过氧化氢酶可以破坏土壤生化反应过程中产生的H2O2,其活性的提高可以增强土壤氧化还原能力及好氧微生物的数量,保证土壤微生物的正常活动[46]。磷酸酶主要将土壤中有机磷转化成无机磷,是土壤中最活跃的酶类之一,在土壤磷循环中起重要作用,是表征土壤磷素有效化强度的重要指标[47]。土壤脲酶直接参与土壤中含氮化合物的转化,其活性可以评价土壤的供氮能力。
本研究中,0.6%盐胁迫下的龙船花和鹅掌藤的土壤过氧化氢酶活性显著低于对照,该盐胁迫下大红花的土壤酸性磷酸酶和脲酶活性也显著低于对照。一方面,可能是由于在高盐分胁迫条件下,土壤中的活体微生物活性数量减少,因此减少微生物向土壤中分泌的土壤酶量[48];另一方面,盐分改变了土壤环境,盐分产生的渗透胁迫及离子毒害都会抑制土壤酶的活性[49],影响了土壤酶功能的发挥[50-51];此外,高盐分的土壤可使根系分泌物产生连作效应,导致土壤环境的进一步恶化,使酶活性降低[52],这与李凤霞等[53]研究宁夏引黄灌区不同盐化程度土壤的过氧化氢酶和脲酶的活性变化结果一致。0.3%盐胁迫下3种植物的土壤磷酸酶活性均显著高于对照,土壤磷酸酶活性在低盐胁迫时表现增加。一方面,由于低盐胁迫下土壤含水量高,土壤容重小,渗透性强,随水分的运移促进酶类物质的活性[54];另一方面,可能是低盐胁迫使土壤微生物胞内酶与胞外酶的比例失调或改变了酶的构象,进而增强酶的活性[55],这与田幼华等[56]的研究结论一致。
3.1.3 土壤化学性质、土壤酶之间的相关性分析
大量研究表明,土壤化学性质、土壤酶之间存在密切联系[57-58]。本研究中,pH值与全N、碱解N和全P呈显著负相关关系,这主要是由于不同的酸碱环境影响养分的转化,这与赵永全等[59]的研究结果一致。有机质与有效P呈显著正相关关系,与速效K呈极显著正相关关系,说明土壤有机质在改善土壤化学性质和促进养分循环方面起着非常重要的作用[60]。全Na与交换性Na呈极显著正相关关系,全N与碱解N呈极显著正相关关系,这可能是由于土壤全量养分和有效养分相互促进的效果[61]。此外,全N和碱解N与全P呈极显著正相关关系,与全K呈极显著负相关关系,全P与全K呈极显著负相关关系,说明土壤N、P和K 三元素总量可在一定程度上表征它们的有效利用性[62]。脲酶与过氧化氢酶呈显著正相关关系,而与磷酸酶呈极显著负相关关系,说明土壤中氮化合物的水解和土壤的熟化程度同土壤中的氧化还原过程相互促进[49]。
3.2 结 论
(1)在高盐胁迫下,土壤全Na和交换性Na含量增长幅度较大,N、P和K含量基本也呈增加趋势,但增长幅度较小。此外,盐胁迫条件下,K+/Na+比值高的植物耐盐性强,但由于K+和Na+电化学性质的相似性[63],Na+与K+存在离子拮抗作用,因而Na+大幅度增加会使植物体内积累过多的Na+,导致植株吸K+困难,离子含量失衡。另外,高盐胁迫下的土壤过氧化氢酶、酸性磷酸酶和脲酶活性基本呈下降趋势。因此,高盐胁迫下土壤盐离子过高或酶活性的降低都会对园林植物的生长产生不利的影响[16]。
(2)偏酸的土壤影响N和P,有机质对有效P和速效K有促进作用;全P提高了全N和碱解N含量,全K对N和P有负面影响,脲酶增强了过氧化氢酶活性,却降低了磷酸酶活性。
