乌索酸对高糖诱导人系膜细胞损伤的作用
2018-07-26岳媛范秋灵都姝妍远方徐莉李琳刘楠姜奕王力宁
岳媛,范秋灵,都姝妍,远方,徐莉,李琳,刘楠,姜奕,王力宁
(1.中国医科大学附属第一医院肾内科,沈阳 110001;2.辽宁中医药大学附属医院肾内科,沈阳 110032;3.中国医科大学附属第一医院中心实验室,沈阳 110001)
糖尿病肾病 (diabetic nephropathy,DN) 是糖尿病的严重并发症,是导致终末期肾脏病的最常见原因[1],其发病机制尚未明确,尚无有效药物可以逆转或阻止其进展,已成为世界范围内亟待解决的公共卫生问题。系膜细胞是肾小球固有细胞,也是肾小球内最活跃的细胞,正常情况下无明显增殖,而在病理条件下则出现异常增殖,导致肾小球硬化。机械因素、代谢因素以及多种调节分子 (包括某些血管活性物质、细胞因子) 等与肾小球硬化的启动及进展密切相关[2],若不给予适当治疗肾小球硬化将进一步加重[3],最终导致终末期肾病。乌索酸 (ursolic acid,UA) 是一种来源于植物的五环三萜类化合物,广泛存在于浆果、水果及中草药中,具有抗肿瘤、降血糖、降血脂及抗动脉粥样硬化作用[4-6]。本研究探讨UA对高糖状态下系膜细胞凋亡的影响。
1 材料与方法
1.1 试剂和仪器
人肾小球系膜细胞和HMC4201培养基购自美国Sciencell公司;乌索酸 (89797) 购自美国Sigma公司;MTT粉、AnnexinV-FITC凋亡检测试剂盒购于北京宝赛生物技术有限公司;TrizolRNA提取试剂盒购自美国Invitrogen公司;Go Taqq PCR Master Mix购自美国Promega公司;兔抗Bcl-xl多克隆抗体购自美国Cell Signal Technology;兔 抗TGF-β1、FN、Bax、survivin多 克隆抗体、兔抗GAPDH多克隆抗体购自美国Proteintech公司;HRP标记羊抗兔IgG购自美国Abcam公司。Power Wave XS2全波长酶标仪 (美国Bio-Tek公司) 、FACS Calibur流式细胞仪 (美国BD公司) 、Mini Transblot 电转膜系统 (美国Bio-Blot公司) 、相差倒置显微镜 (日本Olympus公司) 、 Rotor-Gene 3000 PCR仪 (美国Agilent公司) 。
1.2 细胞培养
人系膜细胞复苏后,接种于培养瓶中,用MCM 4201完全培养基常规培养,置于37 ℃、饱和湿度5% CO2的孵箱内贴壁传代培养,隔天换液1次,取5~9代对数生长期细胞,消化后制成单细胞悬液,分为正常糖组、高糖组、高渗对照组、UA治疗A、B、C组。正常糖组5.5 mmol·L-1葡萄糖培养;高糖组30.0 mmol·L-1葡萄糖培养;高渗对照组5.5 mmol·L-1葡萄糖+24.5 mmol·L-1甘露醇培养;UA治疗A、B、C组分别30.0 mmol·L-1葡 萄 糖+0.5、1.0、2.0 µmol·L-1UA培养。6组均培养48 h后收集细胞。
1.3 方法
1.3.1 MTT法检测细胞增殖:收集对数期细胞,调整细胞悬液浓度,每孔加入150 µL培养液,铺板,5%CO2,37 ℃孵育至细胞单层铺满孔底 (96孔板) ,每孔加入刺激因素150 µL,分别孵育24 h、48 h后镜下观察。每孔加入20 µL 0.5%MTT溶液培养4 h后加入150 µL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,于570 nm处用酶联免疫检测仪测量各孔光密度 (OD) 值,计算细胞增殖率。
1.3.2 流式细胞仪检测细胞凋亡:采用Annexin-V/PI双染法。收集对数期细胞,调整细胞悬液浓度,每瓶加入5 mL培养液,调细胞密度至5×105/瓶。5%CO2,37 ℃孵育至细胞贴壁,换含有不同刺激因素的培养液,孵育48 h后每孔加600 µL胰蛋白酶消化,离心5 min后弃上清液,加入缓冲液(500 µL)悬浮细胞并移入流式管,同时加入PI (5 µL) 和AnnexinV-FITC(5 µL) 避光反应10 min,经流式细胞仪分析。
1.3.3 实时PCR检测Bcl-xl、survivin、Bax、转化生长因子β1 (transforming growth factor β1,TGF-β1) 、纤连蛋白 (fibronectin,FN) mRNA水平:按照总RNA提取试剂盒说明书提取各组细胞总NRA,紫外分光光度计测量RNA浓度,逆转录以及扩增反应按试剂盒说明书进行。FN正义链,5’-CCGCCATTAATGAGAGT GAT-3’,反 义 链,5’-AGTTAGTTGCGGCAGGAGAA G-3’,长度133bp;TGF-β1正义链,5’-GCCCTGGACA CCAACTATTGC-3’,反义链,5’-AGGCTCCAAATGT AGGGGCAGG-3’,长度161bp;survivin正义链,5’-GC TGGCTTCATCCATCCACTGC-3’,反义链,5’-CAATT TTGTTCTTGGCTCT-3’, 长度220bp; Bcl-xl正义链,5’-CCCAGAAAGGATACAGCTGG-3’,反义链,5’-GC GATCCGACTCACCAATAC-3’,长度448bp;Bax正义链,5’-GACGAGGATTGCTGATA-3’,反义链,5’-CTC AGCCCATATTCTTCCAG-3’,长度354bp;β-actin正义链,5’-CCATGTACGTTGCTATCCAGG-3’,反 义 链,5’-TCTCCTTAATGTCACGCACGA-3’,长 度252 bp;引物由日本TaKaRa公司合成。β-actin作为内参对照基因,实验数据处理用2-ΔΔCT方法进行,计算样本mRNA/β-actin mRNA的比值。
1.3.4 Western blotting检测各组细胞Bcl-xl、survivin、Bax、TGF-β1、FN蛋白表达:收集各组细胞,加入60µL蛋白裂解液及0.6 µL蛋白酶抑制剂,超声破碎20 min后离心5 min,吸取上清液,BCA法测定蛋白浓度,并调整至5 µg/µL;7.5%、10%、12% SDS-PAGE凝胶电泳后电转移至PVDF膜,5%脱脂奶粉室温封闭PVDF膜2 h,一抗4 ℃孵育过夜。TBST洗膜加二抗室温孵育2 h,TBST洗膜,滴加ECL发光液后观察。
1.4 统计学分析
2 结果
2.1 UA对系膜细胞增殖的抑制作用
结果显示,24 h各组系膜细胞增殖差异无统计学意义 (P > 0.05) ,48 h高糖组系膜细胞增殖率明显高于正常糖组 (P < 0.05);0.5、1.0、2.0 µmol·L-1UA治疗组系膜细胞的增殖率呈剂量依赖性下降,1.0µmol·L-1UA治疗组系膜细胞增殖率明显低于高糖组 (P < 0.05) ,细胞生长状态良好;2.0 µmol·L-1UA治疗组大部分系膜细胞已经死亡,增殖率明显低于高糖组 (P < 0.05) 。高渗对照组与正常糖组及0.5µmol·L-1UA治疗组系膜细胞增殖率无统计学差异(P > 0.05) 。提示1.0 µmol·L-1UA能明显抑制高糖诱导的系膜细胞增殖且细胞状态良好,可作为后续试验的最佳治疗剂量。见表1。
2.2 UA对系膜细胞凋亡的影响
表1 UA对系膜细胞增殖的影响 Tab.1 Effect of ursolic acid on mesangial cell proliferation

表1 UA对系膜细胞增殖的影响 Tab.1 Effect of ursolic acid on mesangial cell proliferation
1) P < 0.05 compared with normal glucose group;2) P < 0.05 compared with high glucose group.
Proliferation of mesangial cells 24 h 48 h Normal glucose group 2.66±0.04 3.66±0.32 High glucose group 2.70±0.02 4.33±0.231)High osmotic group 2.61±0.02 3.50±0.22 0.5 µmol·L-1 ursolic acid group 2.69±0.03 3.93±0.11 1.0 µmol·L-1 ursolic acid group 2.66±0.02 3.59±0.062)2.0 µmol·L-1 ursolic acid group 1.69±0.062) 0.67±0.162)Group
48 h各组系膜细胞凋亡率如图1所示。正常糖组、高糖组、高渗对照组、UA治疗组凋亡率分别为(12.21±0.51) %、 (12.98±0.27) %、 (15.04±0.33) %、(23.02±0.45) %。高糖组与正常糖组比较差异无统计学意义 (P > 0.05) ,而UA治疗组系膜细胞凋亡率显著高于高糖组 (P < 0.05) 。提示UA促进系膜细胞凋亡,抑制系膜细胞增殖。

图1 流式细胞仪分析UA对系膜细胞凋亡的影响Fig.1 Flow cytometry was performed to analyze the effect of ursolic acid on apoptosis in mesangial cells
2.3 UA对系膜细胞FN、TGF-β1、Bcl-xl、survivin、Bax表达的影响

图2 各组系膜细胞FN、TGF-β1、Bcl-xl、survivin、Bax mRNA的表达Fig.2 Effects of ursolic acid on the expression of FN,TGF-β1,Bcl-xl,survivin,and Bax mRNA in mesangial cells
结果显示,与正常糖组比较,高糖组FN、TGF-β1、Bcl-xl、survivin表达明显增高 (P < 0.05) ,Bax的表达无明显变化;与高糖组比较,UA治疗组FN、TGF-β1、Bcl-xl、survivin表达明显降低 (P < 0.05) ,Bax表达明显增高 (P < 0.05) 。见图2、3。
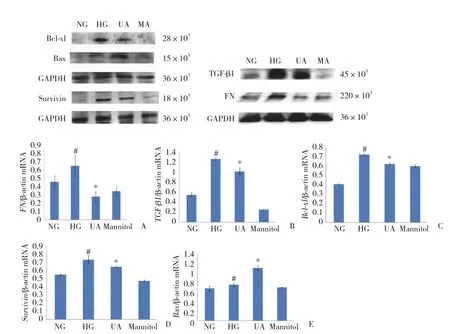
图3 各组系膜细胞FN、TGF-β1、Bcl-xl、survivin、Bax蛋白的表达Fig.3 Effects of ursolic acid on the expression of FN,TGF-β1,Bcl-xl,survivin,and Bax proteins in mesangial cells
3 讨论
DN是糖尿病最重要的并发症,同时也是一个连续的病理变化过程,早期阶段包括系膜细胞增殖、肾小球肥大、基底膜增厚及细胞外基质蛋白聚集,晚期阶段为肾小球硬化及间质纤维化,最终导致肾脏功能的丧失[7-10],细胞外基质蛋白(FN)、Ⅳ型胶原的过多沉积是DN肾脏进展性纤维化的病理基础。前期研究[7]发现高糖刺激人系膜细胞48 h,系膜细胞明显增殖,伴有细胞因子(TGF-β1)、细胞外基质蛋白(FN)的表达增强,提示高糖介导了系膜细胞的增殖与细胞外基质聚集,诱导系膜细胞损伤。近年研究[11-12]提示在DN早期细胞凋亡有利于清除过多的增殖细胞,延缓DN进程。
既往研究[13-14]发现UA诱导Bax/Bcl-2途径使线粒体释放细胞色素C (cytochrome C,CytC) 诱导肿瘤细胞凋亡。吴斌等[5]研究发现UA通过抑制AKt磷酸化促进线粒体释放CytC,诱导恶性肿瘤细胞Jurkat凋亡。刘玲等[14]研究发现三萜类化合物 (齐墩果酸)可使肝癌细胞Bcl-2表达减少,Bax表达增加,CytC在线粒体中表达降低而在胞质中表达增加,从而抑制肿瘤细胞的生长,诱导细胞凋亡,可能与其影响线粒体功能和能量代谢有关。本研究同样发现UA抑制Bcl-xL表达、促进Bax表达,Bax可与线粒体膜上的电压依赖性阴离子通道蛋白孔道形成复合物,释放CytC,参与并诱导细胞凋亡,缓解细胞损伤。因此UA可能通过促进Bax表达,参与并诱导线粒体释放CytC,启动系膜细胞凋亡,维持系膜细胞正常增殖水平。
综上所述,UA可以诱导系膜细胞早期凋亡,缓解高糖诱导的系膜细胞损伤,为UA对DN的早期治疗提供了新的实验依据。
